解题方法
1 . 将2L水滴入盛有1g过氧化钠固体的试管中(如图所示,夹持装置已略去),下列说法错误的是


| A.反应一段时间后,可观察到带火星的小木条复燃 |
| B.反应一段时间后,用手轻轻触摸试管外壁,感觉到烫手 |
| C.反应结束后,滴入几滴紫色石蕊试液至试管,试管中溶液颜色由无色变为红色 |
| D.反应结束后,溶液中的金属阳离子只有Na+ |
您最近一年使用:0次
2023-11-08更新
|
60次组卷
|
2卷引用:吉林省十一校联考2023-2024学年高一上学期11月期中考试化学试题
解题方法
2 . 某同学为了验证硫铁矿(主要成分为FeS2。含有少量的碳)焙烧产物(产生的气体是SO2,CO2),设计如下装置进行实验:
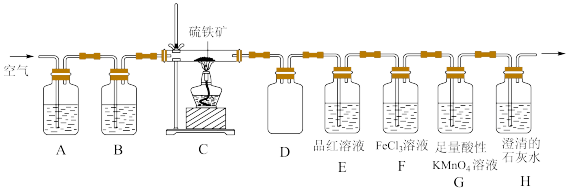
回答下列问题:
(1)装置A、B中的试剂分别是_______ 、_______ 。
(2)装置D的作用是_______ 。
(3)验证焙烧后气体产物的实验现象分别为_______ 、_______ ;若F中颜色发生改变,写出产生颜色变化反应的离子方程式:_______ 。取F中反应后的溶液于洁净的试管中。滴加少量KSCN溶液,溶液不变红,说明溶液中_______ (填“含有”或“不含有”)Fe3+;再继续滴加少量氯水,溶液也不变红。产生这种现象的原因可能是_______ 。
(4)G中盛放足量酸性KMnO4溶液的目的是_______ (用离子方程式表示)。
(5)反应完成后经检验,C中剩余固体物质只有Fe2O3,写出FeS2焙烧反应的化学方程式:_______ 。

回答下列问题:
(1)装置A、B中的试剂分别是
(2)装置D的作用是
(3)验证焙烧后气体产物的实验现象分别为
(4)G中盛放足量酸性KMnO4溶液的目的是
(5)反应完成后经检验,C中剩余固体物质只有Fe2O3,写出FeS2焙烧反应的化学方程式:
您最近一年使用:0次
3 . 室温下,将充满NO2的试管倒立在水中,实验现象如图。下列分析不正确 的是
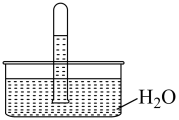
| A.NO2易溶于水,不能用排水法收集 |
| B.试管中剩余的无色气体是未溶解的NO2 |
| C.取试管中的溶液,滴加紫色石蕊溶液,溶液显红色,是因为NO2与H2O反应生成了酸 |
| D.向试管中再缓缓通入一定量的O2,试管中的液面上升 |
您最近一年使用:0次
2022-04-10更新
|
1131次组卷
|
12卷引用:吉林省长春汽车经济技术开发区第三中学 2021-2022学年 高一下学期线上月考化学试题
吉林省长春汽车经济技术开发区第三中学 2021-2022学年 高一下学期线上月考化学试题北京市西城区2022届高三一模化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)专项06 元素及其化合物-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(北京卷)北京市第八十中学2021-2022学年高一下学期期中考试化学试题黑龙江省齐齐哈尔市八校联合体2022-2023学年高三上学期期中考试化学试题北京理工大学附属中学2022-2023学年高三上学期12月月考化学试题北京市第十五中学2023-2024学年高三上学期期中考试化学试题天津市第五十四中学2023-2024学年高一下学期第一次月考 (3 月 )化学试卷河南省漯河市高级中学2023-2024学年高一下学期3月月考化学试题北京市清华大学附属中学朝阳学校2023-2024学年高一下学期3月月考化学
4 . 某化学兴趣小组探究SO2与Ca( NO3)2溶液的反应。
I.实验一:用如下装置制备SO2,然后将SO2通入Ca(NO3)2溶液中,有白色沉淀M产生。

(1)固体a是_______ (写名称) 。
(2)装置D的作用是_______ 。
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是_______ 。
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4也可能是二者混合物。(查阅资料得知:CaSO4微溶于水;CaSO3难溶于水。)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,利用倾析法倾倒出上层清液,抽滤,洗涤得到沉淀M。取沉淀M少许于试管中,加入过量的稀HCI,充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)适合利用倾析法将下列物质与水分离的是_______
(5)取加入过量稀HCl静置后的上层溶液于试管中,加入一种试剂,可进一步证实沉淀M中含有CaSO3,则所加试剂及现象是_______ 。
实验三:探究SO 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为_______ 。
(7)从上述实验现象可得出对SO2氧化起主要作用的是_______ (填O2或NO ),其理由是
),其理由是_______ 。
I.实验一:用如下装置制备SO2,然后将SO2通入Ca(NO3)2溶液中,有白色沉淀M产生。

(1)固体a是
(2)装置D的作用是
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4也可能是二者混合物。(查阅资料得知:CaSO4微溶于水;CaSO3难溶于水。)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,利用倾析法倾倒出上层清液,抽滤,洗涤得到沉淀M。取沉淀M少许于试管中,加入过量的稀HCI,充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)适合利用倾析法将下列物质与水分离的是_______
| A.易沉淀固体 | B.胶状物质 | C.大颗粒沉淀 | D.絮状物质 |
实验三:探究SO
 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为
(7)从上述实验现象可得出对SO2氧化起主要作用的是
 ),其理由是
),其理由是
您最近一年使用:0次
2022-02-17更新
|
614次组卷
|
2卷引用:吉林省长春市博硕学校(原北师大长春附属学校)2021-2022学年高二下学期期末考试化学试题
名校
解题方法
5 . 为探究实验室中久置的氢氧化钠固体的成分,进行如下探究实验。
[对固体猜想]猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3;
猜想Ⅲ:是NaOH和Na2CO3混合物。
[实验和推断]

回答下列问题:
(1)若现象a为有气泡产生,则加入的A溶液可以是___________ ;
a.稀盐酸 b.NaHSO4溶液 c.NaHCO3溶液
产生气泡的反应的离子方程式是___________ ;
(2)若A是Ca(OH)2溶液,现象a为产生白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为___________ (填化学式),该实验___________ (填“能”或“不能”)说明样品中有NaOH。
(3)若A是CaCl2溶液,实验现象a为___________ ,现象b为___________ ,则猜想Ⅱ成立。
(4)久置的氢氧化钠变质的原因是(用化学方程式表示)___________ 。
[对固体猜想]猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3;
猜想Ⅲ:是NaOH和Na2CO3混合物。
[实验和推断]

回答下列问题:
(1)若现象a为有气泡产生,则加入的A溶液可以是
a.稀盐酸 b.NaHSO4溶液 c.NaHCO3溶液
产生气泡的反应的离子方程式是
(2)若A是Ca(OH)2溶液,现象a为产生白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为
(3)若A是CaCl2溶液,实验现象a为
(4)久置的氢氧化钠变质的原因是(用化学方程式表示)
您最近一年使用:0次
名校
6 . 氮氧化物(NOx)是大气污染物之一,处理工业废气中的NOx对于环境保护具有重要的意义。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。_______ ;装置B内的试剂是_______ 。
②装置D中发生反应的离子方程式是_______ ,铜丝可抽动的优点是_______ 。
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为_______ 。
(2)用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知过程中发生的反应有:2NaOH+NO+NO2=2NaNO2+H2O;2NaOH+2NO2=NaNO3+NaNO2+H2O
①用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图:
用NaOH溶液吸收氮氧化物的最佳条件为:α=_______ ,c(NaOH)=_______ 。
②若一定体积的NOx被250mL2mol·L-1的NaOH溶液恰好完全吸收,溶液质量增加19.8g,则x的值为_______ 。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
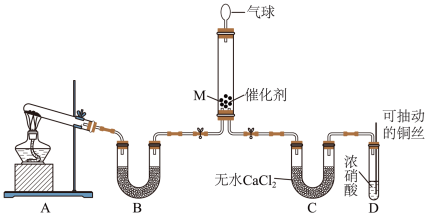
②装置D中发生反应的离子方程式是
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为
(2)用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知过程中发生的反应有:2NaOH+NO+NO2=2NaNO2+H2O;2NaOH+2NO2=NaNO3+NaNO2+H2O
①用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图:
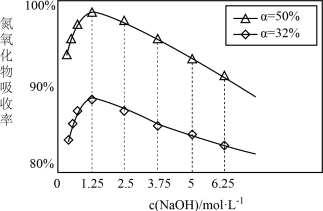
用NaOH溶液吸收氮氧化物的最佳条件为:α=
②若一定体积的NOx被250mL2mol·L-1的NaOH溶液恰好完全吸收,溶液质量增加19.8g,则x的值为
您最近一年使用:0次
2021-08-23更新
|
735次组卷
|
11卷引用:吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷
吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷 山东省聊城市2020-2021学年高一下学期期末考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二下学期第一次月考化学试题山东省临沂第一中学2021-2022学年高一下学期第二次教学检测(4月线上)化学试题河北省定州市第二中学2021-2022学年高一下学期期末考试化学试题河北省石家庄精英中学2022-2023高二上学期开学考试化学试题陕西西安三中2022-2023学年高一下学期第二次月考化学试题“贵百河”2023-2024学年高二上学期10月新高考月考测试化学试题广东省高州市第四中学2023-2024学年高一下学期3月月考化学试题江苏省无锡市江阴市四校联考2023-2024学年高一下学期4月期中考试化学试题广州市第七十五中学2023-2024学年高一下学期第一次阶段考试化学试题
解题方法
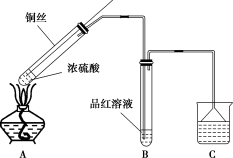
7 . 某同学用如图装置(夹持装置略)探究铜丝与过量浓硫酸的反应。
回答下列问题:
(1)铜与浓硫酸反应的化学方程式为___ 。
(2)B中观察到的现象为___ 。
(3)C中应加入的试剂为___ ,倒置漏斗的作用是___ 。
(4)与向浓硫酸中直接加入铜片相比,该装置用可上下移动的铜丝,优点是___ 。

回答下列问题:
(1)铜与浓硫酸反应的化学方程式为
(2)B中观察到的现象为
(3)C中应加入的试剂为
(4)与向浓硫酸中直接加入铜片相比,该装置用可上下移动的铜丝,优点是
您最近一年使用:0次
2021-05-26更新
|
267次组卷
|
4卷引用:吉林省延边州汪清县第六中学2021-2022学年高一下学期期末考试化学试题
8 . 某同学为验证酸性:醋酸>碳酸>苯酚,经仔细考虑,设计如下实验装置,请回答下列问题:
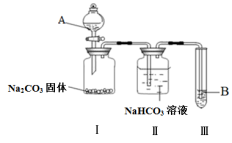
(1)A处的试剂是_______ (填序号,下同),B处的试剂是_______ 。
①醋酸溶液 ②CH3COONa溶液 ③苯酚溶液 ④苯酚钠溶液
(2)装置II中饱和NaHCO3溶液的作用_______ 。
(3)能证明三种酸的酸性强弱的现象_______ 。
(4)写出装置III中发生反应的化学方程式_______ 。

(1)A处的试剂是
①醋酸溶液 ②CH3COONa溶液 ③苯酚溶液 ④苯酚钠溶液
(2)装置II中饱和NaHCO3溶液的作用
(3)能证明三种酸的酸性强弱的现象
(4)写出装置III中发生反应的化学方程式
您最近一年使用:0次
2021-04-29更新
|
684次组卷
|
4卷引用:吉林省长春市第二十中学2020-2021学年高二下学期第二次质量测试化学试题
吉林省长春市第二十中学2020-2021学年高二下学期第二次质量测试化学试题北京市丰台区2020-2021学年高二下学期期中联考化学(B卷)试题(已下线)作业07 醇 酚-2021年高二化学暑假作业(人教版2019)(已下线)第08讲 酚(讲义)-【寒假自学课】2023年高二化学寒假精品课(人教版2019选择性必修3)



