名校
解题方法
1 . 某实验小组利用下图装置模拟古法硫酸生产方法并进行SO2性质探究。

已知A中反应的化学方程式:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。
Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。
完成下列填空:
(1)C装置中覆盖食用油的目的是___________ ;D装置的作用___________ 。B中所得硫酸溶液的质量分数理论值为___________ (保留三位小数)。
为探究SO2与钡盐溶液的反应,在装置C中先后四次加入不同的溶液:
得到如下pH-t图:
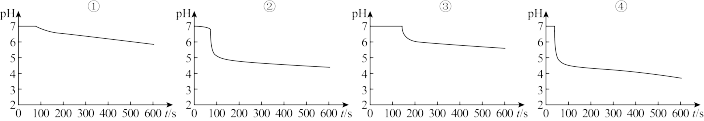
(2)曲线①呈缓慢下降趋势,这是因为___________ 。曲线②出现骤降,表明溶液中生成了___________ (填物质名称)。对比分析上述四组数据,可得出的结论是_________ (任写2条)。
(3)为对排气法收集到的SO2气体进行含量测定,将2240mL气体(已折算为标准状况)通入足量的Ba(NO3)2溶液中,经过滤、洗涤、烘干,最终得到沉淀21.436g。则SO2气体的体积分数为_______ 。若该实验数据较实际值偏大,则可能的原因是________ (选填编号)。
a.气体通入速率过快 b.沉淀未进行恒重操作
c.收集的气体中有CO2 d.未用食用油覆盖液面

已知A中反应的化学方程式:2FeSO4·7H2O
 Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。
Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。完成下列填空:
(1)C装置中覆盖食用油的目的是
为探究SO2与钡盐溶液的反应,在装置C中先后四次加入不同的溶液:
| ① | ② | ③ | ④ |
| 已煮沸的BaCl2溶液 | 未煮沸的BaCl2溶液 | 已煮沸的Ba(NO3)2溶液 | 未煮沸的Ba(NO3)2溶液 |
| 注:锥形瓶中溶液体积相同,钡盐溶液浓度相同;油层厚度一致,通入SO2流速一致。 | |||

(2)曲线①呈缓慢下降趋势,这是因为
(3)为对排气法收集到的SO2气体进行含量测定,将2240mL气体(已折算为标准状况)通入足量的Ba(NO3)2溶液中,经过滤、洗涤、烘干,最终得到沉淀21.436g。则SO2气体的体积分数为
a.气体通入速率过快 b.沉淀未进行恒重操作
c.收集的气体中有CO2 d.未用食用油覆盖液面
您最近一年使用:0次
2022-01-15更新
|
1079次组卷
|
3卷引用:上海市浦东新区2022届高三一模化学试题
上海市浦东新区2022届高三一模化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)黑龙江省哈尔滨市第九中学校2022届高考最后押题卷(一)化学试题
名校
2 . 二氧化氯(ClO2)气体是一种高效消毒灭菌剂,但其稳定性较差,可转化为 NaClO2保存。分别利用吸收法和电解法两种方法得到较稳定的NaClO2。其工艺流程示意图如图所示:
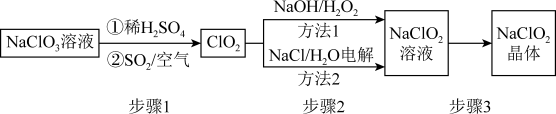
已知:①纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
②长期放置或高于60℃时NaClO2易分解生成 NaClO3和 NaCl。
(1)通入空气的作用是
(2)方法1中,反应的离子方程式是
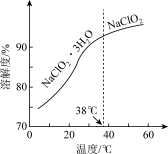
(3)NaClO2的溶解度曲线如图所示,步骤3中从NaClO2溶液中获得NaClO2的操作是
(4)为测定制得的晶体中NaClO2的含量,做如下操作:
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的KI晶体,再滴入适量的稀 H2SO4,充分反应。将所得混合液配成100mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用bmol·L-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为c mL(已知:I2+2S2O →2I-+S4O
→2I-+S4O )。样品中NaClO2的质量分数为
)。样品中NaClO2的质量分数为
(5)NaClO2使用时,加入稀盐酸即可速得到ClO2。但若加入盐酸浓度过大,则气体产物中Cl2的含量会增大,原因是
您最近一年使用:0次
2022-03-18更新
|
395次组卷
|
2卷引用:复旦大学附属中学2022届高三下学期 教学质量检测(二模)化学等级试卷
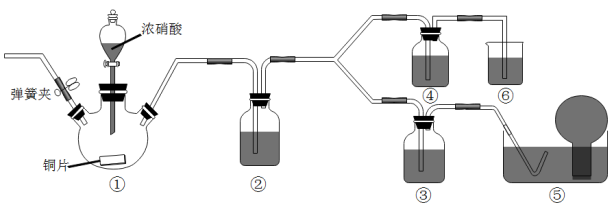
3 . 某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
已知:氢氧化钠溶液不与NO反应,能与NO2反应2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是_______ 、_______ 、_______
(2)滴加浓硝酸之前的操作是先检验装置的气密性,再加入药品,打开弹簧夹后_______
(3)装置①中发生反应的离子方程式是_______
(4)装置②的作用是_______ ,发生反应的化学方程式是 _______
(5)该小组得出的结论依据的试验现象是_______
(6)试验结束后,同学们发现装置①中溶液到绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体,同学们分别设计了以下4个试验来判断两种看法是否正确。这些方案中可行的是_______ (填序号字母)
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
已知:氢氧化钠溶液不与NO反应,能与NO2反应2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(2)滴加浓硝酸之前的操作是先检验装置的气密性,再加入药品,打开弹簧夹后
(3)装置①中发生反应的离子方程式是
(4)装置②的作用是
(5)该小组得出的结论依据的试验现象是
(6)试验结束后,同学们发现装置①中溶液到绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体,同学们分别设计了以下4个试验来判断两种看法是否正确。这些方案中可行的是
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
您最近一年使用:0次
2022-06-11更新
|
406次组卷
|
4卷引用:3.2.2 铵盐和硝酸-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)
(已下线)3.2.2 铵盐和硝酸-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)广州大学附属中学2021-2022学年高一下学期5月月考化学试题湖南省衡阳市2022-2023学年高一下学期期末检测化学试题(已下线)专题01 硫、氮、硅及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)
4 . 土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,主要原因是发酵过程产生的菌种多达百种,难以控制而产生对神经有毒的甲醇等物质。科学酿酒需加SO2等辅料,我国国家标准(GB27602014)规定葡萄酒中SO2的残留量≤0.25 g·L-1。
(1)葡萄酒中添加SO2的作用可能是_______。
Ⅰ.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3.设计如图1的实验:
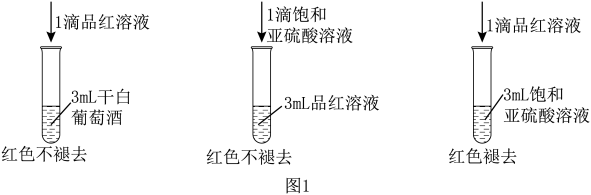
(2)SO2水溶液显酸性,用离子方程式说明_______ 。
(3)甲同学得出的实验结论是干白葡萄酒中不含SO2或H2SO3.这个结论_______ (填“成立”或“不成立”),理由是_______ 。
Ⅱ.实验方案二
用如图实验装置探究二氧化硫的氧化性。按图2充入气体,连接装置,关闭旋塞1和2。
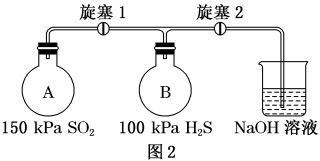
(4)打开旋塞1,可观察到的主要现象是_______ 。
(5)若A瓶和B瓶的体积相等,恢复到常温,关闭旋塞1,打开旋塞2,可观察到的现象是_______ ,此时B瓶中可能发生反应的化学方程式为_______ 。
(6)若图2装置中充入H2S和SO2的混合气体共1mol,充分反应后,所得氧化产物比还原产物多0.25mol,则原混合气体中H2S和SO2的体积比可能是_______。
(7)在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为_______ mol/L。
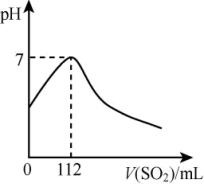
在上述实验中,采用铜和浓硫酸制备SO2,应放置在下列_______ (填序号)中进行反应。

探究二氧化硫的还原性
(8)图2装置中将氢氧化钠溶液换为_______ 溶液,即可验证二氧化硫还原性。
(9)将SO2气体通入下列装置中,一定不可能产生沉淀的共_______ 项。(填写数字)

(10)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物HCl和H2SO4。请写出该反应的化学方程式_______ 。
Ⅲ.实验方案三
搭建图示装置为测定某葡萄酒中SO2的含量:
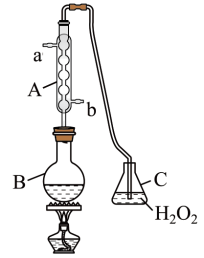
实验步骤如下:在B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应。除去C中剩余的H2O2后,用0.090 0 mol·L-1 NaOH溶液测定反应生成的酸,消耗NaOH溶液25.00 mL。
(11)C中通入SO2发生反应的化学方程式为_______ 。
(12)通过计算求出该葡萄酒中SO2的含量(以g·L-1为单位,即每升葡萄酒中含有SO2的质量)_______ 。
(13)该测定结果比实际值偏高,可能的原因是_______ 。
(14)针对此原因提出一条改进措施:_______ 。
(1)葡萄酒中添加SO2的作用可能是_______。
| A.氧化细菌 | B.抗氧化 | C.漂白 | D.增酸作用 |
Ⅰ.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3.设计如图1的实验:

(2)SO2水溶液显酸性,用离子方程式说明
(3)甲同学得出的实验结论是干白葡萄酒中不含SO2或H2SO3.这个结论
Ⅱ.实验方案二
用如图实验装置探究二氧化硫的氧化性。按图2充入气体,连接装置,关闭旋塞1和2。

(4)打开旋塞1,可观察到的主要现象是
(5)若A瓶和B瓶的体积相等,恢复到常温,关闭旋塞1,打开旋塞2,可观察到的现象是
(6)若图2装置中充入H2S和SO2的混合气体共1mol,充分反应后,所得氧化产物比还原产物多0.25mol,则原混合气体中H2S和SO2的体积比可能是_______。
A.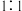 | B. | C.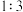 | D.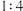 |

在上述实验中,采用铜和浓硫酸制备SO2,应放置在下列

探究二氧化硫的还原性
(8)图2装置中将氢氧化钠溶液换为
(9)将SO2气体通入下列装置中,一定不可能产生沉淀的共

(10)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物HCl和H2SO4。请写出该反应的化学方程式
Ⅲ.实验方案三
搭建图示装置为测定某葡萄酒中SO2的含量:

实验步骤如下:在B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应。除去C中剩余的H2O2后,用0.090 0 mol·L-1 NaOH溶液测定反应生成的酸,消耗NaOH溶液25.00 mL。
(11)C中通入SO2发生反应的化学方程式为
(12)通过计算求出该葡萄酒中SO2的含量(以g·L-1为单位,即每升葡萄酒中含有SO2的质量)
(13)该测定结果比实际值偏高,可能的原因是
(14)针对此原因提出一条改进措施:
您最近一年使用:0次
名校
解题方法
5 . 人类的生产和生活都离不开金属。金属材料的使用作为一个时代的标志,见证了人类文明发展的过程,历史上人类冶炼不同金属的大致年代如图所示:
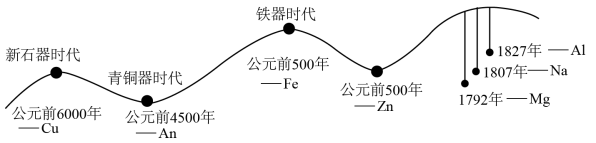
(1)由图可知:人类最早使用的合金是________ ,通过敲打可将金属材料打制成不同的形状,是利用了金属的________ 性。含碳量在0.03%~2%之间某合金,是目前使用量最大的合金,这种合金是________ (填字母)。
A.铝合金 B.镁合金 C.生铁 D,钢
(2)北宋沈插在《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧,挹其水熬之则成胆矾,熬胆矾铁釜,久之亦化为铜”。下列叙述正确的是________ (填字母)。
A.“苦泉”的溶质之一: ;
;
B.“挹其水熬之”:蒸发溶剂;
C.“熬胆矾铁釜,久之亦化为铜”:发生分解反应。
(3)铝的使用距今仅200年左右,现如今铝的年产量得到大幅度的提高。铝虽然较活泼,但抗腐蚀性能好,原因是________ (用化学方程式表示)。
(4)某溶液中含有 、
、 、
、 、
、 等离子,向其中加入过量
等离子,向其中加入过量 后,过滤,将滤渣投入足量盐酸中,所得溶液与原溶液相比,溶液中大量减少的正离子是
后,过滤,将滤渣投入足量盐酸中,所得溶液与原溶液相比,溶液中大量减少的正离子是________ (填字母),大量增加的离子有________ (填化学式)。
A. B.
B. C.
C. D.
D.
工业上用废铁皮制取铁红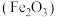 的部分流程示意图如下:
的部分流程示意图如下:
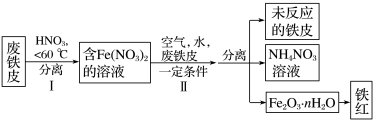
(5)步骤II中发生反应: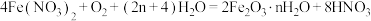 ,反应产生的
,反应产生的 又可将废铁皮中的铁转化为
又可将废铁皮中的铁转化为 ,该反应的化学方程式为:
,该反应的化学方程式为:________ 。
 可制取新型、高效水处理剂——高铁酸钾
可制取新型、高效水处理剂——高铁酸钾 。
。
________ ________
________ ________
________ ________
________ (高铁酸钾)+________
(高铁酸钾)+________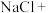 ________
________
(6)配平上述反应,并用单线桥法表示反应过程中的电子转移方向和数目________ 。
(7)此过程中氧化剂是________ (填化学式)。
(8)高铁酸钾 是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用有
是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用有________ 、________
工业上常用铝质容器盛装冷浓酸,为研究铝质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(9)将铝片放入氢氧化钠溶液中可去除表面氧化膜,反应的离子方程式为:________ 。
(10)将已除去表面氧化膜的铝片继续置于氢氧化钠溶液中,迅速产生大量气泡,反应的化学方程式为:________ 。反应过程中氧化剂与还原剂的物质的量之比为________ 。
(11)另取一同样已除去表面氧化膜的铝片放入冷浓硫酸中,10分钟后,移入硫酸铜溶液中,片刻后取出观察,铝片表面无明显变化,其原因是________ 。
(12)另称取铝片6.0g放入15.0mL浓硫酸中,加热,充分应后收集到气体X;甲同学取448mL(标准状况)气体X通入足量过氧化氢溶液中,然后再加入足量 溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中
溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中 的体积分数为
的体积分数为________ 。
分析上述实验中 体积分数的结果,丙同学认为气体X中还可能含量有
体积分数的结果,丙同学认为气体X中还可能含量有 ;为此设计了下列探究实验装置(图中央持仪器省略)。
;为此设计了下列探究实验装置(图中央持仪器省略)。
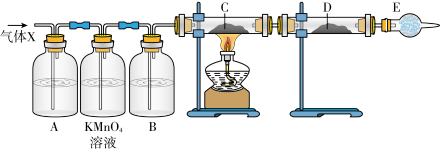
(13)丙同学认为还可能产生氢气的理由是________ 。
(14)A中试剂可选用________。
(15)B中加入的试剂是________ ,E的作用是________ 。
(16)可以证明气体X中含有氢气的实验现象是:________ 。

(1)由图可知:人类最早使用的合金是
A.铝合金 B.镁合金 C.生铁 D,钢
(2)北宋沈插在《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧,挹其水熬之则成胆矾,熬胆矾铁釜,久之亦化为铜”。下列叙述正确的是
A.“苦泉”的溶质之一:
 ;
;B.“挹其水熬之”:蒸发溶剂;
C.“熬胆矾铁釜,久之亦化为铜”:发生分解反应。
(3)铝的使用距今仅200年左右,现如今铝的年产量得到大幅度的提高。铝虽然较活泼,但抗腐蚀性能好,原因是
(4)某溶液中含有
 、
、 、
、 、
、 等离子,向其中加入过量
等离子,向其中加入过量 后,过滤,将滤渣投入足量盐酸中,所得溶液与原溶液相比,溶液中大量减少的正离子是
后,过滤,将滤渣投入足量盐酸中,所得溶液与原溶液相比,溶液中大量减少的正离子是A.
 B.
B. C.
C. D.
D.
工业上用废铁皮制取铁红
 的部分流程示意图如下:
的部分流程示意图如下:
(5)步骤II中发生反应:
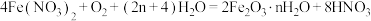 ,反应产生的
,反应产生的 又可将废铁皮中的铁转化为
又可将废铁皮中的铁转化为 ,该反应的化学方程式为:
,该反应的化学方程式为: 可制取新型、高效水处理剂——高铁酸钾
可制取新型、高效水处理剂——高铁酸钾 。
。________
 ________
________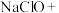 ________
________ ________
________ (高铁酸钾)+________
(高铁酸钾)+________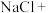 ________
________
(6)配平上述反应,并用单线桥法表示反应过程中的电子转移方向和数目
(7)此过程中氧化剂是
(8)高铁酸钾
 是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用有
是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用有工业上常用铝质容器盛装冷浓酸,为研究铝质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(9)将铝片放入氢氧化钠溶液中可去除表面氧化膜,反应的离子方程式为:
(10)将已除去表面氧化膜的铝片继续置于氢氧化钠溶液中,迅速产生大量气泡,反应的化学方程式为:
(11)另取一同样已除去表面氧化膜的铝片放入冷浓硫酸中,10分钟后,移入硫酸铜溶液中,片刻后取出观察,铝片表面无明显变化,其原因是
(12)另称取铝片6.0g放入15.0mL浓硫酸中,加热,充分应后收集到气体X;甲同学取448mL(标准状况)气体X通入足量过氧化氢溶液中,然后再加入足量
 溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中
溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中 的体积分数为
的体积分数为分析上述实验中
 体积分数的结果,丙同学认为气体X中还可能含量有
体积分数的结果,丙同学认为气体X中还可能含量有 ;为此设计了下列探究实验装置(图中央持仪器省略)。
;为此设计了下列探究实验装置(图中央持仪器省略)。
(13)丙同学认为还可能产生氢气的理由是
(14)A中试剂可选用________。
| A.溴水 | B.品红溶液 | C.氢氧化钠溶液 | D.饱和食盐水 |
(16)可以证明气体X中含有氢气的实验现象是:
您最近一年使用:0次
6 . 打印机墨粉中Fe3O4的含量是衡量墨粉质量优劣的重要指标之一,为测定某墨粉Fe3O4的含量,同学们在化学实验室中进行了如下实验。

已知:①墨粉中除Fe3O4外,其余成分既不含铁元素,也不溶于水、不与酸反应
②酸性高锰酸钾溶液呈紫红色,Mn2+溶液无色
(1)列举两个生成磁性氧化铁反应的化学方程式:___________ 、___________ 。
(2)检验Fe2+:
i.[实验原理]_______Fe2++______ +______H+=______Fe3++______Mn2++______H2O
+______H+=______Fe3++______Mn2++______H2O
配平上述离子方程式,并标出电子的转移方向和数目___________ 。
ii.[实验操作]取第一份溶液少许,向其中滴加酸性KMnO4溶液,振荡,观察到溶液紫色______ 。
iii.【实验结论】溶液中含Fe2+,同时证明Fe2+具有___________ 性。
(3)测定Fe3O4的含量:

i.加入足量氯水的目的是___________ ,有关反应的离子方程式是___________ 。
ii.加入足量NaOH溶液后观察到的现象是___________ 。
iii.沉淀加热时发生反应的化学方程式是___________ 。

已知:①墨粉中除Fe3O4外,其余成分既不含铁元素,也不溶于水、不与酸反应
②酸性高锰酸钾溶液呈紫红色,Mn2+溶液无色
(1)列举两个生成磁性氧化铁反应的化学方程式:
(2)检验Fe2+:
i.[实验原理]_______Fe2++______
 +______H+=______Fe3++______Mn2++______H2O
+______H+=______Fe3++______Mn2++______H2O配平上述离子方程式,并标出电子的转移方向和数目
ii.[实验操作]取第一份溶液少许,向其中滴加酸性KMnO4溶液,振荡,观察到溶液紫色
iii.【实验结论】溶液中含Fe2+,同时证明Fe2+具有
(3)测定Fe3O4的含量:

i.加入足量氯水的目的是
ii.加入足量NaOH溶液后观察到的现象是
iii.沉淀加热时发生反应的化学方程式是
您最近一年使用:0次
名校
解题方法
7 . 铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
【查阅资料】
Ⅰ.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
Ⅱ.KSCN中的硫元素为-2价。
Ⅲ. 受热分解生成
受热分解生成 。
。
实验Ⅰ.检验该补铁剂中铁元素的价态。
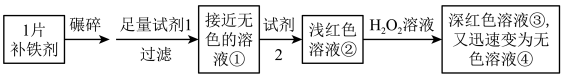
(1)将补铁剂碾碎的目的是_______ 。
(2)试剂1是_______ ,试剂2是_______ 。
(3)加入试剂2后溶液变为浅红色,说明溶液①中含有_______ 。
(4)能证明溶液①中含有 的实验现象是
的实验现象是_______ 。
(5)补全在上述条件下 与
与 发生反应的离子方程式:
发生反应的离子方程式: _______ ______ _______
_______ _______
_______ _______+______
_______+______
(6)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的 与
与 发生了化学反应。甲同学猜测的理论依据是
发生了化学反应。甲同学猜测的理论依据是_______ 。
实验Ⅱ.测定该补铁剂中铁元素的含量。
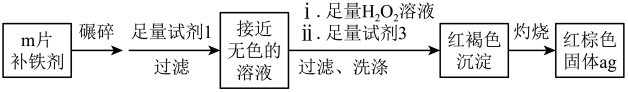
(7) 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是_______ 。
(8)计算每片该补铁剂含铁元素的质量为_______ g.
【查阅资料】
Ⅰ.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
Ⅱ.KSCN中的硫元素为-2价。
Ⅲ.
 受热分解生成
受热分解生成 。
。实验Ⅰ.检验该补铁剂中铁元素的价态。

(1)将补铁剂碾碎的目的是
(2)试剂1是
(3)加入试剂2后溶液变为浅红色,说明溶液①中含有
(4)能证明溶液①中含有
 的实验现象是
的实验现象是(5)补全在上述条件下
 与
与 发生反应的离子方程式:
发生反应的离子方程式:  _______
_______ _______
_______ _______+______
_______+______(6)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的
 与
与 发生了化学反应。甲同学猜测的理论依据是
发生了化学反应。甲同学猜测的理论依据是实验Ⅱ.测定该补铁剂中铁元素的含量。

(7)
 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是(8)计算每片该补铁剂含铁元素的质量为
您最近一年使用:0次
2022-04-23更新
|
274次组卷
|
2卷引用:上海市实验学校2021-2022学年高一下学期线上教学阶段检测化学试题
解题方法
8 . 二氧化硫及硫酸盐在生活、生产中有重要应用。回答下列问题:
I.测定晶体结晶水含量的实验中常选择胆矾作为实验对象进行研究。
(1)结合已有知识及表格中信息解释原因_______ 。
II.《唐本草》和《天工开物》等古籍均记载中国很早就焙烧绿矾制备铁红(主要成分Fe2O3,是一种传统颜料的着色剂)和含硫气体等。
(2)对含硫气体的成分,某学生做出三种假设:①含硫气体为SO2;②含硫气体为SO3;③含硫气体为SO2和SO3。从上述三种假设中挑选一种不合理的,做出解释:_______ 。
(3)将盛有绿矾的硬质玻璃管A按下图装置,加强热使其充分反应。
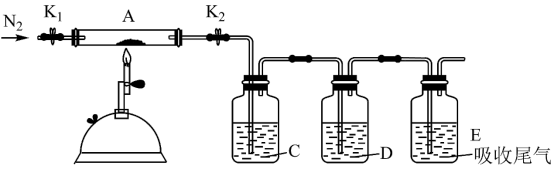
C、D中的溶液依次为_______ 、_______ (选填字母编号)。
a.品红溶液 b.Ba(OH)2溶液 c.盐酸酸化的BaCl2溶液 d.浓硫酸
III.SO2常用于食品加工中作防腐剂、漂白剂。我国规定葡萄酒中SO2最大使用量为0.26g·L-1。某研究小组测定葡萄酒中SO2含量的方法为:在300.00mL葡萄酒中加入适量稀硫酸,加热使SO2全部逸出,并用H2O2完全吸收,再将吸收了SO2的H2O2充分加热后,用0.0900mol·L-1NaOH溶液进行滴定。
(4)H2O2吸收SO2的化学方程式为_______ 。“将吸收了SO2的H2O2充分加热”目的是_______ 。
(5)若选用酚酞作指示剂,滴定终点的现象为_______ 。滴定终点时消耗NaOH溶液25.00mL,该葡萄酒中的SO2含量为_______ g·L-1。该葡萄酒的此项指标被判定为_______ 。(选填:合格、不合格)
I.测定晶体结晶水含量的实验中常选择胆矾作为实验对象进行研究。
(1)结合已有知识及表格中信息解释原因
| 明矾 | 胆矾 | 绿矾 | |
| 化学式 | KAl(SO4)2·12H2O | CuSO4·5H2O | FeSO4·7H2O |
| 色态 | 无色透明 | 蓝色 | 浅绿色 |
| 失去全部结晶水温度(℃) | 200 | 200 | 300 |
II.《唐本草》和《天工开物》等古籍均记载中国很早就焙烧绿矾制备铁红(主要成分Fe2O3,是一种传统颜料的着色剂)和含硫气体等。
(2)对含硫气体的成分,某学生做出三种假设:①含硫气体为SO2;②含硫气体为SO3;③含硫气体为SO2和SO3。从上述三种假设中挑选一种不合理的,做出解释:
(3)将盛有绿矾的硬质玻璃管A按下图装置,加强热使其充分反应。

C、D中的溶液依次为
a.品红溶液 b.Ba(OH)2溶液 c.盐酸酸化的BaCl2溶液 d.浓硫酸
III.SO2常用于食品加工中作防腐剂、漂白剂。我国规定葡萄酒中SO2最大使用量为0.26g·L-1。某研究小组测定葡萄酒中SO2含量的方法为:在300.00mL葡萄酒中加入适量稀硫酸,加热使SO2全部逸出,并用H2O2完全吸收,再将吸收了SO2的H2O2充分加热后,用0.0900mol·L-1NaOH溶液进行滴定。
(4)H2O2吸收SO2的化学方程式为
(5)若选用酚酞作指示剂,滴定终点的现象为
您最近一年使用:0次
9 . 某实验小组同学为了探究铜与浓硫酸的反应,进行了一系列实验。在反应过程中会发生一些副反应,生成不溶于水和酸的CuS、Cu2S。
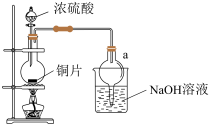
(1)处于安全和绿色化学考虑,在制取硫酸铜时,可选用下列的物质是____ 。
a.Cu b.CuO c.CuS d.CuSO4·Cu(OH)2∙H2O
(2)装置a的作用是___ 。反应过程中,因为浓硫酸的吸水作用,烧瓶中出现白色固体物质,如何简便检验反应后圆底烧瓶里有Cu2+存在?___ 。在实际反应中,由于条件控制不好,容易产生CuS和Cu2S固体:2CuS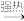 Cu2S+S。
Cu2S+S。
(3)已知样品质量为ag,得到Cu2S是bg,则样品中CuS质量分数是___ 。如果Cu2S高温下转化为Cu,则实验测得的值会___ (填“偏大”、“偏小”或“不变”)
(4)根据以上信息,说明铜与浓硫酸反应需要控制哪些条件?___

(1)处于安全和绿色化学考虑,在制取硫酸铜时,可选用下列的物质是
a.Cu b.CuO c.CuS d.CuSO4·Cu(OH)2∙H2O
(2)装置a的作用是
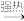 Cu2S+S。
Cu2S+S。(3)已知样品质量为ag,得到Cu2S是bg,则样品中CuS质量分数是
(4)根据以上信息,说明铜与浓硫酸反应需要控制哪些条件?
您最近一年使用:0次
2019-10-28更新
|
852次组卷
|
3卷引用:2019年上海市普通高中学业水平等级性考试(高考)化学试卷



