解题方法
1 . 某化学课外活动小组设计实验探究氨的催化氧化。检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:C处铂丝继续保持红热,F处铜片逐渐溶解。

(1)装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管橡胶塞和__ (填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
(2)装置B的作用是___ 。
(3)装置C中发生反应的化学方程式为__ 。
(4)该装置存在的主要缺陷是__ 。
(5)如图所示的E装置可防止F中溶液倒吸进入D中,请在图中画出装置E中的导气管。___
(6)若进入F装置的物质成分和质量一定,可向F中加入下列物质中的__ (填字母)使铜片溶解的质量增多。
A.Na2CO3 B.NaCl C.CuSO4 D.H2SO4
(7)乙小组认为可将甲小组的装置中A、B部分换成如图2所示装置(其余部分相同)进行实验。烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是__ ,U形管中加入的试剂是__ 。

(1)装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管橡胶塞和
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
(2)装置B的作用是
(3)装置C中发生反应的化学方程式为
(4)该装置存在的主要缺陷是
(5)如图所示的E装置可防止F中溶液倒吸进入D中,请在图中画出装置E中的导气管。
(6)若进入F装置的物质成分和质量一定,可向F中加入下列物质中的
A.Na2CO3 B.NaCl C.CuSO4 D.H2SO4
(7)乙小组认为可将甲小组的装置中A、B部分换成如图2所示装置(其余部分相同)进行实验。烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是
您最近一年使用:0次
2020-08-21更新
|
486次组卷
|
4卷引用:(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第二节 氮及其化合物
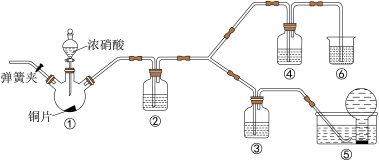
2 . 某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成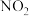 ,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与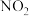 反应:
反应: 。
。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是_______________________________________ 。
(2)滴加浓硝酸之前的操作是检查装置的气密性,加入药品,打开弹簧夹后_______________________________________ 。
(3)装置①中发生反应的化学方程式是____________________________________________ 。
(4)装置②的作用是_____________________ ,发生反应的化学方程式是________________________________________ 。
(5)该小组得出的结论所依据的实验现象是_________________________________________ 。
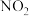 ,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与
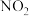 反应:
反应: 。
。(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(2)滴加浓硝酸之前的操作是检查装置的气密性,加入药品,打开弹簧夹后
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是
(5)该小组得出的结论所依据的实验现象是
您最近一年使用:0次
2020-07-11更新
|
681次组卷
|
4卷引用:(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第二节 氮及其化合物
(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第二节 氮及其化合物河北省衡水市桃城区第十四中学2019-2020学年高一下学期第五次综合测试化学试题(已下线)第12讲 氮及其化合物-2021年高考化学一轮复习名师精讲练(已下线)第18讲 硝酸的性质-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)
名校
解题方法
3 . 为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________ 。
(2)该实验可以证明SO2具有_________ 性;H2O2的氧化性_________ Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________ ,B中重新变成红棕色的原因____________________________________ (均用离子方程式表示)。
(4)C中产生的白色沉淀是______ 。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________ 的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
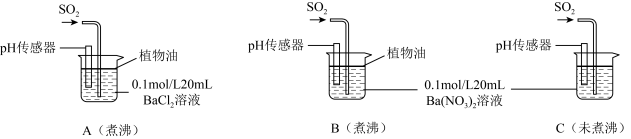
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________ 。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________ 。若实验B、C中通入足量的SO2后,溶液酸性:B_________ C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________ 。

| 实验操作 | 实验现象 |
| i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(2)该实验可以证明SO2具有
(3)B中红棕色褪去的原因
(4)C中产生的白色沉淀是
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:

①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是
您最近一年使用:0次
2020-01-18更新
|
648次组卷
|
3卷引用:专题4 第一单元 第2课时硫酸的制备与性质-高中化学苏教2019版必修第一册
4 . 如图所示分别是某课外活动小组设计的制取氨气并用氨气进行喷泉实验的三组装置,回答下列问题:

(1)用A图所示的装置可制备干燥的NH3:
①反应的化学方程式为___ 。装置中收集NH3的试管口放置棉花团的作用是___ 。
②干燥管中干燥剂能否改用无水CaCl2?__ (填“能”或“不能”)。
(2)用B图所示的装置可快速制取较大量NH3:
①用化学方程式表示浓氨水滴入CaO中有大量NH3逸出的过程:___ 。
②检验NH3是否收集满的实验方法是__ 。

(1)用A图所示的装置可制备干燥的NH3:
①反应的化学方程式为
②干燥管中干燥剂能否改用无水CaCl2?
(2)用B图所示的装置可快速制取较大量NH3:
①用化学方程式表示浓氨水滴入CaO中有大量NH3逸出的过程:
②检验NH3是否收集满的实验方法是
您最近一年使用:0次
2019-11-21更新
|
611次组卷
|
4卷引用:3.3.2 氨的转化与生成练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)
(已下线)3.3.2 氨的转化与生成练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)浙江省金华市方格外国语学校2019-2020学年高二上学期期中考试化学试题(已下线)第14单元 物质的分离、提纯与检验(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷安徽省滁州市定远县育才学校2020-2021学年高一下学期第一次月考化学试题
名校
5 . 某同学利用如下图所示装置完成了浓硫酸和SO2的性质实验(夹持装置已省略)。请回答下列问题
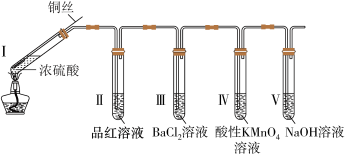
(1)将螺旋状的铜丝伸入浓硫酸中,发生反应的化学方程式为____________ 。
(2)实验中,试管Ⅱ中的品红溶液_____________ (填现象)。
(3)下列说法不正确的是_______ (填字母代号)
A.反应后,将试管I中的液体逐滴加入水中,溶液呈蓝色 B.试管Ⅲ中出现白色浑浊
C.试管Ⅳ中的酸性KMnO4溶液褪色 D.试管V中的NaOH溶液用于吸收尾气
(4)若反应中有0.02 mol H2SO4被还原,则反应产生的气体体积为______ mL(标准状况下)。

(1)将螺旋状的铜丝伸入浓硫酸中,发生反应的化学方程式为
(2)实验中,试管Ⅱ中的品红溶液
(3)下列说法不正确的是
A.反应后,将试管I中的液体逐滴加入水中,溶液呈蓝色 B.试管Ⅲ中出现白色浑浊
C.试管Ⅳ中的酸性KMnO4溶液褪色 D.试管V中的NaOH溶液用于吸收尾气
(4)若反应中有0.02 mol H2SO4被还原,则反应产生的气体体积为
您最近一年使用:0次
2019-08-02更新
|
433次组卷
|
5卷引用:4.4.2 硫酸和硝酸的氧化性(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)
(已下线)4.4.2 硫酸和硝酸的氧化性(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)湖南省长郡中学2018-2019学年高一下学期期末考试化学试题(已下线)考点15 常见非金属元素单质及其重要化合物3——硫-2020年【衔接教材·暑假作业】新高三一轮复习化学山东济南章丘第四中学2021届高三上学期第一次阶段性检测化学试题山东省济南市平阴县第一中学2021-2022学年高三10月月考化学试题
6 . 化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。
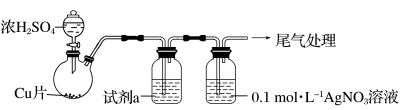
①浓H2SO4与Cu反应的化学方程式是____________________________________ 。
②试剂a是____________ 。
(2)对体系中有关物质性质分析得出:沉淀B可能为 、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:__________ 。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是__________ 。
(3)根据沉淀F的存在,推测 的产生有两个途径:
的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中, 被氧化为
被氧化为 进入D。
进入D。
实验三:探究 的产生途径
的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有________ :取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由:_______ 。
②实验三的结论:__________ 。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________ 。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和 生成。
生成。
(6)根据上述实验所得结论:__________________ 。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。

①浓H2SO4与Cu反应的化学方程式是
②试剂a是
(2)对体系中有关物质性质分析得出:沉淀B可能为
 、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是
(3)根据沉淀F的存在,推测
 的产生有两个途径:
的产生有两个途径:途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,
 被氧化为
被氧化为 进入D。
进入D。实验三:探究
 的产生途径
的产生途径①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有
②实验三的结论:
(4)实验一中SO2与AgNO3溶液反应的离子方程式是
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和
 生成。
生成。(6)根据上述实验所得结论:
您最近一年使用:0次
2019-06-09更新
|
10276次组卷
|
23卷引用:必修第二册RJ第5章挑战区 模拟高考
必修第二册RJ第5章挑战区 模拟高考人教版2019必修第二册 第五章 第一节综合拔高练2019年北京高考化学试题(已下线)专题10.3 化学实验方案的设计与评价 (练)-《2020年高考一轮复习讲练测》人教版(2019)必修第二册第五章 模拟高考湖南省长沙市雅礼中学2021届高三上学期第一次月考化学试题北京市第一〇一中学2021届高三上学期9月月考化学试题(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向14 物质制备探究-备战2022年高考化学一轮复习考点微专题(已下线)考向12 硫及其化合物-备战2022年高考化学一轮复习考点微专题(已下线)第7周 晚练题-备战2022年高考化学周测与晚练(新高考专用)江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题(已下线)专题讲座(十)化学实验设计与探究(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)2021年广东省高考化学试卷变式题11-21(已下线)专题02 定性探究-【微专题·大素养】备战2022年高考化学核心突破(实验综合大题)(已下线)必刷卷05-2022年高考化学考前信息必刷卷(全国甲卷)(已下线)专题十六实验设计与探究实验江苏省海安市实验中学2022-2023学年高一第一次月考化学试题广东省湛江市普通高中2023届高三下学期4月模拟考试化学试题(已下线)专题19 实验综合题(已下线)T28-实验探究题北京市第九中学2023-2024学年高二下学期2月开学考化学试题
名校
7 . 研究铜和铁与浓硫酸的反应,实验如下:
下列说法正确的是
| ① | ② |
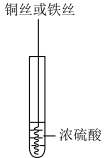 | 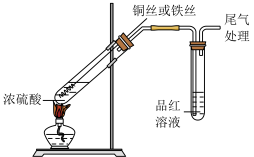 |
| 铜丝表面无明显现象 铁丝表面迅速变黑,之后无明显现象 | 铜丝或铁丝逐渐溶解,产生大量气体, 品红溶液褪色 |
| A.常温下不能用铁制容器盛放浓硫酸,可用铜制容器盛放浓硫酸 |
| B.②中铜丝或铁丝均有剩余时,产生气体的物质的量相等 |
| C.依据②,可推断出铜和铁与浓硫酸反应可生成SO2 |
| D.①②中现象的差异仅是由于温度改变了化学反应速率 |
您最近一年使用:0次
2019-05-28更新
|
2427次组卷
|
18卷引用:(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物
(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物【区级联考】北京市通州区2019届高三下学期第三次模拟考试理科综合化学试题(已下线)第4章 非金属及其化合物 单元测试(测)——2020年高考化学一轮复习讲练测(已下线)小题必刷15 铁、铜及其化合物——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷19 硫及其化合物——2021年高考化学一轮复习小题必刷(通用版)山西省实验中学2021届高三9月月考化学试题(已下线)易错19 实验装置类选择题-备战2021年高考化学一轮复习易错题四川省成都龙泉二中2021届高三下学期3月月考理综化学试题(已下线)第10讲 金属材料及金属矿物的开发利用(精练)-2022年高考化学一轮复习讲练测(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)山西省实验中学2020-2021学年高三上学期第一次月考化学试题(已下线)专题七实验装置图(讲)北京市朝阳区2023届高三下学期三模化学试题(已下线)第5讲 金属材料与金属的冶炼(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省青岛第五十八中学2023-2024学年高一上学期1月月考化学试题
8 . 某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。

(1)装置A制取氯气,该反应的化学方程式:___________ 。
(2)装置C中发生复分解反应制取SO2,该反应的化学方程式:___________ 。
(3)为验证SO2和Cl2发生了反应,小组同学又继续如下实验。
①甲同学认为若SO2和Cl2反应,生成了Cl-,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量___________ 溶液,有白色沉淀生成。
②乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有试剂的名称是___________ 。
③丙同学认为按乙同学的建议改进实验也不合理,理由是:___________ 。
④丙同学取溶液X于试管中,加入少量反应后B中的溶液,生成大量白色沉淀,得出正确结论:SO2与Cl2同时通入水中,可以发生反应。溶液X是_________ (填选项序号)。
a. BaCl2溶液 b. Ba(OH)2溶液 c. 氯水 d. 石蕊溶液
SO2与Cl2同时通入水中反应的化学方程式是______________________ 。

(1)装置A制取氯气,该反应的化学方程式:
(2)装置C中发生复分解反应制取SO2,该反应的化学方程式:
(3)为验证SO2和Cl2发生了反应,小组同学又继续如下实验。
①甲同学认为若SO2和Cl2反应,生成了Cl-,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量
②乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有试剂的名称是
③丙同学认为按乙同学的建议改进实验也不合理,理由是:
④丙同学取溶液X于试管中,加入少量反应后B中的溶液,生成大量白色沉淀,得出正确结论:SO2与Cl2同时通入水中,可以发生反应。溶液X是
a. BaCl2溶液 b. Ba(OH)2溶液 c. 氯水 d. 石蕊溶液
SO2与Cl2同时通入水中反应的化学方程式是
您最近一年使用:0次
2019-03-03更新
|
3473次组卷
|
5卷引用:2.2.1氯气的性质-同步学习必备知识
11-12高一·全国·课时练习
名校
9 . 已知浓硫酸与乙醇的混合液加热后可产生乙烯。为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:将生成的气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学在甲同学的实验中,发现褪色后的溶液中有硫酸根离子,推测在制得的乙烯中还可能有少量还原性气体杂质,由此他提出必须先除去,再与溴水反应。
请回答下列问题:
(1)甲同学实验中溴水褪色的主要的化学方程式为______________________________ 。
(2)甲同学设计的实验________ (填“能”或“不能”)验证乙烯与溴水发生加成反应,理由是________ 。
a.使溴水褪色的反应未必是加成反应
b.使溴水褪色的反应就是加成反应
c.使溴水褪色的物质未必是乙烯
d.使溴水褪色的物质就是乙烯
(3)乙同学推测乙烯中必定含有的一种气体是________ ,可以用________ 来验证,这种气体与溴水反应的化学方程式是_____________________________________________ 。
(4)为验证溴水褪色的反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸性的方法,理由是________________________________________________ 。
乙同学在甲同学的实验中,发现褪色后的溶液中有硫酸根离子,推测在制得的乙烯中还可能有少量还原性气体杂质,由此他提出必须先除去,再与溴水反应。
请回答下列问题:
(1)甲同学实验中溴水褪色的主要的化学方程式为
(2)甲同学设计的实验
a.使溴水褪色的反应未必是加成反应
b.使溴水褪色的反应就是加成反应
c.使溴水褪色的物质未必是乙烯
d.使溴水褪色的物质就是乙烯
(3)乙同学推测乙烯中必定含有的一种气体是
(4)为验证溴水褪色的反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸性的方法,理由是
您最近一年使用:0次
2019-01-30更新
|
1720次组卷
|
4卷引用:2012年人教版高中化学必修二3.2来自石油和煤的化工原料练习卷
(已下线)2012年人教版高中化学必修二3.2来自石油和煤的化工原料练习卷天津市南开中学人教版高中化学选修5预习练习:第二章 第一节 脂肪烃 第1课时湖南省株洲市茶陵县第一中学2020-2021学年高二年上学期入学考试化学试题安徽省安庆外国语学校2020-2021学年高一下学期6月月考化学试题
10 . 某小组同学欲探究NH3的催化氧化反应,按下图装置进行实验。A、B装置可选用的药品:浓氨水、H2O2溶液、蒸馏水、NaOH固体、MnO2。

(1)NH3催化氧化的化学方程式是__________ 。
(2)甲、乙两同学分别按上图装置进行实验。一段时间后,装置G中的溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是__________ 。
②乙观察到装置F中只有白烟生成,白烟的成分是__________ (填化学式)。
③用离子方程式解释装置G中溶液变成蓝色的原因:__________ 。
(3)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进:
①甲认为可调节K1和K2控制A、B装置中的产气量,应__________ (填“增加”或“减少”)装置A中的产气量,或__________ (填“增加”或“减少”)装置B中的产气量。
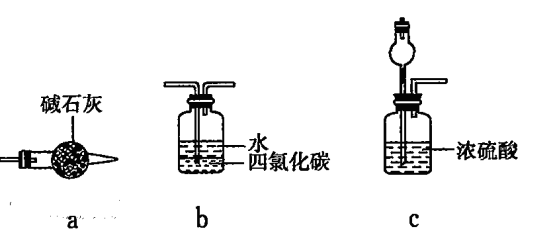
②乙认为可在装置E、F间增加置,该装置可以是__________ (填字母序号)。
(4)为实现该反应,也可用下图所示的装置替换题.给装置中虚线框部分,
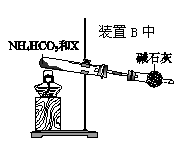
化合物X为__________ 。NH4HCO3的作用是__________ 。

(1)NH3催化氧化的化学方程式是
(2)甲、乙两同学分别按上图装置进行实验。一段时间后,装置G中的溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是
②乙观察到装置F中只有白烟生成,白烟的成分是
③用离子方程式解释装置G中溶液变成蓝色的原因:
(3)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进:
①甲认为可调节K1和K2控制A、B装置中的产气量,应
②乙认为可在装置E、F间增加置,该装置可以是

(4)为实现该反应,也可用下图所示的装置替换题.给装置中虚线框部分,

化合物X为
您最近一年使用:0次
2018-10-01更新
|
1702次组卷
|
6卷引用:人教版2019必修第二册 第五章 第二节 第2课时 氨和铵盐



