1 . 某小组利用含铜刻蚀废液制备无水 ,并电解饱和
,并电解饱和 溶液探究其阴极产物以便回收铜。
溶液探究其阴极产物以便回收铜。
I.制备无水 。制备流程如下:
。制备流程如下:
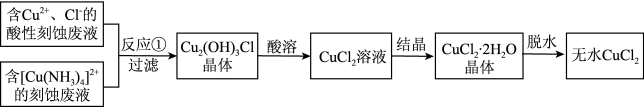
(1)实验室中,“结晶”时使用的陶瓷仪器是_______ ,“脱水”最适宜的方法为_______ 。
(2)已知“过滤”后的滤液中主要溶质为 ,则“反应①”的离子方程式为
,则“反应①”的离子方程式为_______ 。
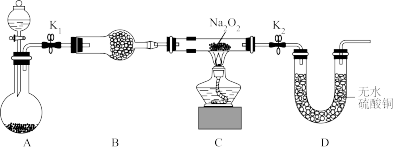
II.探究电解饱和 溶液的阴极产物。用下图所示装置电解饱和
溶液的阴极产物。用下图所示装置电解饱和 溶液,一段时间后,观察到阴极电极表面附着白色固体,电极底部有少量红色固体生成,电极附近的溶液呈“黑色”。
溶液,一段时间后,观察到阴极电极表面附着白色固体,电极底部有少量红色固体生成,电极附近的溶液呈“黑色”。
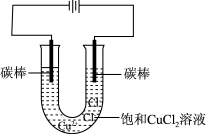
(3)查阅文献发现白色固体是CuCl。则生成CuCl的阴极电极反应为_______ 。
(4)为抑制阴极副反应的发生,该小组继续探究影响CuCl固体析出量的因素,实验如下:
实验结果表明,为减少电解过程中CuCl的析出,可采取的措施有_______ 、_______ 。
(5)为探究溶液呈“黑色”的原因,该小组查阅含铜物质的颜色后有如下猜想:
猜想1:“黑色”物质是细小的CuO粉末;
猜想2:“黑色”物质是纳米铜粉;
猜想3:“黑色”物质是 与
与 、
、 形成的络合离子。
形成的络合离子。
为验证猜想,该小组进行以下实验,得出初步结论:
有同学认为,实验2的现象不能证明猜想2一定成立,理由是③_______ ,因此,关于“黑色”物质的成分还需进一步研究。
 ,并电解饱和
,并电解饱和 溶液探究其阴极产物以便回收铜。
溶液探究其阴极产物以便回收铜。I.制备无水
 。制备流程如下:
。制备流程如下:
(1)实验室中,“结晶”时使用的陶瓷仪器是
(2)已知“过滤”后的滤液中主要溶质为
 ,则“反应①”的离子方程式为
,则“反应①”的离子方程式为II.探究电解饱和
 溶液的阴极产物。用下图所示装置电解饱和
溶液的阴极产物。用下图所示装置电解饱和 溶液,一段时间后,观察到阴极电极表面附着白色固体,电极底部有少量红色固体生成,电极附近的溶液呈“黑色”。
溶液,一段时间后,观察到阴极电极表面附着白色固体,电极底部有少量红色固体生成,电极附近的溶液呈“黑色”。
(3)查阅文献发现白色固体是CuCl。则生成CuCl的阴极电极反应为
(4)为抑制阴极副反应的发生,该小组继续探究影响CuCl固体析出量的因素,实验如下:
| 编号 | 电解液 | 阴极电极析出固体量 | |
| 白色固体 | 红色固体 | ||
| 1 | 5% 溶液 溶液 | 无 | 较多 |
| 2 | 15% 溶液 溶液 | 少量 | 较多 |
| 3 | 饱和 溶液 溶液 | 较多 | 少 |
| 4 | 饱和 溶液,适量盐酸 溶液,适量盐酸 | 无 | 较多 |
(5)为探究溶液呈“黑色”的原因,该小组查阅含铜物质的颜色后有如下猜想:
猜想1:“黑色”物质是细小的CuO粉末;
猜想2:“黑色”物质是纳米铜粉;
猜想3:“黑色”物质是
 与
与 、
、 形成的络合离子。
形成的络合离子。为验证猜想,该小组进行以下实验,得出初步结论:
| 编号 | 操作 | 现象 | 初步结论 |
| 1 | 取2mL“黑色”溶液于试管中,加入适量① | 无明显现象 | 猜想1不成立 |
| 2 | 取2mL“黑色”溶液于试管中,加入适量稀硝酸,振荡 | ② | 猜想2成立 |
您最近一年使用:0次
2022-03-31更新
|
1195次组卷
|
3卷引用:广东省2021-2022学年高三下学期一模化学试题
2 . 某同学制备H2SO4,再用H2SO4制备C2H4,并检验产物。
I.制备H2SO4的重要一步是制SO3
(1)某同学在实验室中根据2SO2(g)+O2(g)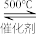 2SO3(g),设计如图1所示实验装置来制备SO3固体。
2SO3(g),设计如图1所示实验装置来制备SO3固体。
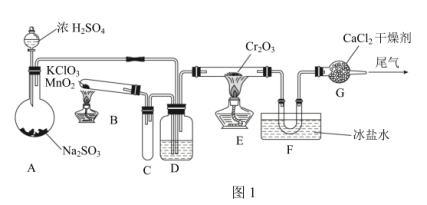
①在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是____ 。
②装置D盛放的是____ 溶液,其作用是____ 。
③实验开始时的操作顺序为____ 。
a.先点燃E处的酒精灯后将混合气体通入E
b.先将混合气体通入E后点燃E处的酒精灯
II.制取乙烯
图2是实验室制乙烯的发生装置,根据图示回答下列问题:
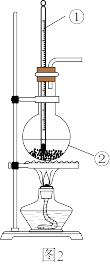
(2)图2中仪器①、②的名称分别为____ 。
(3)反应前在②中放入几块碎瓷片的目的是____ 。
III.检验产物
(4)为检验上述实验收集到的产物,该小组同学进行了如表实验并得出相应结论。
实验①~③中的结论不合理的是____ (填序号),原因是____ 。
I.制备H2SO4的重要一步是制SO3
(1)某同学在实验室中根据2SO2(g)+O2(g)
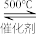 2SO3(g),设计如图1所示实验装置来制备SO3固体。
2SO3(g),设计如图1所示实验装置来制备SO3固体。
①在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
②装置D盛放的是
③实验开始时的操作顺序为
a.先点燃E处的酒精灯后将混合气体通入E
b.先将混合气体通入E后点燃E处的酒精灯
II.制取乙烯
图2是实验室制乙烯的发生装置,根据图示回答下列问题:

(2)图2中仪器①、②的名称分别为
(3)反应前在②中放入几块碎瓷片的目的是
III.检验产物
(4)为检验上述实验收集到的产物,该小组同学进行了如表实验并得出相应结论。
| 实验序号 | 检验试剂和反应条件 | 现象 | 结论 |
| ① | 酸性KMnO4溶液 | 紫红色褪去 | 产物含有乙烯 |
| ② | 澄清Ca(OH)2溶液. | 变浑浊 | 产物含有CO2 |
| ③ | 通过品红溶液 | 红色褪去 | 产物含有SO2 |
您最近一年使用:0次
2022-05-24更新
|
428次组卷
|
2卷引用:天津市和平区2022届高三下学期第三次模拟考试化学试题
3 . 某化学兴趣小组探究SO2与Ca( NO3)2溶液的反应。
I.实验一:用如下装置制备SO2,然后将SO2通入Ca(NO3)2溶液中,有白色沉淀M产生。

(1)固体a是_______ (写名称) 。
(2)装置D的作用是_______ 。
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是_______ 。
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4也可能是二者混合物。(查阅资料得知:CaSO4微溶于水;CaSO3难溶于水。)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,利用倾析法倾倒出上层清液,抽滤,洗涤得到沉淀M。取沉淀M少许于试管中,加入过量的稀HCI,充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)适合利用倾析法将下列物质与水分离的是_______
(5)取加入过量稀HCl静置后的上层溶液于试管中,加入一种试剂,可进一步证实沉淀M中含有CaSO3,则所加试剂及现象是_______ 。
实验三:探究SO 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为_______ 。
(7)从上述实验现象可得出对SO2氧化起主要作用的是_______ (填O2或NO ),其理由是
),其理由是_______ 。
I.实验一:用如下装置制备SO2,然后将SO2通入Ca(NO3)2溶液中,有白色沉淀M产生。

(1)固体a是
(2)装置D的作用是
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4也可能是二者混合物。(查阅资料得知:CaSO4微溶于水;CaSO3难溶于水。)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,利用倾析法倾倒出上层清液,抽滤,洗涤得到沉淀M。取沉淀M少许于试管中,加入过量的稀HCI,充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)适合利用倾析法将下列物质与水分离的是_______
| A.易沉淀固体 | B.胶状物质 | C.大颗粒沉淀 | D.絮状物质 |
实验三:探究SO
 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为
(7)从上述实验现象可得出对SO2氧化起主要作用的是
 ),其理由是
),其理由是
您最近一年使用:0次
2022-02-17更新
|
614次组卷
|
2卷引用:江西省九江市2022届高三第一次高考模拟统一考试理综化学试题
4 . Ⅰ.有资料显示过量的氨气和氯气在常温下可合成岩脑砂 主要成分为NH4Cl,某化学实验小组利用下图的装置来制备岩脑砂,请回答下列问题:
主要成分为NH4Cl,某化学实验小组利用下图的装置来制备岩脑砂,请回答下列问题:
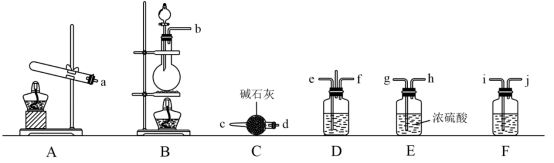
(1)利用装置 制取实验所需的氨气,请写出反应的化学方程式为
制取实验所需的氨气,请写出反应的化学方程式为_______ 。
(2)该实验中用浓盐酸与 反应来制取所需氯气,则装置
反应来制取所需氯气,则装置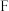 中的试剂名称是
中的试剂名称是_______ 。
(3)为了使氨气和氯气在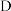 中充分反应,请补全上述装置中仪器接口的合理连接顺序:
中充分反应,请补全上述装置中仪器接口的合理连接顺序: (填仪器接口字母编号)
(填仪器接口字母编号) _______ 。
(4)证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中除了蒸馏水、稀 、红色石蕊试纸外,还需要的主要试剂有
、红色石蕊试纸外,还需要的主要试剂有_______ 。
Ⅱ.下图为制备二氧化硫并探究二氧化硫的某些性质的部分装置 夹持装置未画出
夹持装置未画出 ,请回答下列问题:
,请回答下列问题:
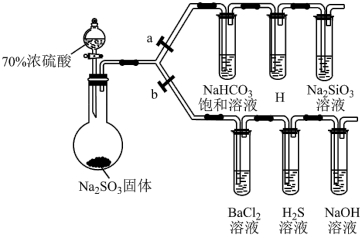
(5)请写出上述装置中用来制备二氧化硫的化学方程式为_______ 。
(6)打开 、关闭
、关闭 ,验证碳、硅两种元素的非金属性的相对强弱。已知酸性:
,验证碳、硅两种元素的非金属性的相对强弱。已知酸性: ,试管
,试管 中所装的试剂为
中所装的试剂为_______ ;能说明碳的非金属性比硅强的实验现象是_______ 。
(7)打开 、关闭
、关闭 ,验证
,验证 的氧化性、还原性和酸性氧化物的通性。
的氧化性、还原性和酸性氧化物的通性。 溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
 主要成分为NH4Cl,某化学实验小组利用下图的装置来制备岩脑砂,请回答下列问题:
主要成分为NH4Cl,某化学实验小组利用下图的装置来制备岩脑砂,请回答下列问题:
(1)利用装置
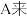 制取实验所需的氨气,请写出反应的化学方程式为
制取实验所需的氨气,请写出反应的化学方程式为(2)该实验中用浓盐酸与
 反应来制取所需氯气,则装置
反应来制取所需氯气,则装置 中的试剂名称是
中的试剂名称是(3)为了使氨气和氯气在
 中充分反应,请补全上述装置中仪器接口的合理连接顺序:
中充分反应,请补全上述装置中仪器接口的合理连接顺序: (填仪器接口字母编号)
(填仪器接口字母编号) (4)证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中除了蒸馏水、稀
 、红色石蕊试纸外,还需要的主要试剂有
、红色石蕊试纸外,还需要的主要试剂有Ⅱ.下图为制备二氧化硫并探究二氧化硫的某些性质的部分装置
 夹持装置未画出
夹持装置未画出 ,请回答下列问题:
,请回答下列问题:
(5)请写出上述装置中用来制备二氧化硫的化学方程式为
(6)打开
 、关闭
、关闭 ,验证碳、硅两种元素的非金属性的相对强弱。已知酸性:
,验证碳、硅两种元素的非金属性的相对强弱。已知酸性: ,试管
,试管 中所装的试剂为
中所装的试剂为(7)打开
 、关闭
、关闭 ,验证
,验证 的氧化性、还原性和酸性氧化物的通性。
的氧化性、还原性和酸性氧化物的通性。 溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
您最近一年使用:0次
21-22高一·全国·课时练习
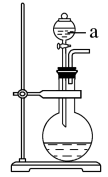
5 . 某化学小组同学发现“84”消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混和有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2。
(1)若用次氯酸钙、浓盐酸为原料,利用如图装置制取Cl2.装置中仪器a的名称为_______ 。
(2)甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,观察有无色气泡产生。乙同学认为不合理,理由是_______ 。
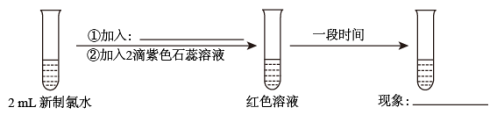
(3)某实验小组对氯水成分和性质进行研究,实验如图:
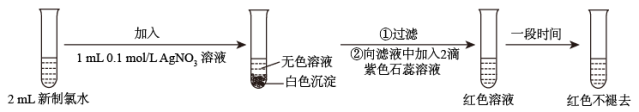
甲同学认为,“红色不褪去”不是因为氯水被稀释所致。乙同学持反对意见。为了证明甲同学错误,乙同学继续以下实验,请在横线上补充所加入的试剂和观察到的现象。
加入:_______ ,现象:_______ 。
(4)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如图装置制备无水FeCl3。
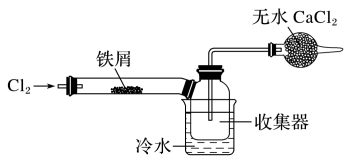
①下列操作步骤的正确排序为_______ (填字母)
a.体系冷却后,停止通入Cl2
b.通入干燥的Cl2赶尽装置中的空气
c.在铁屑下方加热至反应完成
d.用干燥的H2赶尽Cl2
e.检验装置的气密性
②该实验装置存在的明显缺陷是_______ 。
(1)若用次氯酸钙、浓盐酸为原料,利用如图装置制取Cl2.装置中仪器a的名称为

(2)甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,观察有无色气泡产生。乙同学认为不合理,理由是
(3)某实验小组对氯水成分和性质进行研究,实验如图:

甲同学认为,“红色不褪去”不是因为氯水被稀释所致。乙同学持反对意见。为了证明甲同学错误,乙同学继续以下实验,请在横线上补充所加入的试剂和观察到的现象。
加入:

(4)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如图装置制备无水FeCl3。

①下列操作步骤的正确排序为
a.体系冷却后,停止通入Cl2
b.通入干燥的Cl2赶尽装置中的空气
c.在铁屑下方加热至反应完成
d.用干燥的H2赶尽Cl2
e.检验装置的气密性
②该实验装置存在的明显缺陷是
您最近一年使用:0次
6 . 某实验小组在实验室制备干燥纯净的氯气,并探究其性质。所用仪器及药品如图所示:

回答下列问题:
(1)根据实验设计上述制取氯气装置时,按照各装置的功能,连接顺序为:气体发生装置→___________ →收集装置→___________ 。
(2)A中盛放浓盐酸的仪器名称为___________ ,反应的化学方程式为___________ 。
(3)E中反应的离子方程式为_______ 。
(4)若要验证干燥的氯气不具有漂白性,可将如图所示装置连接到原实验装置中,连接的最佳位置是____ (填选项序号)。
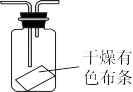
①A、B间 ②B、C间 ③C、D间
(5)该小组同学将制得的氯气配制成氯水,以探究 的还原性。进行了如下实验:取一定量的
的还原性。进行了如下实验:取一定量的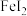 溶液,向其中滴加少量新制氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
溶液,向其中滴加少量新制氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1: 被
被 氧化
氧化
假设2: 被
被 氧化
氧化
请你完成下表,验证假设。
(6)若要产生常温常压下 ,理论上需要
,理论上需要 的质量为
的质量为___________ g。(已知常温常压下气体的摩尔体积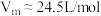 ;计算结果保留两位小数)
;计算结果保留两位小数)

回答下列问题:
(1)根据实验设计上述制取氯气装置时,按照各装置的功能,连接顺序为:气体发生装置→
(2)A中盛放浓盐酸的仪器名称为
(3)E中反应的离子方程式为
(4)若要验证干燥的氯气不具有漂白性,可将如图所示装置连接到原实验装置中,连接的最佳位置是

①A、B间 ②B、C间 ③C、D间
(5)该小组同学将制得的氯气配制成氯水,以探究
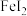 的还原性。进行了如下实验:取一定量的
的还原性。进行了如下实验:取一定量的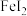 溶液,向其中滴加少量新制氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
溶液,向其中滴加少量新制氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:假设1:
 被
被 氧化
氧化假设2:
 被
被 氧化
氧化请你完成下表,验证假设。
| 实验步骤 | 预期现象 | 结论 |
| ①取少量黄色溶液于试管中,滴加几滴 | 假设1正确 | |
| ②取少量黄色溶液于试管中,滴加几滴 | 假设2正确 |
 ,理论上需要
,理论上需要 的质量为
的质量为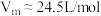 ;计算结果保留两位小数)
;计算结果保留两位小数)
您最近一年使用:0次
2022-01-24更新
|
174次组卷
|
3卷引用:广东省肇庆市2021-2022学年高一上学期期末教学质量检测化学试题
7 . 科学探究是化学学科核心素养之一,某化学兴趣组与在实验室探究氯气与过氧化钠的性质,设计并进行了以下两组实验:
第一组:元素的非金属性强弱。
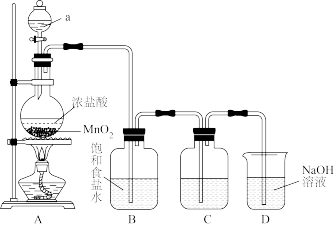
(1)仪器a的名称是___________ 。
(2)装置A中发生反应的化学方程式为: MnO2+4HCl(浓)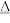 Cl2↑+MnCl2+2H2O, 化学实验室通常用KMnO4代替MnO2制备Cl2且不需要加热,在酸性条件下KMnO4的还原产物为MnCl2,请写出浓盐酸与KMnO4制备Cl2的离子方程式
Cl2↑+MnCl2+2H2O, 化学实验室通常用KMnO4代替MnO2制备Cl2且不需要加热,在酸性条件下KMnO4的还原产物为MnCl2,请写出浓盐酸与KMnO4制备Cl2的离子方程式___________ 。
(3)为验证氯元素的非金属性比硫元素的非金属性强,装置C中盛放的试剂是___________。
(4)装置D用于吸收尾气,D中反应的离子方程式为: Cl2+2OH-=ClO-+Cl-+H2O,氯气与碱反应为放热反应,D中溶液温度会升高,升温后会有ClO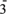 生成,请写出升温后氯气与氢氧化钠溶液反应的化学方程式
生成,请写出升温后氯气与氢氧化钠溶液反应的化学方程式___________ 。
第二组:Na2O2具有强氧化性,H2具有还原性,根据氧化还原反应原理推测Na2O2与H2能发生反应。
(5)装置A中用稀盐酸和锌粒制取H2, 装置B盛放的试剂是碱石灰,碱石灰的作用___________ 。
(6)下面是实验过程中的重要操作,请把以下操作步骤列出正确的排列顺序___________ (填序号)。
①加热Na2O2一段时间。
②用小试管收集气体并检验其纯度。
③打开K1、K2,并通H2。
④停止加热,充分冷却,关闭K1、K2。
(7)实验过程中观察到淡黄色固体逐渐变为白色固体,无水硫酸铜未变蓝色,由实验现象推测Na2O2与H2反应的化学方程式为___________ 。
第一组:元素的非金属性强弱。

(1)仪器a的名称是
(2)装置A中发生反应的化学方程式为: MnO2+4HCl(浓)
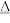 Cl2↑+MnCl2+2H2O, 化学实验室通常用KMnO4代替MnO2制备Cl2且不需要加热,在酸性条件下KMnO4的还原产物为MnCl2,请写出浓盐酸与KMnO4制备Cl2的离子方程式
Cl2↑+MnCl2+2H2O, 化学实验室通常用KMnO4代替MnO2制备Cl2且不需要加热,在酸性条件下KMnO4的还原产物为MnCl2,请写出浓盐酸与KMnO4制备Cl2的离子方程式(3)为验证氯元素的非金属性比硫元素的非金属性强,装置C中盛放的试剂是___________。
| A.Na2S溶液 | B.Na2SO3溶液 | C.Na2SO4溶液 | D.H2S溶液 |
 生成,请写出升温后氯气与氢氧化钠溶液反应的化学方程式
生成,请写出升温后氯气与氢氧化钠溶液反应的化学方程式第二组:Na2O2具有强氧化性,H2具有还原性,根据氧化还原反应原理推测Na2O2与H2能发生反应。

(5)装置A中用稀盐酸和锌粒制取H2, 装置B盛放的试剂是碱石灰,碱石灰的作用
(6)下面是实验过程中的重要操作,请把以下操作步骤列出正确的排列顺序
①加热Na2O2一段时间。
②用小试管收集气体并检验其纯度。
③打开K1、K2,并通H2。
④停止加热,充分冷却,关闭K1、K2。
(7)实验过程中观察到淡黄色固体逐渐变为白色固体,无水硫酸铜未变蓝色,由实验现象推测Na2O2与H2反应的化学方程式为
您最近一年使用:0次
名校
8 . 下图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略):

回答下列问题:
(1)装置A中是用MnO2和浓盐酸反应制备Cl2,请写出其反应的化学方程式:___________ 。
(2)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:___________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ应依次放入:湿润的有色布条、___________ 、干燥的有色布条。
(4)装置E中潮湿的Cl2与Na2CO3反应,生成NaHCO3、Cl2O气体和另一种盐,试写出该反应的化学方程式:___________
(5)装置F的作用是:___________ 。
(6)反应G中的离子方程式为___________ 。
(7)设计最简单的实验方案验证E中生成的固体中存在HCO :
:___________ 。

回答下列问题:
(1)装置A中是用MnO2和浓盐酸反应制备Cl2,请写出其反应的化学方程式:
(2)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ应依次放入:湿润的有色布条、
(4)装置E中潮湿的Cl2与Na2CO3反应,生成NaHCO3、Cl2O气体和另一种盐,试写出该反应的化学方程式:
(5)装置F的作用是:
(6)反应G中的离子方程式为
(7)设计最简单的实验方案验证E中生成的固体中存在HCO
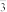 :
:
您最近一年使用:0次
2021-11-27更新
|
138次组卷
|
2卷引用:河北省邢台市第一中学2021-2022学年高一上学期第二次月考化学试题
9 . 化工产品亚硫酸亚铜铵(NH4CuSO3)是一种难溶于水的白色固体。某实验小组将 通入深蓝色的
通入深蓝色的 溶液中,经一系列操作制备
溶液中,经一系列操作制备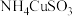 并探究其性质。
并探究其性质。
实验(一)制备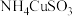 。实验小组设计实验装置如下图所示。
。实验小组设计实验装置如下图所示。
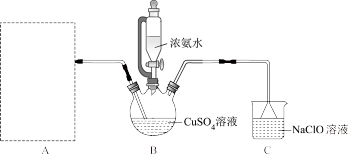
(1)实验室常用 固体粉末和70%硫酸反应制备
固体粉末和70%硫酸反应制备 ,发生装置A宜选择下列中的
,发生装置A宜选择下列中的____ (填序号)。
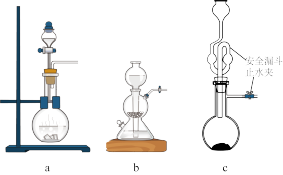
对于c装置,检验其气密性良好的方法是_______ 。
(2)实验开始时,向三颈烧瓶中逐滴加入氨水至过量,可观察到主要现象有______ 。然后向三颈烧瓶中通入 ,生成产物的化学方程式为
,生成产物的化学方程式为______ 。
(3)实验完毕后,分离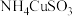 的操作是
的操作是______ 、用75%酒精洗涤、干燥。
(4)下列实验能够说明尾气中 被完全吸收的方案是(填序号)
被完全吸收的方案是(填序号)_______ 。
实验(二)探究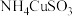 中的铜元素性质。设计实验装置如下图所示。
中的铜元素性质。设计实验装置如下图所示。

实验现象:装置I中白色固体溶解,产生气泡,生成红色固体,溶液变蓝色;装置II中溶液褪色。
(5)装置I中发生反应的离子方程式为__ 。实验中,用硝酸替代稀硫酸,不能探究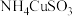 中铜元素的
中铜元素的____ (填“氧化”或“还原”)性。
 通入深蓝色的
通入深蓝色的 溶液中,经一系列操作制备
溶液中,经一系列操作制备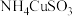 并探究其性质。
并探究其性质。实验(一)制备
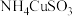 。实验小组设计实验装置如下图所示。
。实验小组设计实验装置如下图所示。
(1)实验室常用
 固体粉末和70%硫酸反应制备
固体粉末和70%硫酸反应制备 ,发生装置A宜选择下列中的
,发生装置A宜选择下列中的
对于c装置,检验其气密性良好的方法是
(2)实验开始时,向三颈烧瓶中逐滴加入氨水至过量,可观察到主要现象有
 ,生成产物的化学方程式为
,生成产物的化学方程式为(3)实验完毕后,分离
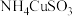 的操作是
的操作是(4)下列实验能够说明尾气中
 被完全吸收的方案是(填序号)
被完全吸收的方案是(填序号)| 序号 | 操作 | 实验现象 |
| 甲 | 取少量装置C中溶液于试管,滴加 溶液 溶液 | 产生白色沉淀 |
| 乙 | 取少量装置C中溶液于试管,滴加 溶液 溶液 | 产生白色沉淀 |
| 丙 | 取少量装置C中溶液于试管,滴加品红溶液 | 溶液由红色变为无色 |
| 丁 | 取少量装置C中溶液于试管,滴加酚酞溶液 | 溶液先变红后褪色 |
实验(二)探究
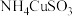 中的铜元素性质。设计实验装置如下图所示。
中的铜元素性质。设计实验装置如下图所示。
实验现象:装置I中白色固体溶解,产生气泡,生成红色固体,溶液变蓝色;装置II中溶液褪色。
(5)装置I中发生反应的离子方程式为
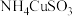 中铜元素的
中铜元素的
您最近一年使用:0次
名校
10 . 实验室用浓硫酸、铜与NaOH溶液为原料制取少量 并探究其性质。
并探究其性质。
I.制备 (装置如图所示)。
(装置如图所示)。
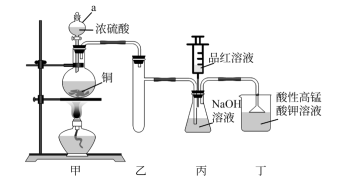
(1)仪器a的名称是___________ 。
(2)装置丁的作用有①吸收尾气,防止环境污染;②___________ ;③___________ 。
(3)证明丙中NaOH已完全转化为 的操作和现象是
的操作和现象是___________ 。
II.探究 与
与 的反应,设计实验如下:向2mL1mol/L
的反应,设计实验如下:向2mL1mol/L 溶液中加入2mL1mol/L
溶液中加入2mL1mol/L 溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份,进行实验Ⅰ和Ⅱ。
溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份,进行实验Ⅰ和Ⅱ。
(4)推测实验Ⅱ产生的无色气体为 ,实验证实推测正确:用滴有碘水的淀粉试纸接近试管口,观察到
,实验证实推测正确:用滴有碘水的淀粉试纸接近试管口,观察到___________ ,反应的离子方程式为___________ 。
(5)对实验Ⅱ产生 的原因进行分析,提出两种假设:
的原因进行分析,提出两种假设:
假设1: 水解使溶液中
水解使溶液中 增大。
增大。
假设2: 存在时,
存在时, 与
与 反应生成CuCl白色沉淀,溶液中
反应生成CuCl白色沉淀,溶液中 增大。
增大。
①假设1不合理,实验证据是___________ 。
②实验证实假设2合理,实验Ⅱ中发生反应的离子方程式有______ ,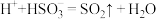 。
。
(6)通过上述分析可知, 增强了
增强了 的氧化性。某同学设计原电池实验证明该实验结果。
的氧化性。某同学设计原电池实验证明该实验结果。
①补全乙实验的现象___________ 。
②已知E为电池电动势[电池电动势即电池的理论电压,是两个电极电位之差,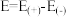 ],
],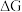 为电池反应的自由能变,则甲电池与乙电池相比较,
为电池反应的自由能变,则甲电池与乙电池相比较,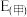
___________ 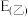 ,
,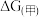
___________ 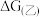 (填“>”或“<”)。
(填“>”或“<”)。
 并探究其性质。
并探究其性质。I.制备
 (装置如图所示)。
(装置如图所示)。
(1)仪器a的名称是
(2)装置丁的作用有①吸收尾气,防止环境污染;②
(3)证明丙中NaOH已完全转化为
 的操作和现象是
的操作和现象是II.探究
 与
与 的反应,设计实验如下:向2mL1mol/L
的反应,设计实验如下:向2mL1mol/L 溶液中加入2mL1mol/L
溶液中加入2mL1mol/L 溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份,进行实验Ⅰ和Ⅱ。
溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份,进行实验Ⅰ和Ⅱ。| 实验 | 操作及现象 |
| Ⅰ | 加入适量 固体,瞬间无明显变化,30s时也无明显变化。 固体,瞬间无明显变化,30s时也无明显变化。 |
| Ⅱ | 加入适量NaCl固体,瞬间无明显变化,30s时有无色气体和白色沉淀,上层溶液颜色变浅。 |
 ,实验证实推测正确:用滴有碘水的淀粉试纸接近试管口,观察到
,实验证实推测正确:用滴有碘水的淀粉试纸接近试管口,观察到(5)对实验Ⅱ产生
 的原因进行分析,提出两种假设:
的原因进行分析,提出两种假设:假设1:
 水解使溶液中
水解使溶液中 增大。
增大。假设2:
 存在时,
存在时, 与
与 反应生成CuCl白色沉淀,溶液中
反应生成CuCl白色沉淀,溶液中 增大。
增大。①假设1不合理,实验证据是
②实验证实假设2合理,实验Ⅱ中发生反应的离子方程式有
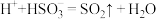 。
。(6)通过上述分析可知,
 增强了
增强了 的氧化性。某同学设计原电池实验证明该实验结果。
的氧化性。某同学设计原电池实验证明该实验结果。①补全乙实验的现象
| 编号 | 甲 | 乙 |
| 实验 | 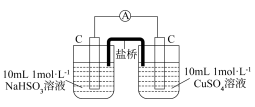 | 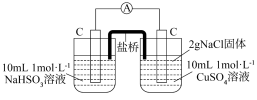 |
| 现象 | 电流计指针发生微小偏转 |
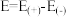 ],
],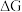 为电池反应的自由能变,则甲电池与乙电池相比较,
为电池反应的自由能变,则甲电池与乙电池相比较,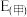
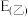 ,
,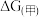
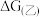 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次



