1 . 某化学研究性学习小组利用以下装置制取并探究氨气的性质,回答下列问题:___________ 。
(2)B装置中的干燥剂成分是___________ 。气流通过C、D装置时候分别观察到的现象:C. ___________ 、D.___________ 。
(3)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到E装置中的现象是产生___________ 。
(4)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是___________ (填“F”或“G”)。

(2)B装置中的干燥剂成分是
(3)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到E装置中的现象是产生
(4)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是
您最近一年使用:0次
2 . 某化学自主实验小组利用如图所示装置(K1、K2为止水夹,夹持装置已略去)探究NO2能否被NH3还原。
(1)a仪器名称为_______ 。
(2)甲中盛放的试剂的名称是_______ ,乙中盛放的试剂的化学式为_______ 。
(3)C中铜与浓硝酸反应时,体现的浓硝酸的性质为_______ ,C中实验现象为_______ 。
(4)实验过程中观察到B中红棕色气体逐渐变淡至无色,经检测发现尾气中的有害气体只有未完全反应的反应物,则B中发生反应的化学方程式为_______ ,其中n(还原产物):n(氧化产物)=_______ 。
(5)NaOH溶液可吸收过量的NO2,二者反应生成两种钠盐,则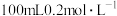 NaOH溶液最多能吸收
NaOH溶液最多能吸收_______ mol NO2.(忽略气体在水中的溶解及气体与水的反应)

(1)a仪器名称为
(2)甲中盛放的试剂的名称是
(3)C中铜与浓硝酸反应时,体现的浓硝酸的性质为
(4)实验过程中观察到B中红棕色气体逐渐变淡至无色,经检测发现尾气中的有害气体只有未完全反应的反应物,则B中发生反应的化学方程式为
(5)NaOH溶液可吸收过量的NO2,二者反应生成两种钠盐,则
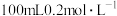 NaOH溶液最多能吸收
NaOH溶液最多能吸收
您最近一年使用:0次
3 . 非金属元素硫在化工生产中扮演重要角色,实验室制备及探究某些含硫化合物。
Ⅰ.利用 和
和 反应合成硫酰氯
反应合成硫酰氯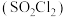 ,已知
,已知 的熔点为
的熔点为 ,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量HCl白雾,100℃以上分解生成
,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量HCl白雾,100℃以上分解生成 和
和 。实验室合成
。实验室合成 的原理:
的原理: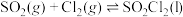 ,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:
,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:_____ 。
(2)装置戊上方分液漏斗中最好选用_____ (填字母)。
a.蒸馏水 b.饱和食盐水 c. 盐酸 d.浓氢氧化钠溶液
盐酸 d.浓氢氧化钠溶液
(3)装置乙和丁盛放的试剂均是浓硫酸,其作用是_____ 。
(4)装置丙放置在冰水浴中的原因是_____ 。
Ⅱ.探究 使品红溶液褪色的原因
使品红溶液褪色的原因
操作1:将 通入品红溶液中,品红溶液褪色。
通入品红溶液中,品红溶液褪色。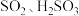 、
、_____ 。
已知:品红是一种棕红色晶体状有机染料,微溶于水,溶于乙醇和酸,溶液呈红色。
②实验设计:小组结合以上信息,设计如下实验证明使品红褪色的微粒不是 请完成表格。
请完成表格。
Ⅰ.利用
 和
和 反应合成硫酰氯
反应合成硫酰氯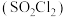 ,已知
,已知 的熔点为
的熔点为 ,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量HCl白雾,100℃以上分解生成
,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量HCl白雾,100℃以上分解生成 和
和 。实验室合成
。实验室合成 的原理:
的原理: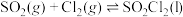 ,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:
,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题: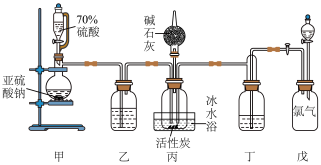
(2)装置戊上方分液漏斗中最好选用
a.蒸馏水 b.饱和食盐水 c.
 盐酸 d.浓氢氧化钠溶液
盐酸 d.浓氢氧化钠溶液(3)装置乙和丁盛放的试剂均是浓硫酸,其作用是
(4)装置丙放置在冰水浴中的原因是
Ⅱ.探究
 使品红溶液褪色的原因
使品红溶液褪色的原因操作1:将
 通入品红溶液中,品红溶液褪色。
通入品红溶液中,品红溶液褪色。
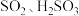 、
、已知:品红是一种棕红色晶体状有机染料,微溶于水,溶于乙醇和酸,溶液呈红色。
②实验设计:小组结合以上信息,设计如下实验证明使品红褪色的微粒不是
 请完成表格。
请完成表格。| 操作2 | 现象 |
| 不褪色 |
您最近一年使用:0次
4 . NH3一种重要的化工原料,可用于制氮肥、HNO3、铵盐、纯碱等。某实验小组设计了如下实验装置制取NH3,回答下列问题:
(1)NH3的制备___________ 。
②实验室用装置D作为制取氨气的发生装置,该反应的化学方程式为___________ ;若用装置B作为制取氨气的发生装置,分液漏斗中盛装的试剂名称为___________ 。
③欲收集一瓶干燥的氨气,选择上图中的装置。其连接顺序为:发生装置→___________ (按气流方向,用小写字母表示)。
(2)工业上NH3经一系列反应可制取硝酸,某校课外活动小组为了探究铜与稀硝酸反应产生的气体是NO,设计了如图实验,实验过程中同时用石灰水吸收产生的氮氧化物获得应用广泛的Ca(NO3)2,实验装置如图所示:___________ 。
②在①操作后将装置A中铜丝插入稀硝酸,溶液显蓝色,有无色气体生成,其中发生反应的离子方程式是___________ ;该反应体现了硝酸的___________ 性。
③装置B中用注射器压入空气之后现象是___________ ;反应的化学方程式是___________ 。
④D装置的作用是___________ 。
(1)NH3的制备

②实验室用装置D作为制取氨气的发生装置,该反应的化学方程式为
③欲收集一瓶干燥的氨气,选择上图中的装置。其连接顺序为:发生装置→
(2)工业上NH3经一系列反应可制取硝酸,某校课外活动小组为了探究铜与稀硝酸反应产生的气体是NO,设计了如图实验,实验过程中同时用石灰水吸收产生的氮氧化物获得应用广泛的Ca(NO3)2,实验装置如图所示:

②在①操作后将装置A中铜丝插入稀硝酸,溶液显蓝色,有无色气体生成,其中发生反应的离子方程式是
③装置B中用注射器压入空气之后现象是
④D装置的作用是
您最近一年使用:0次
名校
5 . 某化学兴趣小组在实验室中模拟甲烷与氯气的反应,模拟装置如图所示。
(1)装置A中发生反应的离子方程式为___________ 。
(2)装置B有三种功能:①控制气流速度;②均匀混合气体;③___________ 。
(3)写出装置C中生成 的化学方程式:
的化学方程式:___________ 。
(4)装置D的石棉中均匀混有足量KI粉末,其作用是___________ ,装置C与装置D中发生反应的类型___________ (填“相同”或“不同”)。
(5)装置E中干燥管的作用是___________ ,实验过程中观察到E中有气泡产生,同时有油状液体生成,气泡的主要成分为___________ 。

(1)装置A中发生反应的离子方程式为
(2)装置B有三种功能:①控制气流速度;②均匀混合气体;③
(3)写出装置C中生成
 的化学方程式:
的化学方程式:(4)装置D的石棉中均匀混有足量KI粉末,其作用是
(5)装置E中干燥管的作用是
您最近一年使用:0次
6 . 某小组同学利用下图所示装置完成碳与浓硫酸反应的实验,并验证所得全部产物。请完成下列空白。___________ ;
(2)写出浓硫酸和木炭粉发生反应的化学方程式:___________ ,在该反应中,浓H2SO4表现出___________ (填“吸水”、“脱水”或“强氧化”)性;。
(3)如果用图中的装置检验上述反应的全部产物,请回答下列问题:
①A中加入的试剂___________ ,B作用是___________ 。
②C中应观察到的现象是___________ ,体现了SO2的性质是___________ 。
a.漂白性 b.氧化性 c.还原性
(4)浓硫酸具有:a.脱水性;b.酸性;c.强氧化性;d.吸水性;下列各项分别表现浓硫酸的什么性质,请将字母填于空白处:
①盛有浓硫酸的烧杯敞口放置一段时间后,质量增加___________ 。
②浓硫酸与铜共热,浓硫酸表现的性质是___________ 。

(2)写出浓硫酸和木炭粉发生反应的化学方程式:
(3)如果用图中的装置检验上述反应的全部产物,请回答下列问题:
①A中加入的试剂
②C中应观察到的现象是
a.漂白性 b.氧化性 c.还原性
(4)浓硫酸具有:a.脱水性;b.酸性;c.强氧化性;d.吸水性;下列各项分别表现浓硫酸的什么性质,请将字母填于空白处:
①盛有浓硫酸的烧杯敞口放置一段时间后,质量增加
②浓硫酸与铜共热,浓硫酸表现的性质是
您最近一年使用:0次
名校
7 . 实验室可用如图装置(略去部分夹持仪器)制取SO2并验证其性质。_______ ,仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成段液柱,若_______ 则整个装置气密性良好。
(2)A中如果用浓硫酸和铜反应,也可制得 进行实验,反应的化学方程式为
进行实验,反应的化学方程式为_______ 。
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为_______ 。
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案Ⅰ:向第一份溶液中加入 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入 溶液,产生白色沉淀
溶液,产生白色沉淀
上述方案合理的是方案_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”); 通入KMnO4溶液中发生的主要反应的离子方程式为
通入KMnO4溶液中发生的主要反应的离子方程式为_______ 。
(5)装置E的作用是做安全瓶,防止F中的液体倒吸入D中,装置F中为_______ 溶液。

(2)A中如果用浓硫酸和铜反应,也可制得
 进行实验,反应的化学方程式为
进行实验,反应的化学方程式为(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案Ⅰ:向第一份溶液中加入
 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入
 溶液,产生白色沉淀
溶液,产生白色沉淀上述方案合理的是方案
 通入KMnO4溶液中发生的主要反应的离子方程式为
通入KMnO4溶液中发生的主要反应的离子方程式为(5)装置E的作用是做安全瓶,防止F中的液体倒吸入D中,装置F中为
您最近一年使用:0次
名校
8 . Ⅰ.某同学完成了如下系列实验,探究元素周期表中元素性质的递变规律.
(1)为验证金属与稀酸的反应速率,将Na、Lⅰ、Fe、Al各0.28mol分别投入到足量的2.2mol/L的硫酸中,实验结果为:___________ 与硫酸反应速率最慢,___________ 与硫酸反应产生的气体最多;(填元素符号)
(2)向 溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为
溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为___________ 。
Ⅱ.验证主族元素非金属性的变化规律设计了如图装置
(3)某研究小组想用该装置一次性验证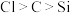 的非金属性的变化规律,则装置A、C中所装药品分别为
的非金属性的变化规律,则装置A、C中所装药品分别为___________ 、___________ .该实验采用的理论依据为___________ ;
(4)铝用途广泛,可与强碱溶液反应,请书写铝与氢氧化钠溶液反应的化学方程式:___________ ;
Ⅳ.粮食安全问题很重要,储存环节要避免虫蛀.工业上可用以下方法制备粮食储备的强效熏虫剂 .
. 为
为___________ (填“一”、“二”或“三”)元酸.
(6)不考虑产物的损失,标准状况下若有 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成___________ 升 气体.
气体.
(1)为验证金属与稀酸的反应速率,将Na、Lⅰ、Fe、Al各0.28mol分别投入到足量的2.2mol/L的硫酸中,实验结果为:
(2)向
 溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为
溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为Ⅱ.验证主族元素非金属性的变化规律设计了如图装置
(3)某研究小组想用该装置一次性验证
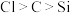 的非金属性的变化规律,则装置A、C中所装药品分别为
的非金属性的变化规律,则装置A、C中所装药品分别为
(4)铝用途广泛,可与强碱溶液反应,请书写铝与氢氧化钠溶液反应的化学方程式:
Ⅳ.粮食安全问题很重要,储存环节要避免虫蛀.工业上可用以下方法制备粮食储备的强效熏虫剂
 .
.
 为
为(6)不考虑产物的损失,标准状况下若有
 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成 气体.
气体.
您最近一年使用:0次
9 . 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是

| A.水、氨气 | B.水、 与 与 | C. 溶液、 溶液、 | D. 溶液、 溶液、 |
您最近一年使用:0次
名校
解题方法
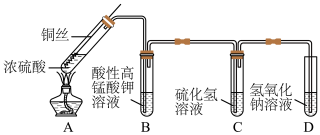
10 . 某化学实验小组的同学利用铜与浓硫酸反应制取二氧化硫并研究其性质,所用实验装置如图。回答下列问题:________________ 。
(2)装置A中反应的化学方程式是__________________ 。
(3)装置B的现象为__________ ,体现了SO2的__________ 性。
(4)装置C中反应的化学方程式是____________________________ 。
(5)探究SO2与钡盐的反应
在下图装置中先后三次加入相同浓度、相同体积、不同条件下的钡盐溶液,控制食用油油层厚度一致,打开开关K,通入SO2流速一致。三次实验现象如下表:
三次实验分别得到如下pH-t图:_____________________________ 。
②pH-t图中,曲线a呈缓慢下降趋势,这是因为__________ ;曲线b出现骤降,这是因为SO2与BaCl2溶液中溶解的__________ 发生反应生成了H+。
③写出实验c中反应的离子方程式:_____________________
______Ba2++_______SO2+______ +_____=______BaSO4↓+_______NO+_______。
+_____=______BaSO4↓+_______NO+_______。
(2)装置A中反应的化学方程式是
(3)装置B的现象为
(4)装置C中反应的化学方程式是
(5)探究SO2与钡盐的反应
在下图装置中先后三次加入相同浓度、相同体积、不同条件下的钡盐溶液,控制食用油油层厚度一致,打开开关K,通入SO2流速一致。三次实验现象如下表:
实验a | 实验b | 实验c |
|
已煮沸的 BaCl2溶液 | 未煮沸的 BaCl2溶液 | 已煮沸的 Ba(NO3)2溶液 | |
无白色沉淀生成 | 有白色沉淀生成 | 有白色沉淀生成 |

②pH-t图中,曲线a呈缓慢下降趋势,这是因为
③写出实验c中反应的离子方程式:
______Ba2++_______SO2+______
 +_____=______BaSO4↓+_______NO+_______。
+_____=______BaSO4↓+_______NO+_______。
您最近一年使用:0次




