解题方法
1 . 某化学小组拟设计实验探究SO2与钙盐溶液的反应情况。
【文献资料】
①CaSO3是难溶于水、易溶于盐酸的白色固体;
②实验室用Na2SO3粉末和70%硫酸反应制备SO2;
③浓硫酸与水混合时放出大量的热,产生大量“酸雾”。
【设计实验】
实验Ⅰ:探究二氧化硫与氯化钙溶液的反应。
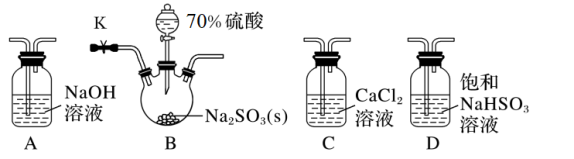
(1)若气体从左至右流动,选择装置并排序为___________ (填字母)。
(2)D装置的作用是___________ (用离子方程式表示)。
(3)连接装置进行实验,发现C装置中产生白色沉淀。
①甲同学对白色沉淀成分提出如下假设:
假设1:白色沉淀是CaSO3;
假设2:白色沉淀是CaSO4;
假设3:白色沉淀是CaSO4和CaSO3。
②乙同学设计实验证明白色沉淀是CaSO4,他的实验方法和现象是___________ 。
③丙同学认为C中生成硫酸钙的原因是装置内O2氧化了SO2。
排除装置内O2干扰采取的措施是:在启动B中反应之前,___________ (填实验步骤),重新实验,C中无明显现象,所以SO2和CaCl2溶液不反应。
实验Ⅱ:探究SO2和Ca(ClO)2溶液的反应。
丁同学仅将上述实验C装置中氯化钙溶液换成漂白精溶液,进行实验时产生了大量白色沉淀。
(4)化学反应有两种情况。
①若SO2过量,则发生的反应为Ca(ClO)2+2SO2+2H2O=CaSO4↓+2HCl+H2SO4;
②若SO2少量,则发生的反应为___________ 。
(5)为了探究C中SO2是否过量,戊同学取少量C中上层清液于试管中,加入下列物质可以达到实验目的的是___________ (填字母)。
a.NaHCO3溶液
b.品红溶液
c.AgNO3溶液
d.紫色石蕊溶液
【文献资料】
①CaSO3是难溶于水、易溶于盐酸的白色固体;
②实验室用Na2SO3粉末和70%硫酸反应制备SO2;
③浓硫酸与水混合时放出大量的热,产生大量“酸雾”。
【设计实验】
实验Ⅰ:探究二氧化硫与氯化钙溶液的反应。

(1)若气体从左至右流动,选择装置并排序为
(2)D装置的作用是
(3)连接装置进行实验,发现C装置中产生白色沉淀。
①甲同学对白色沉淀成分提出如下假设:
假设1:白色沉淀是CaSO3;
假设2:白色沉淀是CaSO4;
假设3:白色沉淀是CaSO4和CaSO3。
②乙同学设计实验证明白色沉淀是CaSO4,他的实验方法和现象是
③丙同学认为C中生成硫酸钙的原因是装置内O2氧化了SO2。
排除装置内O2干扰采取的措施是:在启动B中反应之前,
实验Ⅱ:探究SO2和Ca(ClO)2溶液的反应。
丁同学仅将上述实验C装置中氯化钙溶液换成漂白精溶液,进行实验时产生了大量白色沉淀。
(4)化学反应有两种情况。
①若SO2过量,则发生的反应为Ca(ClO)2+2SO2+2H2O=CaSO4↓+2HCl+H2SO4;
②若SO2少量,则发生的反应为
(5)为了探究C中SO2是否过量,戊同学取少量C中上层清液于试管中,加入下列物质可以达到实验目的的是
a.NaHCO3溶液
b.品红溶液
c.AgNO3溶液
d.紫色石蕊溶液
您最近一年使用:0次
2 . 已知 ,某同学认为钠和
,某同学认为钠和 也可以发生类似的反应,他在实验室中选择如图所示的装置对钠与
也可以发生类似的反应,他在实验室中选择如图所示的装置对钠与 的反应进行了实验探究。依据要求回答问题:
的反应进行了实验探究。依据要求回答问题:
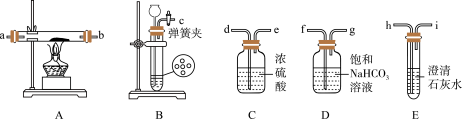
(1)实验室制备 的化学反应方程式为
的化学反应方程式为________
(2)为达到实验目的,题图装置的连接顺序为c→_______
(3)装置气密性良好,装好药品后打开弹簧夹,待装置中的空气排尽后点燃酒精灯。能说明装置中空气已经排尽的现象是____________
(4)该同学用稀盐酸与 反应制备
反应制备 ,向装置B中加入稀盐酸后,发现
,向装置B中加入稀盐酸后,发现 与稀盐酸没有接触。由于稀盐酸已经用完,为使反应顺利进行可再加入的试剂是
与稀盐酸没有接触。由于稀盐酸已经用完,为使反应顺利进行可再加入的试剂是______
A 稀硝酸 B 溶液 C 苯 D
溶液 C 苯 D 
(5)若反应过程中 足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:
足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:
①生成的固体物质为
②生成的固体物质为 和C的混合物
和C的混合物
③生成的固体物质为 和
和 的混合物
的混合物
④生成的固体物质为 和C的混合物
和C的混合物
该同学报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是________
(6)该同学经过反思,认为上述实验设计中存在缺陷。该缺陷是___________
 ,某同学认为钠和
,某同学认为钠和 也可以发生类似的反应,他在实验室中选择如图所示的装置对钠与
也可以发生类似的反应,他在实验室中选择如图所示的装置对钠与 的反应进行了实验探究。依据要求回答问题:
的反应进行了实验探究。依据要求回答问题:
(1)实验室制备
 的化学反应方程式为
的化学反应方程式为(2)为达到实验目的,题图装置的连接顺序为c→
(3)装置气密性良好,装好药品后打开弹簧夹,待装置中的空气排尽后点燃酒精灯。能说明装置中空气已经排尽的现象是
(4)该同学用稀盐酸与
 反应制备
反应制备 ,向装置B中加入稀盐酸后,发现
,向装置B中加入稀盐酸后,发现 与稀盐酸没有接触。由于稀盐酸已经用完,为使反应顺利进行可再加入的试剂是
与稀盐酸没有接触。由于稀盐酸已经用完,为使反应顺利进行可再加入的试剂是A 稀硝酸 B
 溶液 C 苯 D
溶液 C 苯 D 
(5)若反应过程中
 足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:
足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为

②生成的固体物质为
 和C的混合物
和C的混合物③生成的固体物质为
 和
和 的混合物
的混合物④生成的固体物质为
 和C的混合物
和C的混合物该同学报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是
(6)该同学经过反思,认为上述实验设计中存在缺陷。该缺陷是
您最近一年使用:0次
3 . 甲同学通过查询资料知道,一定浓度的硝酸与镁反应时,可得到二氧化氮、一氧化氮、氮气三种气体。该同学用下列仪器组装装置来直接验证有二氧化氮、一氧化氮生成并制取氮化镁 (假设实验中每步转化均是完全的) 。查阅文献得知:
①二氧化氮沸点为21.1 ℃、熔点为-11 ℃,一氧化氮沸点为-151 ℃、熔点为-164 ℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。
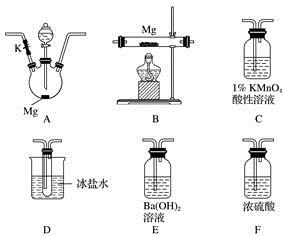
(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是________________________________ 。
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→____________ →E,确定还原产物中有二氧化氮的现象是______________________________________ ,实验中要多次使用装置F,第二次使用F的目的是______________________________________________ 。
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:________________________________ 。
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是______________________________________ 。
(5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成:__________________________ 。
①二氧化氮沸点为21.1 ℃、熔点为-11 ℃,一氧化氮沸点为-151 ℃、熔点为-164 ℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。

(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是
(5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成:
您最近一年使用:0次
2016-12-09更新
|
1389次组卷
|
10卷引用:同步君 必修1 第4章 第4节 硝酸
(已下线)同步君 必修1 第4章 第4节 硝酸高中化学人教版 必修1 第四章 非金属及其化合物 4.氨 硫酸 硝酸 硝酸2015-2016学年江苏省扬州中学高一下期中化学试卷云南省元江县一中2018-2019学年高一上学期12月考试化学试题贵州省剑河县二中2018-2019学年高一上学期期末考试化学试题云南省玉溪市通海二中2020-2021学年高一下学期期中考试化学试题辽宁省沈阳市第一二〇中学2021-2022学年高一下学期线上教学质量检测期中考试化学试题2016届湖北省沙市中学高三下第一次半月考理综化学试卷内蒙古集宁一中2019-2020学年高二下学期第二次月考化学试题山西省忻州市静乐县第一中学2019-2020学年高二下学期第一次月考化学试题
21-22高一·全国·课时练习
4 . 某化学小组同学发现“84”消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混和有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2。
(1)若用次氯酸钙、浓盐酸为原料,利用如图装置制取Cl2.装置中仪器a的名称为_______ 。
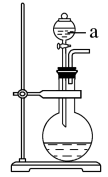
(2)甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,观察有无色气泡产生。乙同学认为不合理,理由是_______ 。
(3)某实验小组对氯水成分和性质进行研究,实验如图:
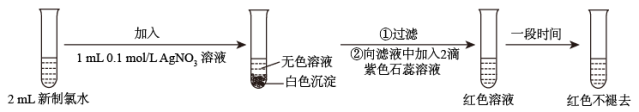
甲同学认为,“红色不褪去”不是因为氯水被稀释所致。乙同学持反对意见。为了证明甲同学错误,乙同学继续以下实验,请在横线上补充所加入的试剂和观察到的现象。
加入:_______ ,现象:_______ 。
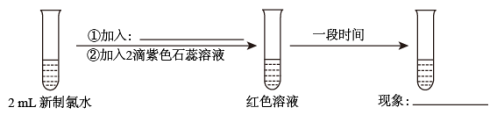
(4)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如图装置制备无水FeCl3。
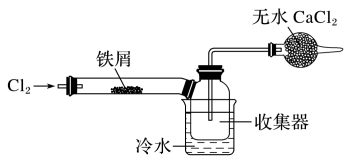
①下列操作步骤的正确排序为_______ (填字母)
a.体系冷却后,停止通入Cl2
b.通入干燥的Cl2赶尽装置中的空气
c.在铁屑下方加热至反应完成
d.用干燥的H2赶尽Cl2
e.检验装置的气密性
②该实验装置存在的明显缺陷是_______ 。
(1)若用次氯酸钙、浓盐酸为原料,利用如图装置制取Cl2.装置中仪器a的名称为

(2)甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,观察有无色气泡产生。乙同学认为不合理,理由是
(3)某实验小组对氯水成分和性质进行研究,实验如图:

甲同学认为,“红色不褪去”不是因为氯水被稀释所致。乙同学持反对意见。为了证明甲同学错误,乙同学继续以下实验,请在横线上补充所加入的试剂和观察到的现象。
加入:

(4)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如图装置制备无水FeCl3。

①下列操作步骤的正确排序为
a.体系冷却后,停止通入Cl2
b.通入干燥的Cl2赶尽装置中的空气
c.在铁屑下方加热至反应完成
d.用干燥的H2赶尽Cl2
e.检验装置的气密性
②该实验装置存在的明显缺陷是
您最近一年使用:0次
5 . 某化学小组采用下图所示装置制备 并探究其化学性质,下列说法错误的是
并探究其化学性质,下列说法错误的是
 并探究其化学性质,下列说法错误的是
并探究其化学性质,下列说法错误的是
| A.加入药品之前,应先检查装置的气密性 |
| B.通过对装置C和E中的产物分析,可判断温度对Cl2与碱溶液反应的影响 |
| C.装置D中的现象为溶液逐渐变成浅黄绿色 |
| D.装置B中NaOH溶液的作用为吸收挥发出来的HCl |
您最近一年使用:0次
2021-07-14更新
|
627次组卷
|
7卷引用:第2章第二节第2课时氯气的实验室制法 氯离子的检验(课中)——课前、课中、课后同步专题精编(人教版2019必修第一册)
第2章第二节第2课时氯气的实验室制法 氯离子的检验(课中)——课前、课中、课后同步专题精编(人教版2019必修第一册)(已下线)3.1.2 氯气的性质与应用-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)内蒙古自治区通辽市科左中旗实验高级中学2020-2021学年高一下学期期末考试化学试题(已下线)专题2.2.3 氯气的制备(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)易错专题17 氯气的实验室制法-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)(已下线)考点09 氯及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
20-21高一上·全国·课时练习
名校
解题方法
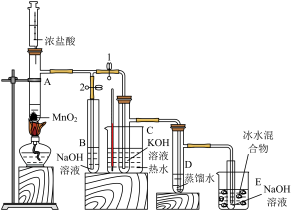
6 . 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质。甲同学设计了如图所示的实验装置(部分支撑用的铁架台省略)。
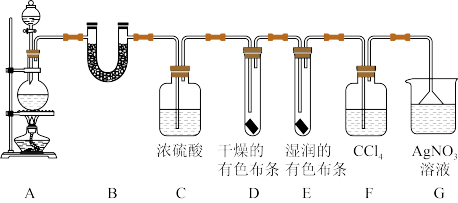
按要求回答下列问题。
(1)若用含有7.3 g HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2总是小于3.55 g的原因是__ 。
(2)①装置B中盛放的试剂名称为____ ,作用是_____ ,现象是_____ 。
②装置D和E中出现的不同现象说明的问题是_____ 。
③装置F的作用是______ 。
④写出装置G中发生反应的离子方程式_____ 。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在______ 与______ 之间(填装置标号),装置中应放入_______ (填试剂或用品名称)。

按要求回答下列问题。
(1)若用含有7.3 g HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2总是小于3.55 g的原因是
(2)①装置B中盛放的试剂名称为
②装置D和E中出现的不同现象说明的问题是
③装置F的作用是
④写出装置G中发生反应的离子方程式
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在
您最近一年使用:0次
14-15高一上·安徽淮北·期末
名校
解题方法
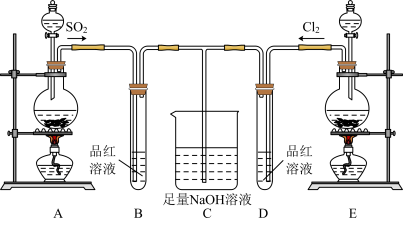
7 . 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下实验装置:__ 。
(2)实验室可用装置E通过MnO2和浓盐酸反应制备Cl2,若有6molHCl参加反应,则转移电子的总数为___ 。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象分别是:B__ ,D___ 。停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别是:B__ ,D__ 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会更强。他们将制得的SO2和Cl2按物质的量之比为1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析产生该现象的原因:__ (用化学方程式表示)。
(2)实验室可用装置E通过MnO2和浓盐酸反应制备Cl2,若有6molHCl参加反应,则转移电子的总数为
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象分别是:B
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会更强。他们将制得的SO2和Cl2按物质的量之比为1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析产生该现象的原因:
您最近一年使用:0次
2020-09-16更新
|
154次组卷
|
8卷引用:鲁科版(2019)高一必修第一册第三章易错疑难集训(二)
鲁科版(2019)高一必修第一册第三章易错疑难集训(二)高一必修第一册(苏教2019版)专题4 第一单元 含硫化合物的性质 易错疑难集训(已下线)2013-2014学年安徽省濉溪县高一上学期期末考试化学试卷(已下线)2013-2014学年河南省平顶山市高一第一学期期末调研考试化学试卷2014-2015甘肃省白银市会宁县五中高一上学期期末化学试卷【全国百强校】西藏自治区拉萨中学2017-2018学年高一下学期期中考试化学试题吉林省公主岭市范家屯镇第一中学2019-2020学年高一上学期期末考试化学试题陕西省西安市选课分科摸底考2023-2024学年高一下学期4月月考化学试题
8 . 某校化学实验兴趣小组探究实验室中制备 Cl2的过程,为证明过程中有水蒸气和 HCl 挥发出来,同时证明Cl2的某些性质,甲同学设计了如下图所示的实验装置,按要求回答问题。

(1)用浓盐酸与足量的 MnO2反应制Cl2的化学反应方程式_____ 。
(2)①装置 B 中盛放的试剂名称为_____ ,作用是_____ ,现象是_____ 。
②装置 D 和E 中出现的不同现象说明的问题是_________ 。
③装置 F 的作用是_____ 。
④写出装置G 中发生反应的离子方程式_____ 。

(1)用浓盐酸与足量的 MnO2反应制Cl2的化学反应方程式
(2)①装置 B 中盛放的试剂名称为
②装置 D 和E 中出现的不同现象说明的问题是
③装置 F 的作用是
④写出装置G 中发生反应的离子方程式
您最近一年使用:0次
2020-05-02更新
|
492次组卷
|
3卷引用:北京市人大附中朝阳学校2019~2020年度第二学期高一年级阶段练习化学化学试题(合格班)
北京市人大附中朝阳学校2019~2020年度第二学期高一年级阶段练习化学化学试题(合格班)安徽省池州市江南教育集团2021届高三上学期1月月考化学试题(已下线)单科化学-2021年秋季高三开学摸底考试卷02(课标全国专用)
解题方法
9 . 乙烯是一种重要的化工原料,某同学设计实验探究工业制备乙烯的原理和乙烯的主要化学性质,实验装置如图所示。
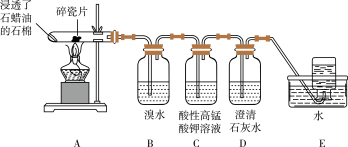
(1)用化学反应方程式解释 装置中的实验现象:
装置中的实验现象:________________________ 。
(2) 装置中的现象是
装置中的现象是________________ ,其发生反应的类型是________________ 。
(3)查阅资料可知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________ (填序号)中的实验现象可判断该资料是否真实。
(4)通过上述实验探究可知,检验甲烷和乙烯的方是________ (填序号,下同);除去甲烷中乙烯的方法是________ 。
a.将气体通入水中
b.将气体通过装溴水的洗气瓶
c.将气体通过装酸性高锰酸钾溶液的洗气瓶
d.将气体通入氢氧化钠溶液中

(1)用化学反应方程式解释
 装置中的实验现象:
装置中的实验现象:(2)
 装置中的现象是
装置中的现象是(3)查阅资料可知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置
(4)通过上述实验探究可知,检验甲烷和乙烯的方是
a.将气体通入水中
b.将气体通过装溴水的洗气瓶
c.将气体通过装酸性高锰酸钾溶液的洗气瓶
d.将气体通入氢氧化钠溶液中
您最近一年使用:0次
10 . 石蜡油分解可产生乙烯。乙烯是一种重要的化工原料,某同学设计实验探究工业制备乙烯的原理和乙烯的主要化学性质,实验装置如图所示。
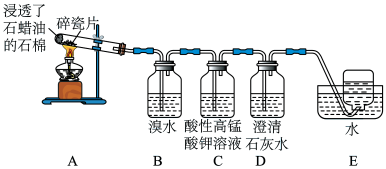
(1)用化学反应方程式解释B装置中的实验现象:_________ 。
(2)C装置中的现象是_________ ,其发生反应的类型是__________ 。
(3)查阅资料可知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_______ (填序号)中的实验现象可判断该资料是否真实。

(1)用化学反应方程式解释B装置中的实验现象:
(2)C装置中的现象是
(3)查阅资料可知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置
您最近一年使用:0次
2020-04-11更新
|
576次组卷
|
3卷引用:课时1 乙烯 烃的分类——A学习区 夯实基础(人教版(2019)第二册)



