名校
解题方法
1 . 实验小组利用传感器探究Na2CO3和NaHCO3的性质。
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱
【实验过程】
【分析与解释】
(1)实验I中,溶解时吸收热量的物质是_______ 。
(2)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为_______ ,OH-未参与该反应的实验证据是_______ 。
(3)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,造成这种差异是由于滴加NaHCO3溶液的烧杯中有_______ (填写离子符号)参与反应。
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱
【实验过程】
| 编号 | 实验操作 | 实验数据 |
| 实验I | 测量下述实验过程的温度变化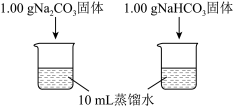 | 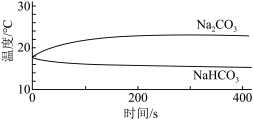 |
| 实验II | 测量下述实验过程的pH变化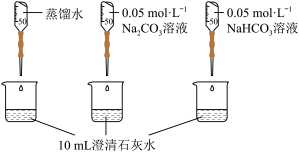 |  |
(1)实验I中,溶解时吸收热量的物质是
(2)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为
(3)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,造成这种差异是由于滴加NaHCO3溶液的烧杯中有
您最近一年使用:0次
2022-11-30更新
|
293次组卷
|
13卷引用:高一必修第一册(苏教2019)专题3 第二单元 金属钠及钠的化合物4
高一必修第一册(苏教2019)专题3 第二单元 金属钠及钠的化合物4北京市2020年普通高中学业水平合格性模拟考试化学试题2020年北京市第一次普通高中学业水平合格性考试化学试题北京市回民学校2020-2021学年高一上学期期中考试化学试题北京市第三十一中学2020—2021学年度高一下学期期中考试化学试题北京第七中学2020-2021学年高一下学期期中考试化学试题天津市红桥区2020-2021学年高一下学期期末考试化学试题(已下线)北京市第四中学2022-2023学年高一上学期期中考试化学试题北京市第四十三中学2022-2023学年高一上学期期中考试化学试题北京市第八中学2022-2023学年高一下学期期末考试化学试题(已下线)专题八 钠及其化合物北京市第十一中学2023-2024学年高一上学期期中考试化学试题北京市月坛中学2023-2024学年高一上学期期中考试化学试题
解题方法
2 . 乙酸俗称_______ ,其分子式为_______ ,其官能团为_______ 。乙酸是一种比碳酸_______ (填“强”或“弱”)的酸,向少量碳酸钙粉末中加入少量乙酸,可观察到的现象为_______ ,其反应的化学方程式为_______ 。由此实验可以得到的结论是_______ 的酸性比_______ 的酸性强。
您最近一年使用:0次
3 . 某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明,浓硝酸能将一氧化氮氧化成二氧化氮,而稀硝酸不能氧化一氧化氮。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
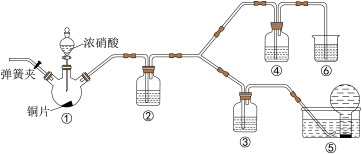
可选试剂:浓硝酸,稀硝酸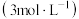 ,蒸馏水,浓硫酸,NaOH溶液。
,蒸馏水,浓硫酸,NaOH溶液。
已知:NaOH溶液不与一氧化氮反应,能与二氧化氮反应。

(1)做实验时应避免将有害气体排放到空气中,装置③④⑥中盛放的试剂依次是_______ 、_______ 、_______ 。
(2)装置①中所发生反应的化学方程式是_______ 。
(3)装置②的作用是_______ ,其中所发生反应的化学方程式是_______ 。
(4)该小组得出结论所依据的实验现象是_______ 。

可选试剂:浓硝酸,稀硝酸
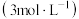 ,蒸馏水,浓硫酸,NaOH溶液。
,蒸馏水,浓硫酸,NaOH溶液。已知:NaOH溶液不与一氧化氮反应,能与二氧化氮反应。

(1)做实验时应避免将有害气体排放到空气中,装置③④⑥中盛放的试剂依次是
(2)装置①中所发生反应的化学方程式是
(3)装置②的作用是
(4)该小组得出结论所依据的实验现象是
您最近一年使用:0次
4 . 为了比较铁、铜的还原性强弱,两位同学分别设计了如下方案:
甲方案:分别将铁片和铜片插入稀硝酸中,有气体产生的是铁,无气体产生的是铜。
乙方案:用惰性电极电解浓度均为 的
的 和
和 的混合溶液,首先在阴极上析出的是铜。
的混合溶液,首先在阴极上析出的是铜。
(1)请对两位同学的方案作出评价________ 。
(2)请设计另外两种方案,证明铁的还原性强于铜________ 。
甲方案:分别将铁片和铜片插入稀硝酸中,有气体产生的是铁,无气体产生的是铜。
乙方案:用惰性电极电解浓度均为
 的
的 和
和 的混合溶液,首先在阴极上析出的是铜。
的混合溶液,首先在阴极上析出的是铜。(1)请对两位同学的方案作出评价
(2)请设计另外两种方案,证明铁的还原性强于铜
您最近一年使用:0次
5 . 甲同学采用图Ⅰ装置验证铜与稀硝酸的反应,并用排水法收集NO气体。
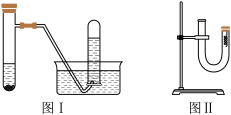
(1)反应过程中的实验现象是_________ 。
(2)乙同学认为虽然收集到的气体为一氧化氮,但并不能说明反应中一定生成一氧化氮。你认为他的理由是_________ 。
(3)丙同学采用图Ⅱ装置进行实验,证明了铜与稀硝酸反应生成一氧化氮。该实验的步骤如下表所示,请在表格中填写对应的实验现象。
(4)从环境保护角度看,丙同学的实验存在什么缺陷_________ 。

(1)反应过程中的实验现象是
(2)乙同学认为虽然收集到的气体为一氧化氮,但并不能说明反应中一定生成一氧化氮。你认为他的理由是
(3)丙同学采用图Ⅱ装置进行实验,证明了铜与稀硝酸反应生成一氧化氮。该实验的步骤如下表所示,请在表格中填写对应的实验现象。
| 实验步骤 | 实验现象 |
| ①从U形管左端加入稀硝酸,直至充满U形管右端 | — |
| ②用附有铜丝的胶塞塞住U形管右端,观察现象 | |
| ③待反应停止后打开胶塞,观察实现现象 |
您最近一年使用:0次
解题方法
6 . 如下图所示,将两只气球中少量的 和
和 粉末同时倒入足量的盐酸中,写出反应的现象和有关的化学方程式
粉末同时倒入足量的盐酸中,写出反应的现象和有关的化学方程式_______ 。
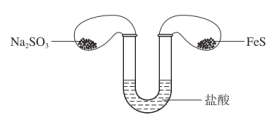
 和
和 粉末同时倒入足量的盐酸中,写出反应的现象和有关的化学方程式
粉末同时倒入足量的盐酸中,写出反应的现象和有关的化学方程式
您最近一年使用:0次
解题方法
7 . 酸类物质能够表现出一些共同的性质,其水溶液中都含有H+。下列关于HCl性质的描述中,不属于酸的共同性质的是
| A.能与Na2O反应生成盐和水 | B.能与Ca(OH)2反应生成盐和水 |
| C.能与AgNO3溶液反应生成白色沉淀 | D.能使紫色石蕊溶液变红 |
您最近一年使用:0次
2022-11-11更新
|
180次组卷
|
4卷引用:作业(十) 物质的类别与物质的性质
名校
解题方法
8 . 某小组通过实验探究 和Na2CO3的性质。
和Na2CO3的性质。
实验一:探究 和Na2CO3的溶解性和水溶液的酸碱性。
和Na2CO3的溶解性和水溶液的酸碱性。
根据上述实验现象,回答下列问题:
(1)常温下, 的溶解度
的溶解度________ (填“大于”“小于”或“等于”)Na2CO3的溶解度。
(2)下列推断正确的是________(填字母)。
实验二:探究 和Na2CO3的热稳定性。
和Na2CO3的热稳定性。
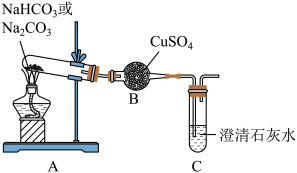
观察到的实验现象如下表所示:
根据上述实验现象,回答下列问题:
(3)加热Na2CO3时,装置C中产生气泡的原因是_______ 。
(4)实验结论是________ 。
(5)加热 发生反应的化学方程式为
发生反应的化学方程式为_________ 。
 和Na2CO3的性质。
和Na2CO3的性质。实验一:探究
 和Na2CO3的溶解性和水溶液的酸碱性。
和Na2CO3的溶解性和水溶液的酸碱性。| 步骤 | 实验操作 | 观察到的实验现象 | |
| Na2CO3 |  | ||
| ① | 在2支试管里分别加入1g 和Na2CO3,各加入10mL水,振荡 和Na2CO3,各加入10mL水,振荡 | 全部溶解,得到透明溶液 | 部分溶解,试管底部有少许固体 |
| ② | 将步骤①的试管中溶液分别分成两份,其中1份溶液中各滴加2滴酚酞溶液 | 溶液变红色 | 溶液变浅红色 |
| ③ | 在步骤②的另两份溶液中各滴加2滴10%盐酸,振荡 | 没有气泡产生 | 产生少量气泡 |
(1)常温下,
 的溶解度
的溶解度(2)下列推断正确的是________(填字母)。
| A.碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性 |
| B.碳酸钠溶液、碳酸氢钠溶液都呈碱性 |
| C.碳酸钠溶液、碳酸氢钠溶液都呈酸性 |
| D.碳酸钠溶液呈碱性,碳酸氢钠溶液呈中性 |
实验二:探究
 和Na2CO3的热稳定性。
和Na2CO3的热稳定性。
观察到的实验现象如下表所示:
| 物质 | 装置B中现象 | 装置C中现象 |
| Na2CO3 | 无明显变化 | 开始断断续续产生气泡,一会儿后,没有气泡,溶液保持澄清 |
 | 白色粉末变蓝色 | 开始断断续续产生气泡,一会儿后,产生连续气泡,溶液变浑浊 |
(3)加热Na2CO3时,装置C中产生气泡的原因是
(4)实验结论是
(5)加热
 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
2022-11-04更新
|
241次组卷
|
3卷引用:第一节 钠及其化合物 第2课时 钠的化合物 焰色试验
9 . 乙醇是生活中常见的有机物,下列有关乙醇的实验操作或实验现象正确的是
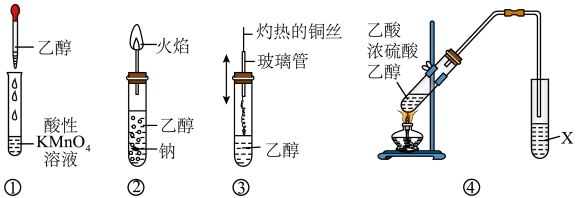

| A.①中酸性KMnO4溶液不会褪色 |
| B.②中钠会在乙醇内部上下跳动,上方的火焰为淡蓝色 |
| C.③中灼热的铜丝插入乙醇中,铜丝由红色变为黑色 |
| D.④中X是饱和NaOH溶液,X液面上有油状液体生成 |
您最近一年使用:0次
2022-09-14更新
|
560次组卷
|
4卷引用:实验活动9 乙醇、乙酸的主要性质
实验活动9 乙醇、乙酸的主要性质湖南省长沙市宁乡市2020-2021学年高一下学期期末调研考试化学试题(已下线)专题09 乙醇 乙酸 基本营养物质(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)(已下线)热点09 乙醇与乙酸
10 . 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表所示:
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理:___________ (填“合理”或“不合理”)。
(2)将铝与Fe2O3混合后放入漏斗中,然后引发铝热反应的实验操作是___________ 。
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是___________ ,反应的离子方程式为___________ 。
(4)实验室溶解该熔融物,下列试剂中最好的是___________(填序号)。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理:
(2)将铝与Fe2O3混合后放入漏斗中,然后引发铝热反应的实验操作是
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(4)实验室溶解该熔融物,下列试剂中最好的是___________(填序号)。
| A.浓硫酸 |
| B.稀硫酸 |
| C.稀硝酸 |
| D.氢氧化钠溶液 |
您最近一年使用:0次



