1 . 过氧化钙(CaO2)广泛应用于水产养殖、污水处理,是优良的供氧剂。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:______________ 。
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是_______________________ 。
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②____________________________ ;③视线和凹液面最低处保持水平再读数。
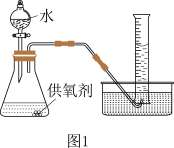
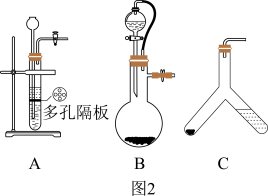
(4)用此装置测得的含量会偏大,原因是________________ ,为了避免此误差可将发生装置换成图2中的装置B或C。
方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。
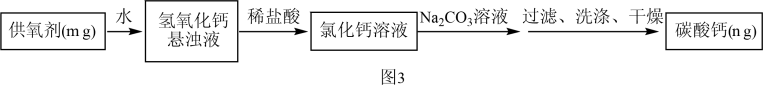
(5)滴加的Na2CO3溶液要过量的原因是_________________________ 。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②

(4)用此装置测得的含量会偏大,原因是

方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。

(5)滴加的Na2CO3溶液要过量的原因是
您最近一年使用:0次
20-21高二下·山东淄博·阶段练习
名校
解题方法
2 . 某学习小组设计制取SO2并验证其部分性质的实验装置图如图(夹持装置省略)。下列叙述正确的是


| A.取反应后D中溶液少许,滴加品红溶液,红色褪去就能说明SO2具有漂白性 |
| B.A装置中比较理想的反应物质是Na2SO3固体和质量分数为10%的硫酸 |
C.B装置溶液变为红色,说明SO2是酸性氧化物;C装置产生白色沉淀的原因为:BaCl2+SO2+H2O BaSO3↓+2HCl BaSO3↓+2HCl |
| D.关闭弹簧夹a,打开弹簧夹b,用酒精灯在三颈烧瓶下微热,若能观察到C中长导管口有明显气泡现象,冷却后液体倒吸,就能判断装置A、B部分气密性良好 |
您最近一年使用:0次
2021-04-06更新
|
937次组卷
|
11卷引用:课后-5.1.1 硫和二氧化硫-人教2019必修第二册
(已下线)课后-5.1.1 硫和二氧化硫-人教2019必修第二册山东省淄博市高青县第一中学2020-2021学年高二下学期第一次月考化学试题(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第11讲 硫及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)山西省长治市第二中学校2021-2022学年高一下学期期中考试化学试题(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题四 非金属及其化合物 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)辽宁省锦州市育明高级中学2022-2023学年高一下学期第一次阶段性考试化学试题(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省常熟市王淦昌高级中学2022-2023学年高二下学期5月月考化学试卷
名校
解题方法
3 . 某学校化学兴趣小组设计如下实验探究铁的电化学腐蚀原理。
(1)实验一:甲小组同学设计如图所示装置证明铁发生了电化学腐蚀。
①用电极反应解释实验a的现象:________ 。
②写出实验b中生成蓝色沉淀的离子方程式:________ 。
③已知 具有氧化性。据此有同学认为仅通过实验b的现象不能证明铁发生了电化学腐蚀,理由是
具有氧化性。据此有同学认为仅通过实验b的现象不能证明铁发生了电化学腐蚀,理由是_________ 。
(2)实验二:乙小组同学向如图所示装置的容器a、b中分别加入 的
的 溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
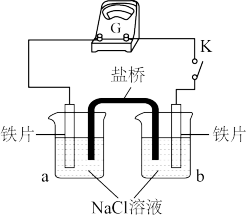
①分别取少量容器a、b中的溶液于试管中,滴加 溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,容器b中铁片做
溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,容器b中铁片做_______ 极。
②加热后,电流计指针发生偏转的原因可能是_______ 。
(3)实验三:丙小组同学向如图所示装置的容器a、b中各加入 不同质量分数的
不同质量分数的 溶液,实验数据如表所示:
溶液,实验数据如表所示:
则实验Ⅱ的容器b中发生的电极反应是______ 。
(1)实验一:甲小组同学设计如图所示装置证明铁发生了电化学腐蚀。
装置 | 分别进行的实验 | 现象 |
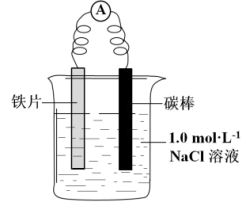 | a.连接好装置,一段时间后,向烧杯中滴加酚酞溶液 | 碳棒附近溶液变红 |
b连接好装置,一段时间后,向烧杯中滴加 溶液 溶液 | 铁片表面产生蓝色沉淀 |
①用电极反应解释实验a的现象:
②写出实验b中生成蓝色沉淀的离子方程式:
③已知
 具有氧化性。据此有同学认为仅通过实验b的现象不能证明铁发生了电化学腐蚀,理由是
具有氧化性。据此有同学认为仅通过实验b的现象不能证明铁发生了电化学腐蚀,理由是(2)实验二:乙小组同学向如图所示装置的容器a、b中分别加入
 的
的 溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
①分别取少量容器a、b中的溶液于试管中,滴加
 溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,容器b中铁片做
溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,容器b中铁片做②加热后,电流计指针发生偏转的原因可能是
(3)实验三:丙小组同学向如图所示装置的容器a、b中各加入
 不同质量分数的
不同质量分数的 溶液,实验数据如表所示:
溶液,实验数据如表所示:实验标号 | 容器a | 容器b | 电流计指针偏转方向 |
Ⅰ | 0.1% | 0.01% | 向右 |
Ⅱ | 0.1% | 3.5% | 向左 |
Ⅲ | 3.5% | 饱和溶液 | 向右 |
则实验Ⅱ的容器b中发生的电极反应是
您最近一年使用:0次
2020-09-19更新
|
279次组卷
|
4卷引用:鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第4节 金属的腐蚀与防护
解题方法
4 . 学习小组同学查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为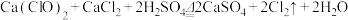 。他们设计如图所示装置,进行了制取氯气并验证其性质的实验。
。他们设计如图所示装置,进行了制取氯气并验证其性质的实验。
试回答下列问题:
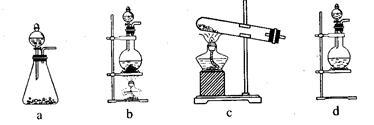
(1)该实验中A部分的装置是______________________ (填字母)。

a b c d
(2)请你帮助他们设计一个实验,证明洗气瓶C中的 已被氧化(简述实验步骤):
已被氧化(简述实验步骤):_________
______________________________________________ 。
(3)写出D装置中发生反应的化学方程式:________________________________________________ 。
(4)该实验存在明显的缺陷,请你提出改进的方法:________________________________________ 。
(5)该小组同学又进行了如下实验:称取漂白粉 ,研磨后溶解,配制成
,研磨后溶解,配制成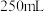 溶液。取
溶液。取 于锥形瓶中,再加入过量KI溶液和过量的
于锥形瓶中,再加入过量KI溶液和过量的 溶液,静置。待完全反应后,用
溶液,静置。待完全反应后,用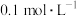 的
的 溶液测定反应生成的碘,已知测定过程中发生反应的化学方程式为
溶液测定反应生成的碘,已知测定过程中发生反应的化学方程式为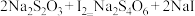 ,共用去
,共用去 溶液
溶液 。则该漂白粉中
。则该漂白粉中 的质量分数为
的质量分数为_______________________ 。
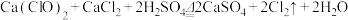 。他们设计如图所示装置,进行了制取氯气并验证其性质的实验。
。他们设计如图所示装置,进行了制取氯气并验证其性质的实验。
试回答下列问题:
(1)该实验中A部分的装置是

a b c d
(2)请你帮助他们设计一个实验,证明洗气瓶C中的
 已被氧化(简述实验步骤):
已被氧化(简述实验步骤):(3)写出D装置中发生反应的化学方程式:
(4)该实验存在明显的缺陷,请你提出改进的方法:
(5)该小组同学又进行了如下实验:称取漂白粉
 ,研磨后溶解,配制成
,研磨后溶解,配制成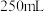 溶液。取
溶液。取 于锥形瓶中,再加入过量KI溶液和过量的
于锥形瓶中,再加入过量KI溶液和过量的 溶液,静置。待完全反应后,用
溶液,静置。待完全反应后,用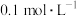 的
的 溶液测定反应生成的碘,已知测定过程中发生反应的化学方程式为
溶液测定反应生成的碘,已知测定过程中发生反应的化学方程式为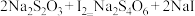 ,共用去
,共用去 溶液
溶液 。则该漂白粉中
。则该漂白粉中 的质量分数为
的质量分数为
您最近一年使用:0次
21-22高一·全国·课时练习
5 . 课外活动小组欲制取次氯酸钠和氯化钠的混合溶液,为提高次氯酸钠的含量,用如图所示装置。图中瓶乙盛饱和食盐水,瓶丙盛放浓硫酸,分液漏斗A中盛浓盐酸。(据资料显示:Cl2与NaOH在不同温度下,产物不同。在较高温度下易生成NaClO3)

试回答:
(1)烧瓶B中盛___ 固体,试管C中盛___ 溶液。
(2)有同学认为可以省去某些装置,你认为怎样:
①能否省去乙装置___ (填“能”或“不能”),理由是___ 。
②装置丙是否有必要___ (填“有”或“没有”),理由是___ 。
(3)有同学认为还必须加入某些装置,你认为怎样?___ (填“需要”或“不需要”),如果你认为需要,请指出该装置的作用____ 。
(4)丁装置中冰水的作用是___ 。

试回答:
(1)烧瓶B中盛
(2)有同学认为可以省去某些装置,你认为怎样:
①能否省去乙装置
②装置丙是否有必要
(3)有同学认为还必须加入某些装置,你认为怎样?
(4)丁装置中冰水的作用是
您最近一年使用:0次
名校
解题方法
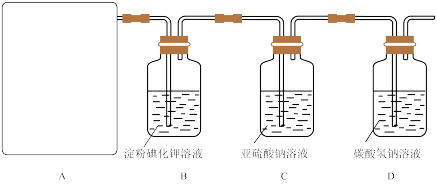
6 . 为了探究Cl2、SO2同时通入水中所发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
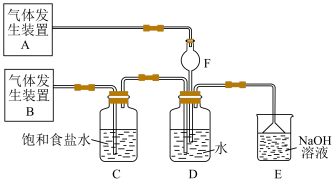
(1)该化学兴趣小组的同学采用Na2SO3与质量分数为70%的硫酸为原料制取SO2,采用MnO2与浓盐酸为原料制取Cl2。在此实验中,仪器 的作用是
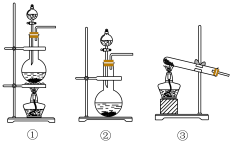
的作用是______ ;气体发生装置B应选择下列装置中的____________ (填序号)。
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,该化学兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④酸性高锰酸钾溶液
若Cl2过量,取适量D中溶液滴加至盛有______ (填序号)的试管中,再加入______ (填序号),产生的现象是______ 。
若SO2过量,取适量D中溶液滴加至盛有______ (填序号)的试管中,产生的现象是______ 。

(1)该化学兴趣小组的同学采用Na2SO3与质量分数为70%的硫酸为原料制取SO2,采用MnO2与浓盐酸为原料制取Cl2。在此实验中,仪器
 的作用是
的作用是
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,该化学兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④酸性高锰酸钾溶液
若Cl2过量,取适量D中溶液滴加至盛有
若SO2过量,取适量D中溶液滴加至盛有
您最近一年使用:0次
2020-03-04更新
|
636次组卷
|
4卷引用:人教版(2019)必修第二册第五章第一节课时1
名校
解题方法
7 . 为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________ 。
(2)该实验可以证明SO2具有_________ 性;H2O2的氧化性_________ Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________ ,B中重新变成红棕色的原因____________________________________ (均用离子方程式表示)。
(4)C中产生的白色沉淀是______ 。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________ 的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
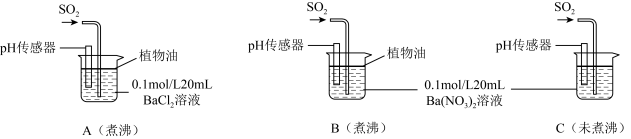
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________ 。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________ 。若实验B、C中通入足量的SO2后,溶液酸性:B_________ C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________ 。

| 实验操作 | 实验现象 |
| i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(2)该实验可以证明SO2具有
(3)B中红棕色褪去的原因
(4)C中产生的白色沉淀是
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:

①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是
您最近一年使用:0次
2020-01-18更新
|
643次组卷
|
3卷引用:专题4 第一单元 第2课时硫酸的制备与性质-高中化学苏教2019版必修第一册
解题方法
8 . 烟道气中的 是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
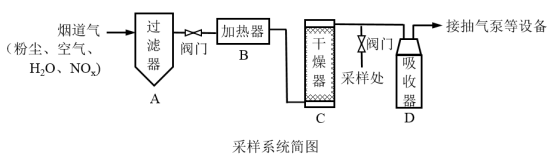
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
(1)A中装有无碱玻璃棉,其作用为___________ 。
(2)C中填充的干燥剂是(填序号)___________ 。
a.碱石灰 b.无水 c.
c.
(3)用实验室常用仪器组装一套装置,其作用与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。____

(4)采样步骤②加热烟道气的目的是___________ 。
 是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
(1)A中装有无碱玻璃棉,其作用为
(2)C中填充的干燥剂是(填序号)
a.碱石灰 b.无水
 c.
c.
(3)用实验室常用仪器组装一套装置,其作用与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。

(4)采样步骤②加热烟道气的目的是
您最近一年使用:0次
2021-01-08更新
|
260次组卷
|
2卷引用:专题7 第一~二单元 综合拔高练-高中化学必修第二册苏教版2019
20-21高一上·全国·课时练习
名校
解题方法
9 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对某绿矾样品进行了如下探究,请回答下列有关问题:
(1)在试管中加入少量该绿矾样品,加水溶解,分别滴加稀硫酸和KSCN溶液,溶液颜色无明显变化,由此得出的结论是__ 。若向试管中继续通入空气,观察到溶液逐渐变红,说明溶液中的Fe2+转化为___ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按图示连接好装置进行实验。
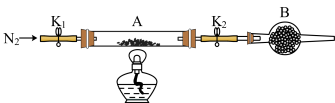
①仪器B的名称是__ ;B中可加入下列试剂中的__ (填标号)。
a.Al2O3 b.Ca(OH)2 c.CuSO4 d.NaCl
②打开K1和K2,缓缓通入N2,点燃酒精灯,加热,接下来的实验操作步骤正确排序是__ (填标号)。
a.熄灭酒精灯 b.关闭K1和K2
c.称量A d.冷却到室温
(1)在试管中加入少量该绿矾样品,加水溶解,分别滴加稀硫酸和KSCN溶液,溶液颜色无明显变化,由此得出的结论是
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按图示连接好装置进行实验。

①仪器B的名称是
a.Al2O3 b.Ca(OH)2 c.CuSO4 d.NaCl
②打开K1和K2,缓缓通入N2,点燃酒精灯,加热,接下来的实验操作步骤正确排序是
a.熄灭酒精灯 b.关闭K1和K2
c.称量A d.冷却到室温
您最近一年使用:0次
10 . 某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。

试回答:
(1)该实验中A部分的装置是_______ (填写装置的序号)。
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):_______ 。
(3)写出D装置中发生反应的离子方程式_______ 。
(4)该实验存在明显的缺陷,请你提出改进的方法_______ 。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 ml 溶液,取25 ml 加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3 + I2 = Na2S4O6 + 2NaI
反应完成时,共用去Na2S2O3 20.0 ml。则该漂白粉中Ca(ClO)2的质量分数为:_______
 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
试回答:
(1)该实验中A部分的装置是

(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
(3)写出D装置中发生反应的离子方程式
(4)该实验存在明显的缺陷,请你提出改进的方法
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 ml 溶液,取25 ml 加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3 + I2 = Na2S4O6 + 2NaI
反应完成时,共用去Na2S2O3 20.0 ml。则该漂白粉中Ca(ClO)2的质量分数为:
您最近一年使用:0次



