22-23高一下·四川泸州·期末
名校
解题方法
1 . 教师在课堂上通过以下装置对原电池的原理和形成条件开展了实验探究,结合探究判断下列说法不正确 的是
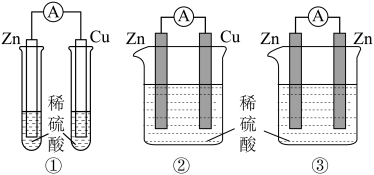
| A.通过装置①金属表面是否产生气泡,可证明Zn比Cu活泼 |
| B.对比①②中Cu片上是否有气泡,可预测②中电流表指针会偏转 |
| C.装置②③对比实验的目的是:探究原电池电极材料应满足的条件 |
D.装置③能形成原电池,正极的电极反应式为: |
您最近一年使用:0次
2023-07-12更新
|
221次组卷
|
4卷引用:6.1.2化学反应与电能课后作业提高篇
名校
解题方法
2 . 将SO2分别通入下列4种溶液中,有关说法正确的是( )
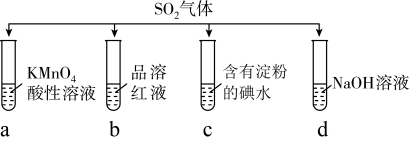

| A.试管a中实验可以证明SO2具有漂白性 |
| B.试管b中溶液褪色,说明SO2具有强氧化性 |
| C.试管c中蓝色退去,说明还原性:SO2>I- |
| D.试管d中无明显现象,说明SO2不是酸性氧化物 |
您最近一年使用:0次
2020-01-18更新
|
430次组卷
|
3卷引用:专题4 第一单元 第1课时二氧化硫的性质和应用-高中化学苏教2019版必修第一册
3 . 某同学用下列装置制备并检验Cl2的性质。下列说法中正确的是( )
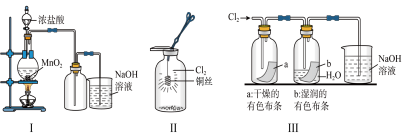

| A.Ⅰ图中如果MnO2过量,浓盐酸就可全部消耗完 |
| B.将Ⅰ图中MnO2换成浓硫酸,撤去酒精灯后可以用于制取少量HCl气体 |
| C.Ⅱ图中铜丝在氯气中燃烧,生成棕黄色的烟 |
| D.若将Ⅲ图装置直接与Ⅰ图发生装置连接,可用于证明干燥的氯气无漂白性 |
您最近一年使用:0次
2019-09-30更新
|
412次组卷
|
4卷引用:专题06 氯及其化合物(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学
(已下线)专题06 氯及其化合物(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学第2章 总结与检测(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)第2章 总结与检测(1)——《高中新教材同步备课》(鲁科版 必修第一册)山东省菏泽市单县第五中学希望部2021-2022学年高三上学期第一次月考化学试题
4 . 为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是
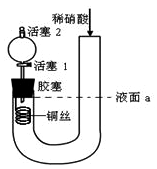

| A.关闭活塞1,加入稀硝酸至液面a处 |
| B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率 |
| C.通过关闭或开启活塞1可以控制反应的进行 |
| D.反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO |
您最近一年使用:0次
2016-12-09更新
|
1681次组卷
|
19卷引用:课中-5.2.3 硝酸 酸雨及防治-人教2019必修第二册
课中-5.2.3 硝酸 酸雨及防治-人教2019必修第二册(已下线)2011届北京市丰台区高三下学期统一练习(一)(理综)化学部分2014-2015福建省福州市八县高一下学期联考化学试卷2015-2016学年黑龙江省实验中学高二下期末化学试卷上海市格致中学2016-2017学年高一下学期期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【押题专练】内蒙古赤峰二中2017-2018学年高一上学期期末考试化学试题(已下线)2018年12月12日 《每日一题》人教必修1-硝酸的强氧化性上海市嘉定区2016届高三第一次质量调研化学试题四川省成都龙泉第二中学2021届高三上学期九月月考化学试题浙江省浙北G2(嘉兴一中、湖州中学)2020-2021学年高二上学期期中联考化学试题辽宁省六校2021届高三上学期期中联考化学试题广东省佛山市顺德李兆基中学2020-2021学年高一3月月考化学试卷江苏省苏州市相城区黄埭中学2020-2021学年高一下学期3月月考化学试题黑龙江省哈尔滨市第六中学2020-2021学年高一4月月考化学试题湖北省部分重点高中2020-2021学年高一下学期4月联考化学试题吉林省延边第二中学2020届高三上学期第一次调研化学试题江苏省盐城市东台创新高级中学2021-2022学年高一5月份月检测化学试题(已下线)3.2.2 铵盐和硝酸-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)
22-23高一·全国·课时练习
5 . 某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
(1)①甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如图所示实验。

X溶液是_______ ,滴入的量一般为_______ 。
②乙同学认为甲同学的实验不能充分证明氢氧化钠溶液与稀盐酸能够发生反应,乙同学的理由是_______ 。
(2)丙同学利用“保温瓶式量热计”(图略),测出10 mL 10%氢氧化钠溶液和不同体积的10%盐酸混合过程中,溶液的温度变化见下表(假设两溶液密度相同)。
就此实验回答下列问题:
①盐酸和氢氧化钠的反应是_______ (填“吸热”或“放热”)反应。
②请在下图中绘制出溶液的温度变化与加入盐酸体积之间的变化关系图_______ 。

(1)①甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如图所示实验。

X溶液是
②乙同学认为甲同学的实验不能充分证明氢氧化钠溶液与稀盐酸能够发生反应,乙同学的理由是
(2)丙同学利用“保温瓶式量热计”(图略),测出10 mL 10%氢氧化钠溶液和不同体积的10%盐酸混合过程中,溶液的温度变化见下表(假设两溶液密度相同)。
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 溶液温度变化(Δt)/℃ | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 |
①盐酸和氢氧化钠的反应是
②请在下图中绘制出溶液的温度变化与加入盐酸体积之间的变化关系图

您最近一年使用:0次
6 . 为了比较铁、铜的还原性强弱,两位同学分别设计了如下方案:
甲方案:分别将铁片和铜片插入稀硝酸中,有气体产生的是铁,无气体产生的是铜。
乙方案:用惰性电极电解浓度均为 的
的 和
和 的混合溶液,首先在阴极上析出的是铜。
的混合溶液,首先在阴极上析出的是铜。
(1)请对两位同学的方案作出评价________ 。
(2)请设计另外两种方案,证明铁的还原性强于铜________ 。
甲方案:分别将铁片和铜片插入稀硝酸中,有气体产生的是铁,无气体产生的是铜。
乙方案:用惰性电极电解浓度均为
 的
的 和
和 的混合溶液,首先在阴极上析出的是铜。
的混合溶液,首先在阴极上析出的是铜。(1)请对两位同学的方案作出评价
(2)请设计另外两种方案,证明铁的还原性强于铜
您最近一年使用:0次
名校
7 . 为探究乙烯与溴的加成反应,甲同学设计并进行如下实验:先用乙醇和浓硫酸为原料制取乙烯( ),将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴发生了加成反应;乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再通入溴水中反应。请回答下列问题:
),将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴发生了加成反应;乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再通入溴水中反应。请回答下列问题:
(1)甲同学设计的实验(填“能”或“不能”)验证乙烯与溴发生了加成反应,其理由是_______。
(2)乙同学推测制得的乙烯中可能含有的一种杂质气体是SO2,它与溴水反应的化学方程式是。假设已验证该杂质存在,必须除去该杂质,因此,乙同学设计了如图所示的实验装置:
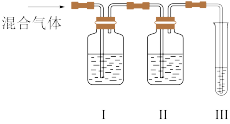
I、II、III装置中可盛放的试剂:_______ (按顺序填序号)。
A.品红溶液 B. 溶液 C.溴水 D.酸性高锰酸钾溶液
溶液 C.溴水 D.酸性高锰酸钾溶液
(3)为验证乙烯与溴发生的这一反应是加成反应而不是取代反应,丙同学提出可用 试纸测反应后溶液的酸碱性,理由是
试纸测反应后溶液的酸碱性,理由是_______ ,还可以选择什么试剂_______ 。
 ),将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴发生了加成反应;乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再通入溴水中反应。请回答下列问题:
),将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴发生了加成反应;乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再通入溴水中反应。请回答下列问题:(1)甲同学设计的实验(填“能”或“不能”)验证乙烯与溴发生了加成反应,其理由是_______。
| A.使溴水褪色的反应,未必是加成反应 |
| B.使溴水褪色的反应,就是加成反应 |
| C.使溴水褪色的物质,未必是乙烯 |
| D.使溴水褪色的物质,就是乙烯 |

I、II、III装置中可盛放的试剂:
A.品红溶液 B.
 溶液 C.溴水 D.酸性高锰酸钾溶液
溶液 C.溴水 D.酸性高锰酸钾溶液(3)为验证乙烯与溴发生的这一反应是加成反应而不是取代反应,丙同学提出可用
 试纸测反应后溶液的酸碱性,理由是
试纸测反应后溶液的酸碱性,理由是
您最近一年使用:0次
解题方法
8 . 含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取 的化学方程式为
的化学方程式为_______ 。
(2)实验室制取干燥 时,净化与收集
时,净化与收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为_______ 。

(3)某氯水久置后不能使品红溶液褪色,可推测氯水中_______ 已分解。检验此久置氯水中 存在的操作及现象是
存在的操作及现象是_______ 。
(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。
③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度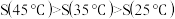
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
⑤数据分析、交流讨论
实验结果为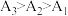 。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有
。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有_______ 。
⑥优化实验 小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5,请完成表2中内容。
表2
⑦实验总结 根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是_______ 。
 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。(1)实验室沿用舍勒的方法制取
 的化学方程式为
的化学方程式为(2)实验室制取干燥
 时,净化与收集
时,净化与收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中
 存在的操作及现象是
存在的操作及现象是(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。
③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
| 实验序号 | 试样 | 测试温度/℃ | 电导率/( ) ) |
| 1 | Ⅰ:25℃的AgCl饱和溶液 | 25 | A1 |
| 2 | Ⅱ:35℃的AgCl饱和溶液 | 35 | A2 |
| 3 | Ⅲ:45℃的AgCl饱和溶液 | 45 | A3 |
实验结果为
 。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有
。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有⑥优化实验 小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5,请完成表2中内容。
表2
| 实验序号 | 试样 | 测试温度/℃ | 电导率/( ) ) |
| 4 | Ⅰ | B1 | |
| 5 | B2 |
您最近一年使用:0次
2022-08-17更新
|
404次组卷
|
2卷引用:第二章 海水中的重要元素——钠和氯 ★综合拔高练
9 . 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表所示:
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理:___________ (填“合理”或“不合理”)。
(2)将铝与Fe2O3混合后放入漏斗中,然后引发铝热反应的实验操作是___________ 。
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是___________ ,反应的离子方程式为___________ 。
(4)实验室溶解该熔融物,下列试剂中最好的是___________(填序号)。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理:
(2)将铝与Fe2O3混合后放入漏斗中,然后引发铝热反应的实验操作是
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(4)实验室溶解该熔融物,下列试剂中最好的是___________(填序号)。
| A.浓硫酸 |
| B.稀硫酸 |
| C.稀硝酸 |
| D.氢氧化钠溶液 |
您最近一年使用:0次
解题方法
10 . 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。某同学选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
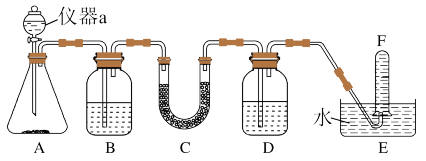
(1)A是制取 的装置,其装置中仪器a的名称是
的装置,其装置中仪器a的名称是_______ 。
(2)B中的试剂是_____ 溶液,发生反应的离子方程式是________ 。
(3)C中 与
与 反应的化学方程式为
反应的化学方程式为________ 。
(4)D中的试剂是 溶液,其作用是
溶液,其作用是________ 。
(5)试管F中收集满气体后,下一步实验操作是_________ ,说明过氧化钠可作供氧剂。

(1)A是制取
 的装置,其装置中仪器a的名称是
的装置,其装置中仪器a的名称是(2)B中的试剂是
(3)C中
 与
与 反应的化学方程式为
反应的化学方程式为(4)D中的试剂是
 溶液,其作用是
溶液,其作用是(5)试管F中收集满气体后,下一步实验操作是
您最近一年使用:0次



