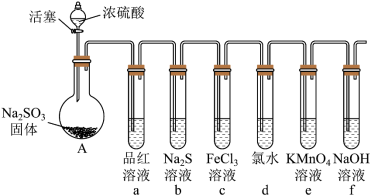
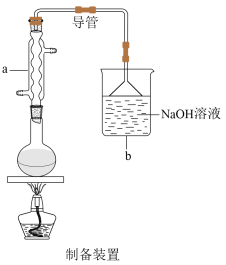
1 . 某化学兴趣小组欲用下图所示装置制备 SO2并探究其某些性质。___________________ ,该反应中,浓硫酸体现氧化性和酸性的物质的量之比为______________ 。
(2)为验证二氧化硫的漂白性,试管a中的现象是___________________ 。
(3)反应一段时间后,试管b 中溶液出现淡黄色沉淀,该现象说明二氧化硫具有___________ 性。
(4)为了验证试管c中 SO2与 Fe3+发生了氧化还原反应,在如图装置中通入过量 的 SO2后,取试管 c 中的溶液分成三份,并设计了如下实验:
方案I:向第一份溶液中加入酸性 KMnO4溶液,紫色褪去;
方案Ⅱ:向第二份溶液中加入 KSCN 溶液不变红,再加入新制的氯水,溶液变红;
方案Ⅲ:向第三份溶液中加入用盐酸酸化的 BaCl2溶液,产生白色沉淀。
指出上述不合理的方案并说明原因:_______________ 。
(5)为验证二氧化硫的还原性,反应一段时间后,将试管d中的溶液分成三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入 BaCl2溶液,产生白色沉淀。
上述方案合理的是___________ (填“I”“Ⅱ”或“Ⅲ”)。试管d中发生反应生成__________ 、___________ 。
(6)试管e中发生反应的离子方程式为_______________ 。试管f中装 NaOH 溶液的目的是_________________ 。
(2)为验证二氧化硫的漂白性,试管a中的现象是
(3)反应一段时间后,试管b 中溶液出现淡黄色沉淀,该现象说明二氧化硫具有
(4)为了验证试管c中 SO2与 Fe3+发生了氧化还原反应,在如图装置中通入
方案I:向第一份溶液中加入酸性 KMnO4溶液,紫色褪去;
方案Ⅱ:向第二份溶液中加入 KSCN 溶液不变红,再加入新制的氯水,溶液变红;
方案Ⅲ:向第三份溶液中加入用盐酸酸化的 BaCl2溶液,产生白色沉淀。
指出上述不合理的方案并说明原因:
(5)为验证二氧化硫的还原性,反应一段时间后,将试管d中的溶液分成三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入 BaCl2溶液,产生白色沉淀。
上述方案合理的是
(6)试管e中发生反应的离子方程式为
您最近一年使用:0次
解题方法
2 . 某化学学习小组进行如下实验:
I.为探究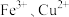 对
对 分解的催化效果,实验方案如下图所示:
分解的催化效果,实验方案如下图所示:___________ (填实验现象),即可得出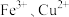 的催化效果的差异。有同学建议将
的催化效果的差异。有同学建议将 改为
改为 溶液,理由是
溶液,理由是___________ 。
II.测定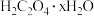 中
中 值
值
已知: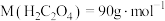 ,①称取
,①称取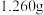 纯草酸晶体,将草酸制成
纯草酸晶体,将草酸制成 水溶液为待测液;②取
水溶液为待测液;②取 待测液放入锥形瓶中,再加入适量的稀
待测液放入锥形瓶中,再加入适量的稀 ;③用浓度为
;③用浓度为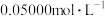 的
的 标准溶液进行滴定。
标准溶液进行滴定。
(2)请写出滴定中发生反应的离子方程式___________ 。
(3)由图可知消耗 溶液体积为
溶液体积为___________  。
。___________ 。
(5)通过上述数据,求得
___________ ,若由于操作不当,滴定结束后滴定管尖嘴处滴定前滴定后有一气泡,引起实验结果___________ (偏大、偏小或没有影响),其它操作均正确,滴定前未用标准 溶液润洗滴定管,引起实验结果
溶液润洗滴定管,引起实验结果___________ (偏大、偏小或没有影响)。
I.为探究
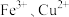 对
对 分解的催化效果,实验方案如下图所示:
分解的催化效果,实验方案如下图所示: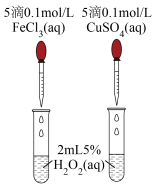
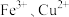 的催化效果的差异。有同学建议将
的催化效果的差异。有同学建议将 改为
改为 溶液,理由是
溶液,理由是II.测定
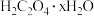 中
中 值
值已知:
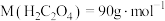 ,①称取
,①称取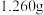 纯草酸晶体,将草酸制成
纯草酸晶体,将草酸制成 水溶液为待测液;②取
水溶液为待测液;②取 待测液放入锥形瓶中,再加入适量的稀
待测液放入锥形瓶中,再加入适量的稀 ;③用浓度为
;③用浓度为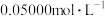 的
的 标准溶液进行滴定。
标准溶液进行滴定。(2)请写出滴定中发生反应的离子方程式
(3)由图可知消耗
 溶液体积为
溶液体积为 。
。
(5)通过上述数据,求得

 溶液润洗滴定管,引起实验结果
溶液润洗滴定管,引起实验结果
您最近一年使用:0次
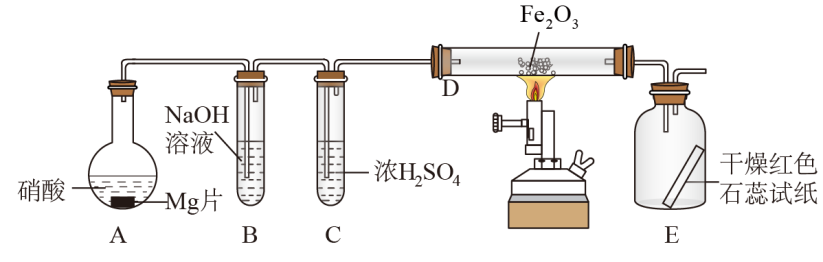
3 . 硝酸与金属反应时,浓度不同生成的还原产物也可能不同,某兴趣小组进行了如下图所示的实验探究,实验现象及相关数据如下:
②从C进入D中的气体有两种,且体积比为1∶1;
③将D加热一段时间后,E中干燥的红色石蕊试纸逐渐变蓝。(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O,且水蒸气的体积忽略不计,实验中的液体药品均过量。请回答:
(1)装置中仪器A的名称___________ ;硝酸与Mg片反应生成的气体成分是___________ (用化学式表示)。
(2)硝酸在装置A的反应中所表现的性质有___________ 。
(3)利用所提供的试剂(NaNO2溶液、KMnO4溶液、KI溶液、稀硫酸、淀粉溶液)设计实验,证明B中生成的这种盐在酸性条件下具有氧化性___________ 。
(4)写出D中发生反应的化学方程式___________ 。
(5)若向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,其体积为硝酸与Mg片反应生成的气体体积的 (同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式
(同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式___________ 。
②从C进入D中的气体有两种,且体积比为1∶1;
③将D加热一段时间后,E中干燥的红色石蕊试纸逐渐变蓝。(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O,且水蒸气的体积忽略不计,实验中的液体药品均过量。请回答:
(1)装置中仪器A的名称
(2)硝酸在装置A的反应中所表现的性质有
(3)利用所提供的试剂(NaNO2溶液、KMnO4溶液、KI溶液、稀硫酸、淀粉溶液)设计实验,证明B中生成的这种盐在酸性条件下具有氧化性
(4)写出D中发生反应的化学方程式
(5)若向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,其体积为硝酸与Mg片反应生成的气体体积的
 (同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式
(同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式
您最近一年使用:0次
名校
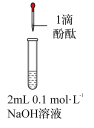
4 . 某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。
A.乙酸 B.苯酚 C.碳酸 D.乙醇
(1)甲同学设计并实施了如下实验方案。
(2)乙同学对甲同学的实验提出如下改进方案,能一次比较 、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如图所示。
、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如图所示。_____ (填接口字母)。
②丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有_____ 的洗气装置,使乙同学的实验设计更加完善。
A.乙酸 B.苯酚 C.碳酸 D.乙醇
(1)甲同学设计并实施了如下实验方案。
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
| 1 | 分别取4种溶液,滴加紫色石蕊溶液 | ①溶液变红的是溶液 | 略 |
| 2 | 将 通入 通入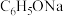 溶液中 溶液中 | ②现象: | ③方程式: |
| 3 | 配制等物质的量浓度的 、 、 溶液,并比较其pH 溶液,并比较其pH |  溶液的pH大于 溶液的pH大于 溶液 溶液 | 略 |
| 4 | 向含酚酞的 溶液中,各滴加等量的BD两种溶液 溶液中,各滴加等量的BD两种溶液 | D中无明显现象; B中红色明显变浅 | ④滴加B时方程式: |
| ⑤结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是 | |||
 、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如图所示。
、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如图所示。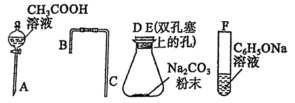
②丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有
您最近一年使用:0次
名校
解题方法
5 . 1-溴丁烷可用于合成麻醉药盐酸丁卡因,也用于生产染料和香料,是稀有元素萃取的溶剂及有机合成的中间体,其制备如图(夹持装置略): (浓)
(浓)
ⅱ.
ⅲ. (浓)
(浓)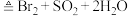
请回答下列问题:
(1)在反应时,若选用较浓的硫酸作为反应物,得到的产品会呈黄色,为除去颜色,最好选择下列的_______ (填标号)溶液来洗涤产品。
A.四氯化碳 B.硫酸钠 C.氢氧化钠 D.亚硫酸钠
产品选择上述溶液洗涤后,还需要用蒸馏水洗涤一次,洗涤液与产品分离的操作是_______ (填操作名称)。
(2)分离得到的有机层依次用适量的水、饱和 溶液、水洗涤、用无水
溶液、水洗涤、用无水 干燥,蒸馏,得到最终产品。若投入正丁醇
干燥,蒸馏,得到最终产品。若投入正丁醇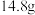 ,得到产物
,得到产物 ,则1-溴丁烷的产率为
,则1-溴丁烷的产率为______ %(保留一位小数)。
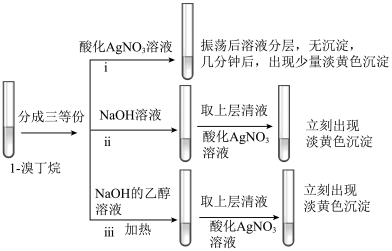
(3)探究小组为研究1-溴丁烷的水解反应和消去反应,设计如下探究实验:_______ 。
②实验ⅲ的有机化学反应方程式是_______ 。
③为深入研究1-溴丁烷与 溶液是否能发生消去反应,小组设计如图装置探究(加热和夹持装置略去):
溶液是否能发生消去反应,小组设计如图装置探究(加热和夹持装置略去):
Ⅰ.甲同学认为不能依据酸性高锰酸钾溶液褪色,判断A中发生消去反应,理由是_______ 。
Ⅱ.乙同学对实验进行了改进,依据实验现象可判断是否发生消去反应,改进的方案是_______ 。
 (浓)
(浓)
ⅱ.

ⅲ.
 (浓)
(浓)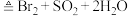
请回答下列问题:
(1)在反应时,若选用较浓的硫酸作为反应物,得到的产品会呈黄色,为除去颜色,最好选择下列的
A.四氯化碳 B.硫酸钠 C.氢氧化钠 D.亚硫酸钠
产品选择上述溶液洗涤后,还需要用蒸馏水洗涤一次,洗涤液与产品分离的操作是
(2)分离得到的有机层依次用适量的水、饱和
 溶液、水洗涤、用无水
溶液、水洗涤、用无水 干燥,蒸馏,得到最终产品。若投入正丁醇
干燥,蒸馏,得到最终产品。若投入正丁醇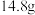 ,得到产物
,得到产物 ,则1-溴丁烷的产率为
,则1-溴丁烷的产率为(3)探究小组为研究1-溴丁烷的水解反应和消去反应,设计如下探究实验:
②实验ⅲ的有机化学反应方程式是
③为深入研究1-溴丁烷与
 溶液是否能发生消去反应,小组设计如图装置探究(加热和夹持装置略去):
溶液是否能发生消去反应,小组设计如图装置探究(加热和夹持装置略去):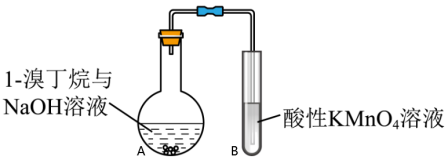
Ⅰ.甲同学认为不能依据酸性高锰酸钾溶液褪色,判断A中发生消去反应,理由是
Ⅱ.乙同学对实验进行了改进,依据实验现象可判断是否发生消去反应,改进的方案是
您最近一年使用:0次
2024-05-04更新
|
563次组卷
|
3卷引用:山东省青岛第五十八中学2023-2024学年高二下学期4月月考化学试卷
6 . 某化学兴趣小组同学利用如图所示装置(夹持与加热装置已略去)来进行乙醇的脱水反应实验,下列说法错误的是

A. 在该反应中起催化剂作用 在该反应中起催化剂作用 |
| B.若将盛装水的试剂瓶撤去后进行实验,实验过程中观察到试管中的酸性高锰酸钾溶液褪色,一定是生成的乙烯使其褪色 |
C.实验过程中,可能发生的反应有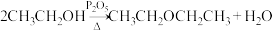 |
| D.该实验过程中所生成的乙烯,其所有原子一定位于同一平面上 |
您最近一年使用:0次
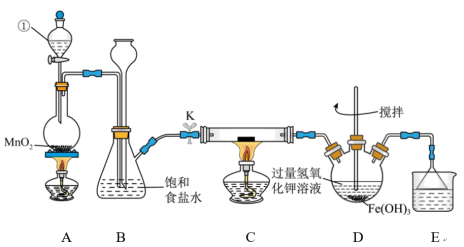
7 . 氯气是一种重要的化工原料,可用于生产塑料、合成纤维和染料等。实验室某实验小组现用下图装置来制取氯气并对氯气的某些性质和用途进行探究(K为开关,夹持装置已省略)。请回答下列问题:__________ 。
(2)检验装置A、B的气密性:将仪器①的活塞和开关K关闭,从长颈漏斗处加水至液面高于锥形瓶中的液面,若________ ,则说明装置气密性良好。
(3)装置A中发生反应的化学方程式为__________ 。
(4)装置E中的试剂是___________ ,作用是___________ 。
(5)装置C中为湿润的KI-淀粉试纸,通入 后试纸变蓝,则该反应的离子方程式为
后试纸变蓝,则该反应的离子方程式为_________ ;该小组为了研究干燥的氯气与金属钠之间的反应,欲在装置C中直接放置一块纯净的金属钠进行实验,该方案存在不妥之处,请你指出不妥之处并改正:__________ 。
(2)检验装置A、B的气密性:将仪器①的活塞和开关K关闭,从长颈漏斗处加水至液面高于锥形瓶中的液面,若
(3)装置A中发生反应的化学方程式为
(4)装置E中的试剂是
(5)装置C中为湿润的KI-淀粉试纸,通入
 后试纸变蓝,则该反应的离子方程式为
后试纸变蓝,则该反应的离子方程式为
您最近一年使用:0次
2024-03-19更新
|
56次组卷
|
2卷引用:广东省汕头市潮阳区河溪中学2023-2024学年高二上学期月考化学试题
8 . 磺酰氯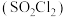 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量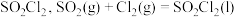 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知 的熔点为
的熔点为 ,沸点为
,沸点为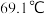 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。
回答下列问题。 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。
(2)导管a的作用是___________ ;仪器b中的试剂是___________ 。
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是___________ 。
(4) 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为___________ 。
(5)若反应中消耗的氯气体积为 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为___________ (产率:实际产量/理论产量 )。
)。
(6)已知酸性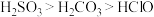 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为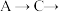
___________  ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为___________ 。
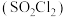 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量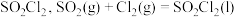 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知 的熔点为
的熔点为 ,沸点为
,沸点为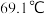 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。回答下列问题。

 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。A. 的硫酸和 的硫酸和 | B. 的硝酸和 的硝酸和 固体 固体 |
C.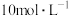 的硫酸和 的硫酸和 固体 固体 | D. 的硫酸和 的硫酸和 固体 固体 |
(2)导管a的作用是
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是
(4)
 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为(5)若反应中消耗的氯气体积为
 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为 )。
)。(6)已知酸性
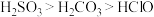 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为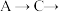
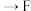 ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为
您最近一年使用:0次
2024-02-23更新
|
161次组卷
|
2卷引用:广东省惠州市第一中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
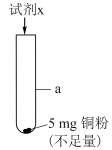
9 . 某小组探究Cu与 的反应,进行如下实验。
的反应,进行如下实验。
已知: (无色)
(无色) (白色)
(白色)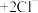
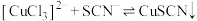 (白色)
(白色)
(1)Ⅰ、Ⅱ中,反应后的溶液均变为蓝色,推测有 生成。分别取少量反应后的溶液,滴加
生成。分别取少量反应后的溶液,滴加 溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是
溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是_______ 。
(2) 内,Cu被氧化的反应速率:Ⅰ
内,Cu被氧化的反应速率:Ⅰ_______ Ⅱ(填“>”“<”或“=”)。
(3)研究Ⅱ的反应过程,设计如下装置进行实验。不同时间取左侧烧杯中的溶液,滴加 溶液,取样时间与实验现象如下(不考虑
溶液,取样时间与实验现象如下(不考虑 的作用)。
的作用)。
经检验,白色沉淀为 。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加
。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加 溶液,溶液红色依次变浅。
溶液,溶液红色依次变浅。
① 溶液的浓度是
溶液的浓度是_______  。
。
②根据ⅰ、ⅱ中“产生白色沉淀”“溶液红色变浅”,推测Cu转化为 ,Cu与
,Cu与 溶液反应的离子方程式是
溶液反应的离子方程式是_______ 。
③由ⅲ、ⅳ可知, 后主要反应的离子方程式是
后主要反应的离子方程式是_______ 。
(4)对比Ⅰ和Ⅱ,结合ⅰ~ⅳ, 在Cu与
在Cu与 反应中的作用是
反应中的作用是_______ 。
(5)研究 的浓度对铜粉溶解的影响,进行如下实验。
的浓度对铜粉溶解的影响,进行如下实验。
a中加入的试剂x为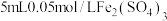 和
和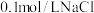 的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是
的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是 。则铜粉未完全溶解的原因是
。则铜粉未完全溶解的原因是_______ 。
 的反应,进行如下实验。
的反应,进行如下实验。已知:
 (无色)
(无色) (白色)
(白色)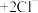
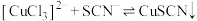 (白色)
(白色)
| 序号 | 试剂x | 实验现象 |
| Ⅰ | 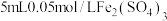 溶液 溶液 | 溶液变为浅蓝色, 时,铜粉有较多剩余 时,铜粉有较多剩余 | |
| Ⅱ | 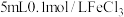 溶液 溶液 | 溶液变为蓝色, 时,铜粉完全溶解 时,铜粉完全溶解 |
(1)Ⅰ、Ⅱ中,反应后的溶液均变为蓝色,推测有
 生成。分别取少量反应后的溶液,滴加
生成。分别取少量反应后的溶液,滴加 溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是
溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是(2)
 内,Cu被氧化的反应速率:Ⅰ
内,Cu被氧化的反应速率:Ⅰ(3)研究Ⅱ的反应过程,设计如下装置进行实验。不同时间取左侧烧杯中的溶液,滴加
 溶液,取样时间与实验现象如下(不考虑
溶液,取样时间与实验现象如下(不考虑 的作用)。
的作用)。
| 序号 | 取样时间/min | 现象 |
| ⅰ | 1 | 产生白色沉淀 | |
| ⅱ | 10 | 产生白色沉淀,较 时量多 时量多 | |
| ⅲ | 30 | 产生白色沉淀,较 时量少 时量少 | |
| ⅳ | 40 | 无白色沉淀产生 |
 。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加
。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加 溶液,溶液红色依次变浅。
溶液,溶液红色依次变浅。①
 溶液的浓度是
溶液的浓度是 。
。②根据ⅰ、ⅱ中“产生白色沉淀”“溶液红色变浅”,推测Cu转化为
 ,Cu与
,Cu与 溶液反应的离子方程式是
溶液反应的离子方程式是③由ⅲ、ⅳ可知,
 后主要反应的离子方程式是
后主要反应的离子方程式是(4)对比Ⅰ和Ⅱ,结合ⅰ~ⅳ,
 在Cu与
在Cu与 反应中的作用是
反应中的作用是(5)研究
 的浓度对铜粉溶解的影响,进行如下实验。
的浓度对铜粉溶解的影响,进行如下实验。a中加入的试剂x为
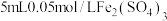 和
和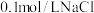 的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是
的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是 。则铜粉未完全溶解的原因是
。则铜粉未完全溶解的原因是
您最近一年使用:0次
2024-01-20更新
|
152次组卷
|
2卷引用:北京市第一七一中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
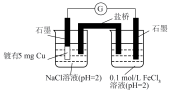
10 . 研究小组探究 与水反应。取
与水反应。取 粉末加入到
粉末加入到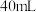 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
下列说法不正确的是
 与水反应。取
与水反应。取 粉末加入到
粉末加入到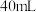 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。编号 | ① | ② | ③ | ④ |
操作 |
|
|
|
|
现象 | 溶液变红色,20秒后褪色 | ⅰ.产生大量能使带火星木条复燃的气体 ⅱ.溶液变红色,10分钟后褪色 | ⅰ.溶液变红色,10分钟后溶液褪色 ⅱ.变红色 | 溶液变红色,2小时后无明显变化 |
A.由②中现象ⅰ可知, 与水反应有 与水反应有 生成 生成 |
B.由③、④可知,②中溶液红色褪去是因为 大 大 |
C.由②、③、④可知,①中溶液红色褪去的主要原因不是 大 大 |
D.向①中褪色后的溶液中滴加5滴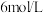 盐酸,溶液最终变成红色 盐酸,溶液最终变成红色 |
您最近一年使用:0次
2023-12-15更新
|
148次组卷
|
21卷引用:北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题
北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题安徽省示范高中培优联盟2020-2021学年高一上学期冬季联赛化学试题北京一零一中学2021-2022学年高三上学期 9月开学练习化学试题北京市首都师范大学附属中学2022-2023学年高一上学期12月月考化学试题福建省厦门外国语学校2023-2024学年高一上学期10月第一次月考化学试题河南省唐河县鸿唐高级中学2023-2024学年高三上学期9月月考化学试题山东省菏泽市郓城县第一中学2023-2024学年高一上学期9月月考化学试题北京市海淀区2021届高三上学期期中考试化学试题北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题北京交通大学附属中学2021-2022学年高一上学期期中考试化学试题四川省德阳市德阳五中2021-2022学年高一上学期期末考试化学试题(已下线)北京市第四中学2022-2023学年高一上学期期中考试化学试题北京师范大学附属实验中学2021-2022学年高一上学期1月期末测试化学试题北京市第八中学2022-2023学年高一下学期期末考试化学试题北京市清华大学附属中学2023-2024学年高三上学期开学考试化学(A)试题天津市第一中学2023-2024学年高一上学期11月期中化学试题北京市第二十中学2023-2024学年高一上学期期中考试化学试题北京市日坛中学2023-2024学年高一上学期期中考试化学试题北京师范大学燕化附属中学2023-2024学年高一上学期期中考试化学试卷北京市第一五九中学2023-2024学年高一上学期期中考试化学试题