名校
1 . 某研究小组探究酸碱性对 和
和 反应的影响。
反应的影响。
资料: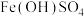 为黄色固体,难溶于水,可溶于酸。
为黄色固体,难溶于水,可溶于酸。
Ⅰ.无外加酸碱时,实验如下。
实验ⅰ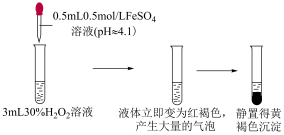
实验ⅱ
(1)根据_____ ,可证实实验ⅰ中红褐色液体为胶体。
(2)已知黄褐色沉淀中有 ,还可能存在
,还可能存在 ,设计实验证实
,设计实验证实_____ 。(填操作和现象)
(3)结合化学用语,解释无外加酸碱时反应结束后 降低的原因
降低的原因_____ 。
Ⅱ.外加酸碱条件下,实验如下。
(4)根据实验ⅲ,推测立即产生大量气体的原因。
猜想一: 催化
催化 分解。
分解。
猜想二:_____ 。
设计实验_____ ,证实猜想一不是立即产生大量气体的主要原因。
(5) 是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因
是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因_____ 。
主要反应机理:
注: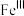 代表
代表 的化合价为+3
的化合价为+3
(6)已知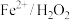 体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于
体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于 有强氧化性,根据以上实验探究,配制该体系最好控制在
有强氧化性,根据以上实验探究,配制该体系最好控制在_____ 条件下。
 和
和 反应的影响。
反应的影响。资料:
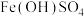 为黄色固体,难溶于水,可溶于酸。
为黄色固体,难溶于水,可溶于酸。Ⅰ.无外加酸碱时,实验如下。
实验ⅰ

实验ⅱ

(1)根据
(2)已知黄褐色沉淀中有
 ,还可能存在
,还可能存在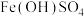 ,设计实验证实
,设计实验证实(3)结合化学用语,解释无外加酸碱时反应结束后
 降低的原因
降低的原因Ⅱ.外加酸碱条件下,实验如下。
| 实验编号 | 实验操作 | 现象 |
| ⅲ | 取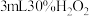 溶液于试管中,滴加 溶液于试管中,滴加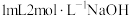 溶液,再滴加 溶液,再滴加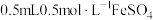 溶液 溶液 | 液体变为红褐色,立即产生大量气体,有液体喷出试管,最终产生大量红褐色沉淀 |
| ⅳ | 取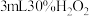 溶液于试管中,滴加 溶液于试管中,滴加 稀硫酸,再滴加 稀硫酸,再滴加 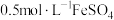 溶液 溶液 | 溶液呈黄色,有少量气泡产生,静置无沉淀产生 |
(4)根据实验ⅲ,推测立即产生大量气体的原因。
猜想一:
 催化
催化 分解。
分解。猜想二:
设计实验
(5)
 是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因
是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因主要反应机理:
①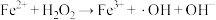 | ② ( ( 的水解) 的水解) |
③ | ④ |
⑤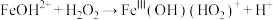 | ⑥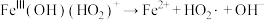 |
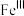 代表
代表 的化合价为+3
的化合价为+3(6)已知
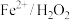 体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于
体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于 有强氧化性,根据以上实验探究,配制该体系最好控制在
有强氧化性,根据以上实验探究,配制该体系最好控制在
您最近一年使用:0次
2024-01-21更新
|
123次组卷
|
2卷引用:北京市丰台区2023-2024学年高二上学期期末考试化学试题
解题方法
2 . 某小组同学探究卤族元素性质递变规律,设计如下实验:
(1)实验①的离子方程式为_______ 。实验②的现象是_______ 。
(2)综合实验①②③,Cl2、Br2、I2单质的氧化性由强到弱的顺序是_______ (用化学式表示);从原子结构的角度解释上述递变规律。_______
(3)实验中加入CCl4萃取的目的是_______ ;CCl4可以作为萃取剂的原因是_______ 。
| 序号 | 过程 | 现象 | 结论 |
| ① | 向NaBr溶液中加入少量氯水,再加入CCl4,振荡后静置 | 液体分层,下层呈红棕色 | 氧化性:Cl2>Br2 |
| ② | 向KI溶液中加入少量氯水,再加入CCl4,振荡后静置 | 氧化性:Cl2>I2 | |
| ③ | 向KI溶液中加入少量溴水,再加入CCl4,振荡后静置 |
(2)综合实验①②③,Cl2、Br2、I2单质的氧化性由强到弱的顺序是
(3)实验中加入CCl4萃取的目的是
您最近一年使用:0次
名校
解题方法
3 . Fe2+在空气中易被氧化。某小组探究绿矾(FeSO4•7H2O)和莫尔盐[(NH4)2Fe(SO4)2•6H2O]在空气中的稳定性。
Ⅰ.探究溶液中的稳定性:配制0.1mol·L-1两种溶液[A:FeSO4,B:(NH4)2Fe(SO4)2],露置于空气中一段时间,并检验其中的Fe3+,结果如表。
(1)常温时0.1mol·L-1(NH4)2SO4溶液pH=5.0,则B溶液中水解程度:Fe2+_____ NH (填“>”或“<”),因此新配制的A、B溶液pH几乎相同。
(填“>”或“<”),因此新配制的A、B溶液pH几乎相同。
(2)放置24h后溶液pH均减小,写出该过程中Fe2+被空气氧化的离子方程式:_____ 。
上述实验说明两种溶液中的Fe2+的稳定性差异不大。
Ⅱ.探究晶体的稳定性:将两种晶体分别在不同条件下放置数天,实验记录如表。
(3)上述实验说明,相同条件下两种晶体在空气中稳定性更强的是_____ (填名称)。
(4)甲同学推测绿矾在ii中的结果与i不同可能是容器中O2不足造成的。乙同学经过对比,分析该推测不成立,其理由是_____ 。
(5)该小组同学根据实验结果进而推测绿矾易被氧化与其失去结晶水有关。
①绿矾晶体失去结晶水的实验现象是_____ 。
②莫尔盐晶体中______ 离子的存在使结晶水不易失去;该离子与H2O分子之间可能存在的作用是_____ 。
(6)同学们经过对两种晶体结构的比较,分析莫尔盐在空气中更稳定,除了上述原因外,还可能的原因:莫尔盐晶体中离子间的空隙较小,_____ 。
Ⅰ.探究溶液中的稳定性:配制0.1mol·L-1两种溶液[A:FeSO4,B:(NH4)2Fe(SO4)2],露置于空气中一段时间,并检验其中的Fe3+,结果如表。
| 编号 | 新配制 | 1h后 | 24h后 | |||||
| pH | 性状 | 酸化后滴等量KSCN(aq) | pH | 性状 | 酸化后滴等量KSCN(aq) | pH | 性状 | |
| A | 3.9 | 无色溶液 | 几乎无色 | 3.4 | 黄色溶液 | 变红 | 3.3 | 红褐色沉淀 |
| B | 3.9 | 无色溶液 | 几乎无色 | 3.3 | 黄色溶液 | 变红 | 3.2 | 红褐色沉淀 |
 (填“>”或“<”),因此新配制的A、B溶液pH几乎相同。
(填“>”或“<”),因此新配制的A、B溶液pH几乎相同。(2)放置24h后溶液pH均减小,写出该过程中Fe2+被空气氧化的离子方程式:
上述实验说明两种溶液中的Fe2+的稳定性差异不大。
Ⅱ.探究晶体的稳定性:将两种晶体分别在不同条件下放置数天,实验记录如表。
| 编号 | i | ii | iii | iv | |
| 实验条件 | 露置 | 密闭容器 | 潮湿的密闭容器 | 盛有干燥剂的 密闭容器 | |
| 实验结果 | 绿矾 | 晶体逐渐变白,进而出现土黄色;Fe3+含量很多 | 无明显变化;Fe3+含量非常少 | 晶体结块,颜色不变;Fe3+含量非常少 | 晶体逐渐变白,最终出现淡黄色;Fe3+含量很多 |
| 莫尔盐 | 无明显变化;Fe3+含量非常少 | 无明显变化;Fe3+含量非常少 | 晶体略结块,颜色不变;Fe3+含量非常少 | 无明显变化;Fe3+含量很少 | |
(4)甲同学推测绿矾在ii中的结果与i不同可能是容器中O2不足造成的。乙同学经过对比,分析该推测不成立,其理由是
(5)该小组同学根据实验结果进而推测绿矾易被氧化与其失去结晶水有关。
①绿矾晶体失去结晶水的实验现象是
②莫尔盐晶体中
(6)同学们经过对两种晶体结构的比较,分析莫尔盐在空气中更稳定,除了上述原因外,还可能的原因:莫尔盐晶体中离子间的空隙较小,
您最近一年使用:0次
2024-01-14更新
|
157次组卷
|
3卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高二上学期1月期末化学试题
名校
4 . 某化学小组对卤代烷在不同条件下发生反应的情况进行实验探究。
[实验1]取一支试管,滴入15滴溴乙烷,加入1mL5%的NaOH溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有___________的试管中,再加入2滴AgNO3溶液。溶液出现浑浊。
[实验2]向圆底烧瓶中加入2.0gNaOH和15mL无水乙醇,搅拌,再加入5mL1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过盛有___________试管A后,再通入盛有酸性KMnO4溶液的B试管。紫红色逐渐褪去。
请回答:
(1)补全试剂:实验1中___________ ,实验2中___________ 。溴乙烷发生水解反应的化学方程式是___________ 。
(2)已知:溴乙烷的沸点:38.4℃,1-溴丁烷的沸点:101.6℃
①由微粒间作用解释溴乙烷和1-溴丁烷沸点差异的原因是___________ 。
②有同学用溴乙烷代替1-溴丁烷进行实验2,发现酸性KMnO4溶液不褪色。由已知沸点差异分析实验失败的可能原因:___________ 。
(3)对比实验1和实验2所用试剂,有利于卤代烃消去反应发生的外部条件,除了弱极性溶剂外,还需要相对较___________ (填“高”或“低”)的温度。
(4)实验2检验出反应产物有丁烯,仍不能说明该条件下没有发生取代反应。若进一步检验是否生成1-丁醇,可采用的如下方法是___________ (填序号)。
a.使反应混合物与金属钠反应
b.对产物进行质谱分析
c.对产物进行核磁共振氢谱分析
(5)研究表明,除了外部条件,卤代烷的自身结构特点也决定了反应的趋向。伯卤代烷(R-CH2-X)优先发生取代反应,叔卤代烷(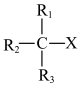 )优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:
)优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:___________ 。
[实验1]取一支试管,滴入15滴溴乙烷,加入1mL5%的NaOH溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有___________的试管中,再加入2滴AgNO3溶液。溶液出现浑浊。
[实验2]向圆底烧瓶中加入2.0gNaOH和15mL无水乙醇,搅拌,再加入5mL1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过盛有___________试管A后,再通入盛有酸性KMnO4溶液的B试管。紫红色逐渐褪去。
请回答:
(1)补全试剂:实验1中
(2)已知:溴乙烷的沸点:38.4℃,1-溴丁烷的沸点:101.6℃
①由微粒间作用解释溴乙烷和1-溴丁烷沸点差异的原因是
②有同学用溴乙烷代替1-溴丁烷进行实验2,发现酸性KMnO4溶液不褪色。由已知沸点差异分析实验失败的可能原因:
(3)对比实验1和实验2所用试剂,有利于卤代烃消去反应发生的外部条件,除了弱极性溶剂外,还需要相对较
(4)实验2检验出反应产物有丁烯,仍不能说明该条件下没有发生取代反应。若进一步检验是否生成1-丁醇,可采用的如下方法是
a.使反应混合物与金属钠反应
b.对产物进行质谱分析
c.对产物进行核磁共振氢谱分析
(5)研究表明,除了外部条件,卤代烷的自身结构特点也决定了反应的趋向。伯卤代烷(R-CH2-X)优先发生取代反应,叔卤代烷(
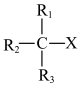 )优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:
)优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:
您最近一年使用:0次
5 . I.有机物种类繁多,性质多种多样。下列十种物质:①C2H5OH ②CH3CHO ③CH3COOH ④HOCH2CH2OH ⑤HOCH2(CHOH)4CHO⑥蛋白质 ⑦淀粉 ⑧油脂 ⑨酚醛树脂 ⑩塑料
⑩塑料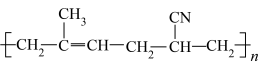
(1)①~③中,沸点最高的是
(2)①~④中能发生缩合聚合反应的是
(3)①~⑤中含有手性碳原子的是
(4)属于天然高分子的是
(5)⑨单体为
II.某同学为验证酸性:醋酸>碳酸>苯酚,经仔细考虑,设计如下实验装置,请回答下列问题:
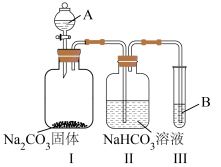
①醋酸溶液 ②CH3COONa溶液 ③苯酚溶液 ④苯酚钠溶液
(7)装置II中饱和NaHCO3溶液的作用
(8)能证明三种酸的酸性强弱的现象
(9)写出装置Ⅲ中发生反应的离子方程式
您最近一年使用:0次
解题方法
6 . 下列各组实验中,化学反应速率最快的是
| 选项 | 反应物 | 催化剂 | 温度 |
| A | 5 mL 10%  溶液 溶液 | 无 | 20℃ |
| B | 5 mL 10%  溶液 溶液 | 无 | 30℃ |
| C | 5 mL 10%  溶液 溶液 |  粉末 粉末 | 20℃ |
| D | 5 mL 10%  溶液 溶液 |  粉末 粉末 | 30℃ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-02更新
|
177次组卷
|
2卷引用:新疆乌鲁木齐市六校联考2023-2024学年高二上学期期末考试化学试题
名校
解题方法
7 . 回答下列问题:
Ⅰ.某小组研究 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。
资料:单质硫可溶于过量硫化钠溶液形成淡黄色的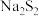 溶液。
溶液。
(1)根据实验可知, 具有
具有___________ 性。
(2)甲同学预测实验Ⅰ中 被氧化成
被氧化成 。
。
①根据实验现象,乙同学认为甲的预测不合理,理由是___________ 。
②乙同学取实验Ⅰ中少量溶液进行实验,检测到有 ,得出
,得出 被氧化成
被氧化成 的结论,丙同学否定了该结论,理由是
的结论,丙同学否定了该结论,理由是___________ 。
③同学们经讨论后,设计了如下实验,证实该条件下 的确可以将
的确可以将 氧化成
氧化成 。
。
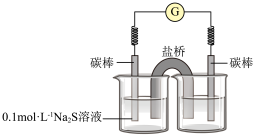
右侧烧杯中的溶液是___________ ;连通后电流计指针偏转,一段时间后,取左侧烧杯中的溶液,用盐酸酸化后,滴加 溶液,观察到有白色沉淀生成,证明
溶液,观察到有白色沉淀生成,证明 氧化成了
氧化成了 。
。
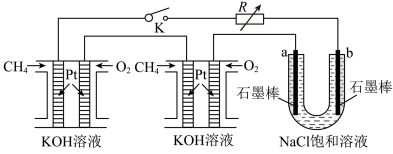
Ⅱ.甲烷和甲醇的燃料电池具有广阔的开发和应用前景。
(3)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:

通入a物质的电极是原电池的___________ (填“正”或“负”)极,其电极反应式为___________ 。
(4)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验:如图所示U形管中氯化钠溶液的体积为800mL。闭合K后,若每个电池中甲烷通入量为0.224L(标准状况),且反应完全,则理论上通过电解池的电量为___________ (法拉第常数 ),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为
),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为___________ (假设反应后溶液体积不变)。
Ⅰ.某小组研究
 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。| 实验序号 | Ⅰ | Ⅱ |
| 实验过程 | 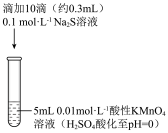 |  |
| 实验 现象 | 紫色变浅(pH>1),生成棕褐色沉淀( ) ) | 溶液呈淡黄色(pH≈8),生成浅粉色沉淀( ) ) |
 溶液。
溶液。(1)根据实验可知,
 具有
具有(2)甲同学预测实验Ⅰ中
 被氧化成
被氧化成 。
。①根据实验现象,乙同学认为甲的预测不合理,理由是
②乙同学取实验Ⅰ中少量溶液进行实验,检测到有
 ,得出
,得出 被氧化成
被氧化成 的结论,丙同学否定了该结论,理由是
的结论,丙同学否定了该结论,理由是③同学们经讨论后,设计了如下实验,证实该条件下
 的确可以将
的确可以将 氧化成
氧化成 。
。
右侧烧杯中的溶液是
 溶液,观察到有白色沉淀生成,证明
溶液,观察到有白色沉淀生成,证明 氧化成了
氧化成了 。
。Ⅱ.甲烷和甲醇的燃料电池具有广阔的开发和应用前景。
(3)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:

通入a物质的电极是原电池的
(4)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验:如图所示U形管中氯化钠溶液的体积为800mL。闭合K后,若每个电池中甲烷通入量为0.224L(标准状况),且反应完全,则理论上通过电解池的电量为
 ),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为
),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为
您最近一年使用:0次
8 . 探究甲醛与新制Cu(OH)2的反应:①向6mL6mol/LNaOH溶液中滴加8滴2%CuSO4溶液,振荡,加入0.5mL15%甲醛溶液,混合均匀,水浴加热,迅速产生红色沉淀,产生无色气体;②反应停止后分离出沉淀,将所得沉淀洗净后加入浓盐酸,不溶解;③相同条件下,甲酸钠溶液与新制Cu(OH)2共热,未观察到明显现象:已知: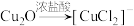 ,甲醛是具有强还原性的气体,下列说法正确的是
,甲醛是具有强还原性的气体,下列说法正确的是
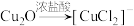 ,甲醛是具有强还原性的气体,下列说法正确的是
,甲醛是具有强还原性的气体,下列说法正确的是| A.红色沉淀的主要成分不是Cu2O,可能是Cu |
| B.将产生的无色气体通过灼热的CuO后得到红色固体,气体中一定含有CO |
C.从甲醛的结构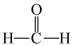 推测,其氧化产物可能为碳酸( 推测,其氧化产物可能为碳酸(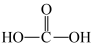 ) ) |
| D.实验中会得到大量含有CO2的无色气体 |
您最近一年使用:0次
名校
9 . 向乙醛溶液中加入含 的物质的量为1
的物质的量为1 的溴水,观察到溴水褪色。对产生该现象的原因有如下3种猜想:①溴水与乙醛发生取代反应;②由于乙醛具有还原性,溴水将乙醛氧化为乙酸;③由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应。
的溴水,观察到溴水褪色。对产生该现象的原因有如下3种猜想:①溴水与乙醛发生取代反应;②由于乙醛具有还原性,溴水将乙醛氧化为乙酸;③由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应。
为探究哪一种猜想正确,某研究性学习小组设计了如下2种实验方案。
方案1:检验褪色后溶液的酸碱性。方案2:测定反应后溶液中的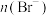 。
。
下列说法正确的是
 的物质的量为1
的物质的量为1 的溴水,观察到溴水褪色。对产生该现象的原因有如下3种猜想:①溴水与乙醛发生取代反应;②由于乙醛具有还原性,溴水将乙醛氧化为乙酸;③由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应。
的溴水,观察到溴水褪色。对产生该现象的原因有如下3种猜想:①溴水与乙醛发生取代反应;②由于乙醛具有还原性,溴水将乙醛氧化为乙酸;③由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应。为探究哪一种猜想正确,某研究性学习小组设计了如下2种实验方案。
方案1:检验褪色后溶液的酸碱性。方案2:测定反应后溶液中的
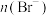 。
。下列说法正确的是
| A.若检验褪色后的溶液显酸性,说明溴水将乙醛氧化成乙酸 |
B.若测得反应后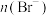 为0 为0 ,说明溴水与乙醛发生加成反应 ,说明溴水与乙醛发生加成反应 |
C.若测得反应后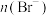 为2 为2 ,说明溴水与乙醛发生取代反应 ,说明溴水与乙醛发生取代反应 |
D.若溴水能将乙醛氧化为乙酸,反应的离子方程式为: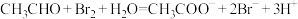 |
您最近一年使用:0次
2023-07-18更新
|
327次组卷
|
4卷引用:山西省名校联合测评2022-2023学年高二下学期7月期末化学试题
10 . 下列实验现象和解释都合理的是
| 选项 | 实验操作 | 现象 | 解释 |
| A | 将溴乙烷与 的乙醇溶液共热产生的气体通入溴的 的乙醇溶液共热产生的气体通入溴的 溶液中 溶液中 | 溴的 溶液褪色 溶液褪色 | 溴乙烷发生消去反应,生成乙烯 |
| B | 取大小相同的金属钠块与浓盐酸、与水反应进行对照实验 | 金属钠与浓盐酸反应比金属钠与水反应速率慢 | 浓盐酸中 较小 较小 |
| C | 将酚酞滴加到 浓溶液中 浓溶液中 | 试液先变红后褪色 | 高浓度的 具有超强的漂白性 具有超强的漂白性 |
| D | 热的苯酚水溶液自然冷却 | 变浑浊 | 温度降低析出苯酚晶体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



