2024高三下·全国·专题练习
解题方法
1 . 探究pH对 溶液的配制和保存的影响。
溶液的配制和保存的影响。
I. 溶液的配制
溶液的配制
将 分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
II. 溶液的保存
溶液的保存
将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
(1)①中的浑浊主要是FeOOH,用离子方程式表示其生成过程_______ 。
(2)该实验的初步结论:保存 溶液的最佳pH是
溶液的最佳pH是_______ 。
(3)进一步探究pH对 变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后:
变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后: 接近2mol/L,电流没有明显变化;
接近2mol/L,电流没有明显变化;
ii.向右池滴加等量浓硫酸,电流明显增大。
已知:电流增大表明化学反应速率加快,在该实验条件下与物质的氧化性(还原性)增强有关。
a.结合电极反应式分析ii中电流增大的原因_______ 。
b.依据实验i和ii推断:③比②中 更易变质的原因是
更易变质的原因是_______ 。
c.按上述原理进行实验,证实①中 更易变质的主要原因是
更易变质的主要原因是 的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,_______ 。
 溶液的配制和保存的影响。
溶液的配制和保存的影响。I.
 溶液的配制
溶液的配制将
 分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:| 编号 | 溶剂 | 溶液性状 | |
| ① | 蒸馏水 | 浅黄色澄清溶液 |  ;滴加1mol/LKSCN溶液无明显变化 ;滴加1mol/LKSCN溶液无明显变化 |
| ② |  | 无色澄清溶液 |  ;滴加1mol/LKSCN溶液微微变红 ;滴加1mol/LKSCN溶液微微变红 |
| ③ |  | 无色澄清溶液 | 滴加1mol/LKSCN溶液微微变红 |
 溶液的保存
溶液的保存将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
| 编号 | 溶液性状 | |
| ① | 橙色浑浊 | 用 酸化后,浊液变澄清,再滴加1mol/LKSCN溶液后变深红 酸化后,浊液变澄清,再滴加1mol/LKSCN溶液后变深红 |
| ② | 无色溶液 | 滴加1mol/L的KSCN溶液后显浅红色 |
| ③ | 无色溶液 | 滴加1mol/L的KSCN溶液后显红色,颜色比②略深 |
(2)该实验的初步结论:保存
 溶液的最佳pH是
溶液的最佳pH是(3)进一步探究pH对
 变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后:
变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后: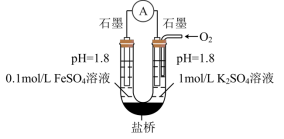
 接近2mol/L,电流没有明显变化;
接近2mol/L,电流没有明显变化;ii.向右池滴加等量浓硫酸,电流明显增大。
已知:电流增大表明化学反应速率加快,在该实验条件下与物质的氧化性(还原性)增强有关。
a.结合电极反应式分析ii中电流增大的原因
b.依据实验i和ii推断:③比②中
 更易变质的原因是
更易变质的原因是c.按上述原理进行实验,证实①中
 更易变质的主要原因是
更易变质的主要原因是 的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
您最近一年使用:0次
2 . 铁与水蒸气反应的实验装置如图,下列说法正确的是___________ 。
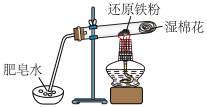
A.实验时,试管口应高于试管底
B.加热时试管内生成黑色物质,点燃肥皂泡可听到爆鸣声
C.反应的化学方程式为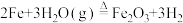
D.试管中发生化合反应
E.湿棉花的作用是提供水蒸气
F.试验结束后,应该先熄灭酒精灯,再将导管移出肥皂水

A.实验时,试管口应高于试管底
B.加热时试管内生成黑色物质,点燃肥皂泡可听到爆鸣声
C.反应的化学方程式为
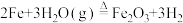
D.试管中发生化合反应
E.湿棉花的作用是提供水蒸气
F.试验结束后,应该先熄灭酒精灯,再将导管移出肥皂水
您最近一年使用:0次
3 . 某小组探究镁与醋酸溶液反应的实质。
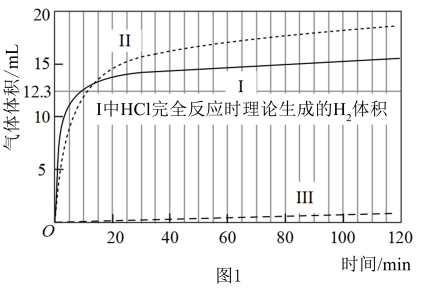
【实验】在常温水浴条件下进行实验Ⅰ~Ⅲ,记录生成气体的体积和溶液 变化,如图1、2。
变化,如图1、2。
Ⅰ.取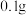 光亮的镁屑(过量)放入
光亮的镁屑(过量)放入 溶液中;
溶液中;
Ⅱ.取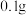 光亮的镁屑放入
光亮的镁屑放入 溶液(
溶液( )中;
)中;
Ⅲ.取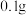 光亮的镁屑放入
光亮的镁屑放入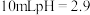 的
的 溶液中。
溶液中。
【数据】
(1)起始阶段Ⅰ中主要反应的离子方程式为___________ 。
(2)Ⅱ起始溶液中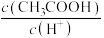 约为
约为___________ (用“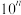 ”表示)。
”表示)。
(3)起始阶段,导致Ⅱ和Ⅲ中气体生成速率差异的主要因素不是 ,实验证据是
,实验证据是___________ 。
基于溶液组成预测Ⅱ的气体生成速率快于Ⅲ的原因是 能直接与
能直接与 反应。
反应。
验证:【实验Ⅳ】室温下,将一小段打磨光亮的镁条投入 冰醋酸中,立即产生大量气体。
冰醋酸中,立即产生大量气体。
(4)选择冰醋酸的理由是___________ 。
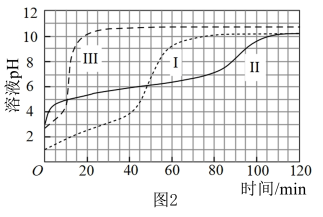
探究醋酸溶液中与 反应的主要微粒。
反应的主要微粒。
【实验Ⅴ】与实验Ⅱ相同的条件和试剂用量,将溶液换成含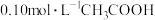 和
和 的
的 混合溶液(
混合溶液( )。各时刻气体生成的瞬时速率(
)。各时刻气体生成的瞬时速率( )对比如下。
)对比如下。
(5)①将a~c时刻对应溶液中的粒子浓度进行排序: :
:___________ (用“>”或“=”连接表示,下同);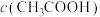 :
:___________ 。
②结合a~c中微粒浓度的比值分析, 和
和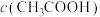 中哪一因素对气体生成速率影响更大:
中哪一因素对气体生成速率影响更大:___________ 。
(6)综合以上实验得出结论:
①镁与醋酸溶液反应时, 、
、 、
、 均能与镁反应产生氢气。
均能与镁反应产生氢气。
② 反应产生气体的主要微粒是
反应产生气体的主要微粒是___________ 。
【实验】在常温水浴条件下进行实验Ⅰ~Ⅲ,记录生成气体的体积和溶液
 变化,如图1、2。
变化,如图1、2。Ⅰ.取
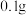 光亮的镁屑(过量)放入
光亮的镁屑(过量)放入 溶液中;
溶液中;Ⅱ.取
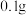 光亮的镁屑放入
光亮的镁屑放入 溶液(
溶液( )中;
)中;Ⅲ.取
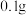 光亮的镁屑放入
光亮的镁屑放入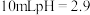 的
的 溶液中。
溶液中。【数据】


(1)起始阶段Ⅰ中主要反应的离子方程式为
(2)Ⅱ起始溶液中
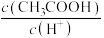 约为
约为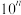 ”表示)。
”表示)。(3)起始阶段,导致Ⅱ和Ⅲ中气体生成速率差异的主要因素不是
 ,实验证据是
,实验证据是基于溶液组成预测Ⅱ的气体生成速率快于Ⅲ的原因是
 能直接与
能直接与 反应。
反应。验证:【实验Ⅳ】室温下,将一小段打磨光亮的镁条投入
 冰醋酸中,立即产生大量气体。
冰醋酸中,立即产生大量气体。(4)选择冰醋酸的理由是
探究醋酸溶液中与
 反应的主要微粒。
反应的主要微粒。【实验Ⅴ】与实验Ⅱ相同的条件和试剂用量,将溶液换成含
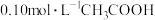 和
和 的
的 混合溶液(
混合溶液( )。各时刻气体生成的瞬时速率(
)。各时刻气体生成的瞬时速率( )对比如下。
)对比如下。| a.Ⅴ起始速率 | b.Ⅱ起始速率 | c.Ⅱ进行到 时速率 时速率 |
| 2.1 | 2.3 | 0.8 |
(5)①将a~c时刻对应溶液中的粒子浓度进行排序:
 :
: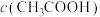 :
:②结合a~c中微粒浓度的比值分析,
 和
和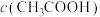 中哪一因素对气体生成速率影响更大:
中哪一因素对气体生成速率影响更大:(6)综合以上实验得出结论:
①镁与醋酸溶液反应时,
 、
、 、
、 均能与镁反应产生氢气。
均能与镁反应产生氢气。②
 反应产生气体的主要微粒是
反应产生气体的主要微粒是
您最近一年使用:0次
名校
解题方法
4 . 氯酸钾为无色或白色晶体,是一种强氧化剂。某化学小组制取氯酸钾并进行有关探究实验。
I.制取氯酸钾
利用如图所示的实验装置进行实验。回答下列问题:
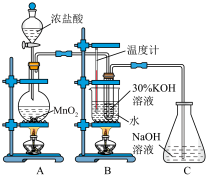
(1)装置A中盛装浓盐酸的仪器名称是___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
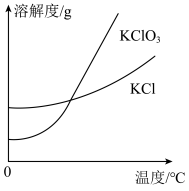
(3)氯气和氢氧化钾溶液在加热的条件下可制得氯酸钾,若装置B中加热温度过低,所得主要氧化产物为___________ (填化学式)。已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置B所得溶液中提取氯酸钾晶体的实验操作是蒸发浓缩、___________ 、洗涤、干燥。
II.探究氯酸钾与碘化钾的反应
(4)在不同条件下KClO3可将KI氧化为I2或KIO3.室温下,该小组设计了系列实验研究硫酸浓度对反应产物的影响,实验记录如下表:
①3号试管实验中x的值为___________ ;1号试管实验的作用是___________ 。
②假设氧化产物唯一,还原产物为KCl,2号试管中主要反应的离子方程式为___________ 。
③由该系列实验可得出的结论是___________ 。
I.制取氯酸钾
利用如图所示的实验装置进行实验。回答下列问题:

(1)装置A中盛装浓盐酸的仪器名称是
(2)装置A中发生反应的离子方程式为
(3)氯气和氢氧化钾溶液在加热的条件下可制得氯酸钾,若装置B中加热温度过低,所得主要氧化产物为

II.探究氯酸钾与碘化钾的反应
(4)在不同条件下KClO3可将KI氧化为I2或KIO3.室温下,该小组设计了系列实验研究硫酸浓度对反应产物的影响,实验记录如下表:
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol·L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol·L-1H2SO4/mL | 0 | 3.0 | x | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 5.0 | 0 |
| 取少量反应后溶液滴加淀粉溶液 | 无现象 | 变蓝 | 变蓝 | 无现象 |
②假设氧化产物唯一,还原产物为KCl,2号试管中主要反应的离子方程式为
③由该系列实验可得出的结论是
您最近一年使用:0次
2023-11-13更新
|
431次组卷
|
2卷引用:广东省汕头市潮阳实验学校2024届高三上学期期中考试化学试题
名校
5 . 某化学活动小组以氮氧化合物的研究为课题:
(1)氮氧化物(NO和NO2)是汽车尾气和化工生产中的常见大气污染物,NOX可以用NaClO2溶液转化为 ,向NaClO2溶液中加入硫酸,探究脱除率与初始pH的关系如图所示。
,向NaClO2溶液中加入硫酸,探究脱除率与初始pH的关系如图所示。
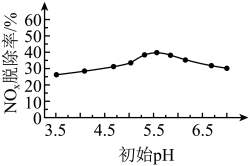
①写出NaClO2溶液加入硫酸除去NO时发生反应的离子方程式:___________ 。
②由图可知,pH=3.5比pH=5.5的脱除率低,甲同学认为①的反应从进行程度角度判断应为___________ 反应。
③乙同学认为硫酸不能用盐酸代替,请你用化学方程式来解释原因:___________ 。
(2)工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2.活动小组同学决定在实验室利用如图装置探究NO2能否被NH3还原。
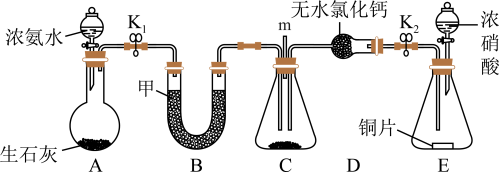
①若在一定温度和催化剂条件下NO2能够被NH3还原,化学方程式为___________ 。
②甲同学认为装置B中可以和D放入同一物质,观点___________ (填“正确”或“错误”),若“错误”你的建议是___________ 。
③乙同学发现此实验装置的不足之处是___________ ,画出补充装置并标注盛装药品名称___________ 。
(1)氮氧化物(NO和NO2)是汽车尾气和化工生产中的常见大气污染物,NOX可以用NaClO2溶液转化为
 ,向NaClO2溶液中加入硫酸,探究脱除率与初始pH的关系如图所示。
,向NaClO2溶液中加入硫酸,探究脱除率与初始pH的关系如图所示。
①写出NaClO2溶液加入硫酸除去NO时发生反应的离子方程式:
②由图可知,pH=3.5比pH=5.5的脱除率低,甲同学认为①的反应从进行程度角度判断应为
③乙同学认为硫酸不能用盐酸代替,请你用化学方程式来解释原因:
(2)工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2.活动小组同学决定在实验室利用如图装置探究NO2能否被NH3还原。

①若在一定温度和催化剂条件下NO2能够被NH3还原,化学方程式为
②甲同学认为装置B中可以和D放入同一物质,观点
③乙同学发现此实验装置的不足之处是
您最近一年使用:0次
名校
6 . 某小组为了探究硫酸的性质,设计如下实验:
回答下列问题:
(1)实验①没有明显现象的原因是___________ ;改变一个条件,为使实验①中的反应持续发生,改变条件是___________ 。
(2)为了引发实验②中的反应,宜采取的措施是___________ ;实验后,观察产物水溶液的颜色,其操作方法是___________ 。
(3)实验④产生的气体是___________ (填化学式),比较实验③和④可知,从氧化还原角度分析,H+的作用是___________ ;写出该反应的离子方程式:___________ 。
(4)向实验④所得溶液中加入过量NaOH溶液得到沉淀M,用元素分析仪分析,M为铜的氧化物,提纯干燥后的M在惰性气体氛围下加热,12 g M完全分解为10 g CuO。M的化学式为___________ ;M能与稀硫酸酸化的KI溶液反应生成白色沉淀CuI(碘化亚铜),在滤液中加入淀粉溶液,溶液变蓝色。写出M和稀硫酸酸化的KI溶液反应的离子方程式:___________ 。
| 序号 | 操作 | 现象 |
| ① | 常温下,在铁片中加入过量的浓硫酸 | 没有明显现象 |
| ② | 常温下,在铜片上加入过量的浓硫酸 | 没有明显现象 |
| ③ | 在铜和过量30%H2O2的混合溶液中加入Na2SO4溶液 | 没有明显现象 |
| ④ | 在铜和过量30%H2O2的混合溶液中加入稀硫酸 | 溶液变蓝色,并产生气泡 |
(1)实验①没有明显现象的原因是
(2)为了引发实验②中的反应,宜采取的措施是
(3)实验④产生的气体是
(4)向实验④所得溶液中加入过量NaOH溶液得到沉淀M,用元素分析仪分析,M为铜的氧化物,提纯干燥后的M在惰性气体氛围下加热,12 g M完全分解为10 g CuO。M的化学式为
您最近一年使用:0次
2023-10-22更新
|
73次组卷
|
4卷引用:河南省六市重点高中2024届高三上学期10月调研考试化学试题
解题方法
7 . 化合物A由3种元素组成,某学习小组按如下流程进行实验:
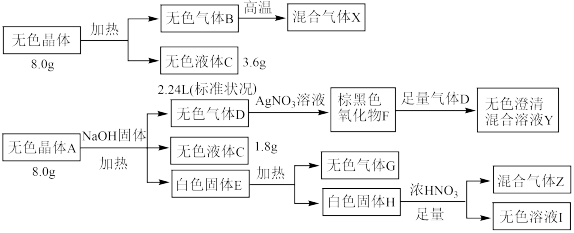
已知:无色气体B高温下分解得到的混合气体X,在相同条件下体积增大到原来的1.5倍;无色气体G为单质,混合气体Z呈红棕色。
(1)化合物A的组成元素是___________ ,A的化学式是___________ 。
(2)写出无色晶体A受热分解生成无色气体B的化学方程式:___________ 。
(3)写出F→Y过程中棕黑色固体溶解所发生反应的离子方程式:___________ 。
(4)设计实验检验白色固体E中的阴离子:___________ 。

已知:无色气体B高温下分解得到的混合气体X,在相同条件下体积增大到原来的1.5倍;无色气体G为单质,混合气体Z呈红棕色。
(1)化合物A的组成元素是
(2)写出无色晶体A受热分解生成无色气体B的化学方程式:
(3)写出F→Y过程中棕黑色固体溶解所发生反应的离子方程式:
(4)设计实验检验白色固体E中的阴离子:
您最近一年使用:0次
8 . 物质的性质与变化
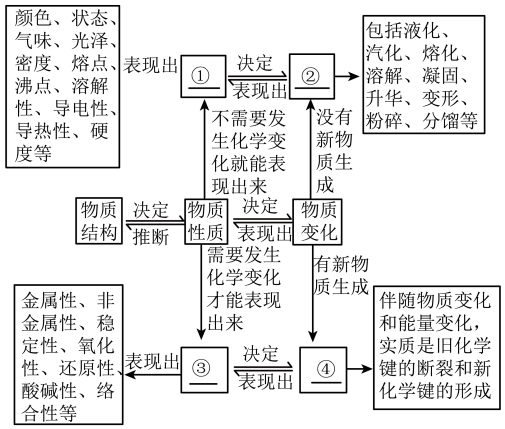
①___ 、②_____ 、③____ 、④_____ 。

①
您最近一年使用:0次
名校
解题方法
9 . 某科研小组对乙醛与新制Cu(OH)2反应的实验进行探究。文献资料:
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O Cu+Cu2+。
Cu+Cu2+。
Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
(1)实验ⅰ中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4的化学方程式___________ 。
(2)实验ⅰ、ⅱ、ⅲ中,实验___________ 的新制Cu(OH)2浊液与乙醛反应生成了Cu2O。
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
① 由实验ⅳ的现象推测:实验ⅱ的黑色沉淀是___________ 。
② 实验ⅴ能够产生砖红色沉淀的原因是___________ (结合微粒符号解释),写出实验ⅴ中该微粒与乙醛发生反应的方程式___________ 。
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:___________ ,加热,无色溶液先变为亮黄色,逐渐加深为橙黄色。
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式___________ 。
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是___________ 。
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O
 Cu+Cu2+。
Cu+Cu2+。Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
| 序号 | 5% CuSO4 溶液体积 | 10% NaOH 溶液的体积 | 振荡后现象 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅰ | 2 mL | 5滴 | 浅蓝绿色沉淀 | 仍然为浅蓝绿色沉淀 |
| ⅱ | 2 mL | 0.5 mL | 浅蓝色沉淀 | 浅蓝色沉淀→黑色沉淀 |
| ⅲ | 5滴 | 2 mL | 蓝色浊液 | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
(2)实验ⅰ、ⅱ、ⅲ中,实验
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
| 序号 | 实验 | 加入试剂 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅳ |  | 3 mL H2O | 蓝色沉淀→黑色沉淀 |
| ⅴ | 3 mL 10% NaOH | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
② 实验ⅴ能够产生砖红色沉淀的原因是
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是
您最近一年使用:0次
2023-07-10更新
|
149次组卷
|
2卷引用:北京市顺义区杨镇第一中学2023-2024学年高三上学期第一次月考化学试题
2023高三·全国·专题练习
解题方法
10 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
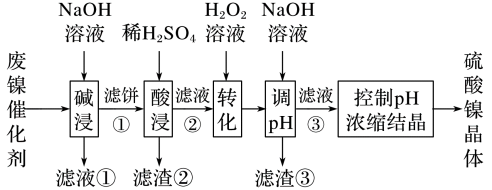
(1)为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式:___________
(2)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH.写出该反应的离子方程式:___________

(1)为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式:
(2)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH.写出该反应的离子方程式:
您最近一年使用:0次



