名校
1 . 探究H2O2与水的反应,实验如下。下列分析错误的是
(已知: 、
、 )
)
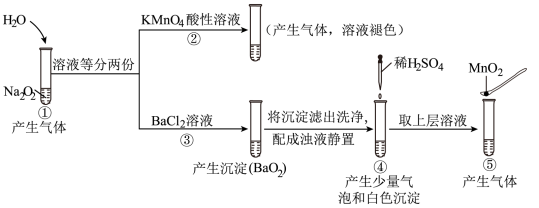
(已知:
 、
、 )
)
| A.①、⑤中产生的气体都能使带火星的木条复燃 |
B.②中 和⑤中 和⑤中 的所起的作用不同 的所起的作用不同 |
C.通过③能比较酸性: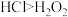 |
| D.④中发生了氧化还原反应和复分解反应 |
您最近一年使用:0次
2021-11-20更新
|
854次组卷
|
3卷引用:天津市部分区2021-2022学年高三上学期期中练习化学试题
2 . 下列装置完成相关实验,其中不合理的是

| A.图A是证明Na2O2与水反应放热 | B.图B是证明Cl2能与烧碱溶液反应 |
| C.图C是探究钠与Cl2反应 | D.图D除去Cl2中的少量HCl |
您最近一年使用:0次
2021-11-16更新
|
630次组卷
|
8卷引用:天津市第一中学2021-2022学年高一上学期期中考试化学试题
3 . 如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
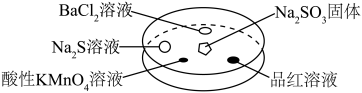
| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-03-05更新
|
979次组卷
|
29卷引用:天津市第三中学2020-2021学年高一下学期期中考试化学试题
天津市第三中学2020-2021学年高一下学期期中考试化学试题天津市宁河区芦台二中2019-2020学年高一下学期第一次阶段测试化学试题(已下线)5.1.1 硫与二氧化硫(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)(已下线)【浙江新东方】【2021.5.19】【SX】【高三下】【高中化学】【SX00144】青海省西宁市海湖中学2021-2022学年高二上学期开学考试化学试题陕西省渭南市华州区咸林中学2021-2022学年高一上学期第三阶段质量检测化学试题(已下线)2012届高三上学期化学一轮复习《硫、氮和可持续发展》专题综合测试(苏教版)2016届湖南省衡阳市第八中学高三上学期第二次月考化学试卷2015-2016学年山东寿光现代中学高一上12月月考化学卷2015-2016学年四川省资阳市高一下学期期末化学试卷湖南省长郡中学2018届高三月考试题(二)化学试题1山东省寿光现代中学2017-2018学年高一12月月考化学试题河南省郑州市第一中学2017-2018学年高一下学期入学考试化学试题甘肃省兰州市第一中学2017-2018学年高一下学期第一次月考化学试题甘肃省静宁县第一中学2017-2018学年高一下学期第二次月考化学试题【全国百强校】广西南宁市第二中学2017-2018学年高一下学期期中考试(理)化学试题【全国百强校】宁夏回族自治区吴忠中学2019届高三上学期第三次月考(期中)化学试题安徽省定远重点中学2018-2019学年高一下学期开学考试化学试题安徽省六安市舒城中学2019-2020学年高一下学期第一次月考化学试题宁夏青铜峡市高级中学2021届高三上学期期中考试化学试题山西省临汾市第一中学2021-2022学年高一上学期期末化学试题四川省什邡中学2021-2022学年高一下学期第二次月考化学试题四川省遂宁市射洪中学2021-2022学年高一下学期第一次月考化学试题(强基班)四川省广安市邻水县邻水实验学校2021-2022学年高一下学期5月第二次月考化学试题新疆伊犁哈萨克自治州伊犁州华—伊十校联盟2022-2023学年高一下学期4月期中联考化学试题云南省玉溪市民族中学2022-2023学年高一下学期6月考试化学试题云南省红河哈尼族彝族自治州第一中学2023-2024学年高一下学期3月月考化学试题北师大附属实验中学2023-2024学年度第二学期期中试卷北京师范大学附属实验中学2023-2024学年高一下学期期中考试化学试题
名校
解题方法
4 . 某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
(已知: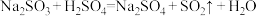 ,药品足量)
,药品足量)
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是___________ 、___________ 。
(2)反应后,装置B中发生的现象是___________ ,反应的离子方程式为___________ 。
(3)装置C中的现象是___________ ,表现了SO2的___________ 。
(4)装置D中现象是___________ ,发生反应的化学方程式为___________ 。
(5)装置E的目的是探究SO2与品红作用生成了不稳定的无色物质,请写出实验操作及现象___________ 。
(6)F装置的作用是___________ 。
(已知:
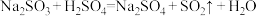 ,药品足量)
,药品足量)
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是
(2)反应后,装置B中发生的现象是
(3)装置C中的现象是
(4)装置D中现象是
(5)装置E的目的是探究SO2与品红作用生成了不稳定的无色物质,请写出实验操作及现象
(6)F装置的作用是
您最近一年使用:0次
2021-06-29更新
|
506次组卷
|
6卷引用:天津市河北区2020-2021学年高一下学期期末考试化学试题
天津市河北区2020-2021学年高一下学期期末考试化学试题天津市东丽区2021-2022学年高一下学期期末质量监测化学试题天津市第十四中学2023-2024学年高一下学期期中考试化学试题(已下线)专题01 硫、氮及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)(已下线)重难点02 常见气体的制备、性质、检验-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)(已下线)综合 期末压轴80题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)
名校
解题方法
5 . 实验小组利用传感器探究Na2CO3和NaHCO3的性质。
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱
【实验过程】
【分析与解释】
(1)实验I中,溶解时吸收热量的物质是_______ 。
(2)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为_______ ,OH-未参与该反应的实验证据是_______ 。
(3)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,造成这种差异是由于滴加NaHCO3溶液的烧杯中有_______ (填写离子符号)参与反应。
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱
【实验过程】
| 编号 | 实验操作 | 实验数据 |
| 实验I | 测量下述实验过程的温度变化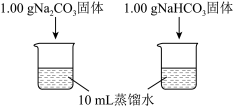 | 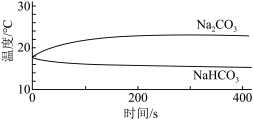 |
| 实验II | 测量下述实验过程的pH变化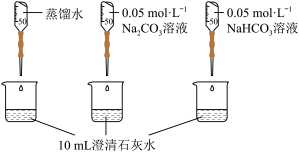 |  |
(1)实验I中,溶解时吸收热量的物质是
(2)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为
(3)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,造成这种差异是由于滴加NaHCO3溶液的烧杯中有
您最近一年使用:0次
2022-11-30更新
|
361次组卷
|
13卷引用:天津市红桥区2020-2021学年高一下学期期末考试化学试题
天津市红桥区2020-2021学年高一下学期期末考试化学试题北京市第三十一中学2020—2021学年度高一下学期期中考试化学试题北京第七中学2020-2021学年高一下学期期中考试化学试题北京市2020年普通高中学业水平合格性模拟考试化学试题2020年北京市第一次普通高中学业水平合格性考试化学试题高一必修第一册(苏教2019)专题3 第二单元 金属钠及钠的化合物4北京市回民学校2020-2021学年高一上学期期中考试化学试题(已下线)北京市第四中学2022-2023学年高一上学期期中考试化学试题北京市第四十三中学2022-2023学年高一上学期期中考试化学试题北京市第八中学2022-2023学年高一下学期期末考试化学试题(已下线)专题八 钠及其化合物北京市第十一中学2023-2024学年高一上学期期中考试化学试题北京市月坛中学2023-2024学年高一上学期期中考试化学试题
6 . 某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是( )

| A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2 |
| B.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4===4CuSO4+2NO↑+4H2O |
| C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强 |
| D.由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应 |
您最近一年使用:0次
2016-11-25更新
|
1713次组卷
|
28卷引用:天津市第八中学2020-2021学年高一下学期第一次统练化学试题
天津市第八中学2020-2021学年高一下学期第一次统练化学试题2016-2017学年天津市第一中学高一上期末化学卷辽宁省辽河油田第二高级中学2020-2021学年高一3月开学考试化学试题绥化市明水县第一中学2020-2021 学年高一下学期四月月考质量监测化学试题河北省师范大学附属中学2020-2021学年高一第二学期期中考试化学试题河北省唐县第一中学2020-2021学年高一下学期期中考试化学试题广东省惠州市2022届高三第一次调研考试化学试题福建省福州市文博中学2020-2021学年高一下学期期中考试化学试题2017届广东省惠州市高三上学期调研模拟二化学试卷湖北省沙市中学2017-2018学年高一上学期期末考试化学试题黑龙江省牡丹江市第一高级中学2019-2020学年高二上学期开学检测化学试题湖北省鄂州高中2019-2020学年高一下学期4月月考化学试题(已下线)【南昌新东方】2019-2020 雷氏中学 高一下 周练内蒙古呼和浩特市土默特左旗第一中学2019-2020学年高一下学期期中考试化学试题鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第3节 氮的循环 课时3 硝酸高一必修第二册(人教2019版)第五章 第二节 氮及其化合物 课时3 硝酸陕西省西安中学2018-2019学年高一下学期期末考试化学题(已下线)小题必刷20 氮及其化合物——2021年高考化学一轮复习小题必刷(通用版)(已下线)【浙江新东方】绍兴qw135安徽省六安市舒城县舒州中学2020-2021学年高三12月月考化学试题福建省泉州市四校(晋江磁灶中学等)2019-2020学年高一下学期期中联考化学试题(已下线)押广东卷化学第12题 物质制备与方案评价-备战2022年高考化学临考题号押题(广东卷)黑龙江省牡丹江市第二高级中学2023届高三上学期第一次阶段测试化学试题北京育才学校2022-2023学年高一下学期3月月考化学试题湖北省宜昌市协作体2022-2023学年高一下学期期中考试化学试题四川省广元中学2022-2023学年高一下期第一次段考化学试题第3课时 硝酸 人类活动对氮循环和环境的影响云南省丽江润泽高级中学2023-2024学年高一下学期3月月中考试化学试题
名校
解题方法
7 . 实验室用如下装置制取氯气,并用氯气进行系列实验。回答下列问题:
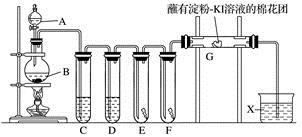
(1)A中盛有浓盐酸,B中盛有 ,写出反应的离子方程式:
,写出反应的离子方程式:______ 。
(2)试管C中盛放饱和氯化钠溶液,D中盛放浓硫酸,E中为红色干布条,F中为红色湿布条,可观察到E、F中的现象是______ ,对比E和F中的现象可得出的结论及解释是______ 。
(3)装置G处的现象为______ ,写出发生反应的化学方程式______ 。
(4)用离子方程式表示试剂X的作用:______ 。
(5)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
Ⅰ.NaClO有较强的______ (填“氧化”、“还原”)性,所以是常用的消毒剂和漂白剂。
Ⅱ.“消毒液与洁厕灵同时使用”会产生有毒的气体,写出反应的离子方程式:______ 。

(1)A中盛有浓盐酸,B中盛有
 ,写出反应的离子方程式:
,写出反应的离子方程式:(2)试管C中盛放饱和氯化钠溶液,D中盛放浓硫酸,E中为红色干布条,F中为红色湿布条,可观察到E、F中的现象是
(3)装置G处的现象为
(4)用离子方程式表示试剂X的作用:
(5)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
| 注意事项: 1.本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。 2.密封保存,请勿与洁厕灵同时作用。 3.保质期为一年 |
Ⅱ.“消毒液与洁厕灵同时使用”会产生有毒的气体,写出反应的离子方程式:
您最近一年使用:0次
2021-01-14更新
|
460次组卷
|
4卷引用:天津市和平区2020-2021学年高一上学期期末考试化学试题
解题方法
8 . 某实验小组的同学在实验室利用如图装置进行实验。
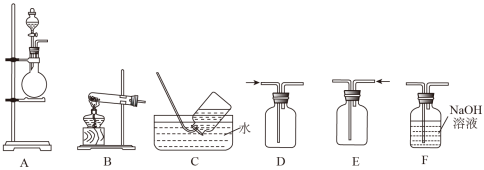
请回答下列问题:
(1)甲同学用 装置制备
装置制备 气体,上述装置中可用于收集
气体,上述装置中可用于收集 气体的是
气体的是_______ (填字母), 中发生反应的离子方程式为
中发生反应的离子方程式为_______ 。
(2)乙同学用图中的装置 进行铜与浓硫酸反应制取
进行铜与浓硫酸反应制取 气体,装置
气体,装置 中还缺少的仪器名称是
中还缺少的仪器名称是_______ ,该反应的化学方程式为_______ ;实验所产生的 尾气选用装置
尾气选用装置_______ (填字母)来吸收。
(3)丙同学用装置 制取氨气,发生反应的化学方程式是
制取氨气,发生反应的化学方程式是_______ ;为了检验集气瓶中氨气是否集满,可将湿润的红色石蕊试纸置于导管口,若_______ ,则证明已收集满;若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是_______ ,该反应的化学方程式为_______ 。
(4)丙同学在实验室中模拟氨的催化氧化反应,该反应中,当生成标准状况下 时,被氧化的氨的质量是
时,被氧化的氨的质量是_______  。
。

请回答下列问题:
(1)甲同学用
 装置制备
装置制备 气体,上述装置中可用于收集
气体,上述装置中可用于收集 气体的是
气体的是 中发生反应的离子方程式为
中发生反应的离子方程式为(2)乙同学用图中的装置
 进行铜与浓硫酸反应制取
进行铜与浓硫酸反应制取 气体,装置
气体,装置 中还缺少的仪器名称是
中还缺少的仪器名称是 尾气选用装置
尾气选用装置(3)丙同学用装置
 制取氨气,发生反应的化学方程式是
制取氨气,发生反应的化学方程式是(4)丙同学在实验室中模拟氨的催化氧化反应,该反应中,当生成标准状况下
 时,被氧化的氨的质量是
时,被氧化的氨的质量是 。
。
您最近一年使用:0次
2021-07-01更新
|
345次组卷
|
5卷引用:天津市东丽区2020-2021学年高一下学期期末考试化学试题
2021·广东·模拟预测
名校
9 . 铜与浓硝酸反应生成NO2,浓硝酸变稀后生成NO(沸点为−151℃),某探究小组由这一实验事实出发,猜测碳与浓硝酸反应生成NO2,浓硝酸变稀后生成NO,并设计如图所示装置进行验证(加热和尾气处理装置、夹持仪器均已略去)。回答下列问题:_______ ;N2的作用除将装置内空气排尽外,还有_______ 。
(2)打开弹簧夹1、2,在持续通入N2的条件下,先把碳加热至红热后停止加热,再缓慢滴入浓硝酸的原因为_______ ;反应产生的气体干燥后进入装置C的冷却瓶,气体颜色变浅接近于无色,其原因为_______ ;一段时间后,打开弹簧夹3,通入O2,冷却瓶中气体进入装置D后气体颜色仍无明显变化,说明该小组的猜测_______ (填“正确”或“错误”)。
(3)该小组对上面装置进行改进,验证碳被浓硝酸氧化的产物为CO2(加热装置和夹持仪器已略去)。
①装置F、G中的试剂可以分别选用_______ 、_______ (填标号)。
a.蒸馏水 b.NaOH溶液 c.Na2CO3溶液 d.澄清石灰水
②装置H中盛有NaOH溶液,向其中通入足量氧气进行尾气处理,生成NaNO3,该反应的离子方程式为_______ 。

(2)打开弹簧夹1、2,在持续通入N2的条件下,先把碳加热至红热后停止加热,再缓慢滴入浓硝酸的原因为
(3)该小组对上面装置进行改进,验证碳被浓硝酸氧化的产物为CO2(加热装置和夹持仪器已略去)。

①装置F、G中的试剂可以分别选用
a.蒸馏水 b.NaOH溶液 c.Na2CO3溶液 d.澄清石灰水
②装置H中盛有NaOH溶液,向其中通入足量氧气进行尾气处理,生成NaNO3,该反应的离子方程式为
您最近一年使用:0次
解题方法
10 . 某化学小组对铁及其化合物的性质、制备进行如下探究。请按要求回答下列问题。
(一) 与
与 性质探究。供选试剂:
性质探究。供选试剂: 溶液、
溶液、 溶液、
溶液、 片、
片、 粉、
粉、 溶液
溶液
(1)同学甲探究铁具有还原性,可选择试剂: 粉、
粉、 溶液、
溶液、_______ 。
(2)同学乙为探究 的还原性,取2 mL
的还原性,取2 mL  溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是
溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是_______ ;欲获得更充分证据,此实验操作应该完善为_______ 。
(3)同学丙欲探究 具有氧化性,其方案涉及反应的离子方程式为
具有氧化性,其方案涉及反应的离子方程式为_______ 。
(二) 的制备同学丁设计如图所示装置,气密性已查完好。
的制备同学丁设计如图所示装置,气密性已查完好。
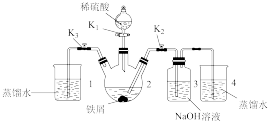
(4)为达到实验目的,需进行的操作:先打开 ,关闭
,关闭 ,打开
,打开 ,反应片刻后,再
,反应片刻后,再_______ ,_______ ,发现溶液从装置2进入装置3中,关闭 。
。
(5)从实验操作过程分析装置3中有灰绿色沉淀产生而没有产生白色沉淀的原因:_______ 。
(三)出土铁器修复部分过程的分析与探究
(6)腐蚀原理分析:一般认为,铁经过了如下腐蚀循环:Ⅰ. 转化为
转化为 ;Ⅱ.
;Ⅱ. 在自然环境中形成
在自然环境中形成 ;Ⅲ.
;Ⅲ. 和
和 反应形成致密的
反应形成致密的 保护层;Ⅳ.
保护层;Ⅳ. 保护层再转化为
保护层再转化为 。如此往复腐蚀。
。如此往复腐蚀。
①从原子结构解释步骤I很容易发生的原因:_______ 。
②上述过程属于氧化还原反应的步骤为_______ (填序号)。
(7)化学修复过程探究:研究发现, 对铁的腐蚀会造成严重影响,铁器表面会产生
对铁的腐蚀会造成严重影响,铁器表面会产生 。将铁器浸没在盛有
。将铁器浸没在盛有
 、
、
 的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用
的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用 溶液洗涤,至无
溶液洗涤,至无 。
。
①加热目的是_______ 。
②检测 洗涤干净与否的操作:
洗涤干净与否的操作:_______ 。
③铁器表面的 脱氯生成
脱氯生成 。写出该反应的离子方程式:
。写出该反应的离子方程式:_______ 。
④修复中 变成
变成 。写出该反应的化学方程式:
。写出该反应的化学方程式:_______ 。
(一)
 与
与 性质探究。供选试剂:
性质探究。供选试剂: 溶液、
溶液、 溶液、
溶液、 片、
片、 粉、
粉、 溶液
溶液(1)同学甲探究铁具有还原性,可选择试剂:
 粉、
粉、 溶液、
溶液、(2)同学乙为探究
 的还原性,取2 mL
的还原性,取2 mL  溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是
溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是(3)同学丙欲探究
 具有氧化性,其方案涉及反应的离子方程式为
具有氧化性,其方案涉及反应的离子方程式为(二)
 的制备同学丁设计如图所示装置,气密性已查完好。
的制备同学丁设计如图所示装置,气密性已查完好。
(4)为达到实验目的,需进行的操作:先打开
 ,关闭
,关闭 ,打开
,打开 ,反应片刻后,再
,反应片刻后,再 。
。(5)从实验操作过程分析装置3中有灰绿色沉淀产生而没有产生白色沉淀的原因:
(三)出土铁器修复部分过程的分析与探究
(6)腐蚀原理分析:一般认为,铁经过了如下腐蚀循环:Ⅰ.
 转化为
转化为 ;Ⅱ.
;Ⅱ. 在自然环境中形成
在自然环境中形成 ;Ⅲ.
;Ⅲ. 和
和 反应形成致密的
反应形成致密的 保护层;Ⅳ.
保护层;Ⅳ. 保护层再转化为
保护层再转化为 。如此往复腐蚀。
。如此往复腐蚀。①从原子结构解释步骤I很容易发生的原因:
②上述过程属于氧化还原反应的步骤为
(7)化学修复过程探究:研究发现,
 对铁的腐蚀会造成严重影响,铁器表面会产生
对铁的腐蚀会造成严重影响,铁器表面会产生 。将铁器浸没在盛有
。将铁器浸没在盛有
 、
、
 的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用
的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用 溶液洗涤,至无
溶液洗涤,至无 。
。①加热目的是
②检测
 洗涤干净与否的操作:
洗涤干净与否的操作:③铁器表面的
 脱氯生成
脱氯生成 。写出该反应的离子方程式:
。写出该反应的离子方程式:④修复中
 变成
变成 。写出该反应的化学方程式:
。写出该反应的化学方程式:
您最近一年使用:0次



