1 . 室温下,1体积的水能溶解约40体积的SO2。用试管收集SO2后进行如下实验。对实验现象的分析正确的是


| A.试管内液面上升,证明SO2与水发生了反应 |
| B.试管中剩余少量气体,是因为SO2的溶解已达饱和 |
C.取出试管中的溶液,立即滴入紫色石蕊试液,溶液显红色,原因是:SO2+H2O⇌H2SO3、H2SO3⇌H++ 、 、 ⇌H++ ⇌H++ |
| D.取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发 |
您最近一年使用:0次
2021-09-03更新
|
8941次组卷
|
25卷引用:天津市和平区第二南开学校2022-2023学年高一下学期第一次月考化学试题
天津市和平区第二南开学校2022-2023学年高一下学期第一次月考化学试题2021年新高考北京化学高考真题(已下线)4.1.1 二氧化硫的性质与应用-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)2021年北京高考化学试题变式题1-10上海市青浦区2022届高三一模化学试题安徽省皖北联盟2021-2022学年高一下学期5月联考化学试题上海市黄浦区2022届高三6月学业等级考调研测试化学试题上海市黄埔区2022届高三下学期二模化学试题北京市清华附中2021-2022学年高一下学期期末考试化学试题(已下线)微专题21 二氧化硫性质四重性探究-备战2023年高考化学一轮复习考点微专题(已下线)微专题30 非金属及其化合物制备流程与实验探究(S、Se、Te、Cl、Br、I)-备战2023年高考化学一轮复习考点微专题新疆石河子第一中学2021-2022学年高一下学期4月月考化学试题北京市中国人民大学附属中学丰台学校2022届高三上学期期中考试化学试题宁夏银川市第二中学2022-2023学年高三上学期统练三化学试题辽宁省大石桥市第三高级中学2021-2022学年高三12月月考化学试题江苏省苏州市常熟中学2022-2023学年高一上学期末测试卷一化学试题(已下线)专题08 元素及其化合物(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题10 常见非金属元素的性质及应用-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)新疆兵团第三师图木舒克市鸿德实验学校2022-2023学年高一下学期第一次月考化学试题(已下线)第3讲 硫及其重要化合物北京师范大学第二附属中学2023-2024学年高三上学期10月月考化学试题北京市北京师范大学第二附属中学2021-2022学年高三上学期期中考试化学试题北京市中国人民大学附属中学2021-2022学年高一下学期期末考试化学试题北京市第十三中学2023-2024学年高三上学期开学考化学试卷 北京大学附属中学预科部2023-2024学年高三下学期3月阶段练习化学试题
2 . 为探究Na2SO3的性质,实验小组同学进行了如下实验:

| A.③和④中产生的气体成分完全相同 | B.②和⑥中沉淀的主要成分不同 |
| C.①→②和④→⑥均只发生了复分解反应 | D. 的还原性在酸性条件下增强 的还原性在酸性条件下增强 |
您最近一年使用:0次
2023-04-06更新
|
2515次组卷
|
11卷引用:天津市滨海新区2023-2024学年塘沽第一中学高三上学期第二次月考化学试题
天津市滨海新区2023-2024学年塘沽第一中学高三上学期第二次月考化学试题北京市海淀区2022-2023学年高三下学期期中练习化学试题山东省东营市第一中学2023届高三下学期二模化学试题浙江省杭州第四中学2022-2023学年高一下学期期中考试化学试题(已下线)【2023】【高一下】【期中考】【杭四下沙】【高中化学】【罗梦宇收集】(已下线)题型35 微型成套装置实验流程(已下线)题型45 物质性质探究型综合实验山西省晋城一中2022-2023学年高一下学期第三次调研考试化学试题(已下线)热点19 化学微型实验北京一零一中2023-2024学年高三上学期第一次月考(开学考)化学试卷 北京市顺义区第二中学2023-2024学年高三下学期开学测化学试题
3 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
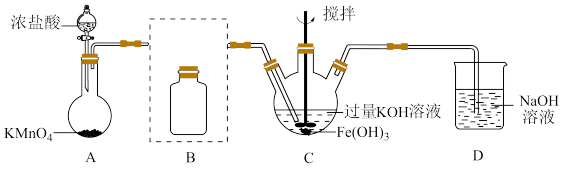
①A为氯气发生装置。A中反应方程式是________________ (锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。_______
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有________________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________ 产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2________  (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是________________ 。
③资料表明,酸性溶液中的氧化性 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:________________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是
②将除杂装置B补充完整并标明所用试剂。
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH
 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性
 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次
2018-06-09更新
|
9625次组卷
|
31卷引用:天津市耀华中学2023届高三第一次统练化学试题
天津市耀华中学2023届高三第一次统练化学试题2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题16 化学实验综合题(已下线)高考母题题源18 化学实验设计与探究(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)(已下线)2019年高考总复习巅峰冲刺-专题03 氧化还原反应 离子反应应试策略(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精讲)——2021年高考化学一轮复习讲练测高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 高考帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 高考帮河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题(已下线)易错22 气体实验装置的设计-备战2021年高考化学一轮复习易错题(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第7讲 铁及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向14 物质制备探究-备战2022年高考化学一轮复习考点微专题四川省遂宁市射洪中学2021-2022学年高一下学期第一次月考化学试题(强基班)(已下线)第07讲 铁及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第28讲 定性、定量实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)云南省玉溪市华宁县第二中学2021-2022年高一下学期开学考试化学试题第三章 金属及其化合物 第14讲 铁及其化合物的转化关系(已下线)第一部分 化学综合实验 热点6 物质性质探究实验北京一零一中学2023-2024学年高一上学期11月统练三化学试卷河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题
名校
解题方法
4 . 将浓盐酸加到 中进行如图(a~c均为浸有相应试液的棉花)所示的探究实验,反应一段时间后,下列分析正确的是
中进行如图(a~c均为浸有相应试液的棉花)所示的探究实验,反应一段时间后,下列分析正确的是
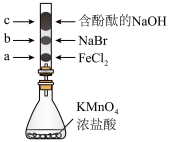
 中进行如图(a~c均为浸有相应试液的棉花)所示的探究实验,反应一段时间后,下列分析正确的是
中进行如图(a~c均为浸有相应试液的棉花)所示的探究实验,反应一段时间后,下列分析正确的是
A.a处变黄色,说明 具有还原性 具有还原性 |
B.b处变橙色,说明非金属性 |
C.c处红色逐渐变浅,说明 具有漂白性 具有漂白性 |
D.浓盐酸与 反应,只体现HCl的酸性 反应,只体现HCl的酸性 |
您最近一年使用:0次
2022-12-22更新
|
1149次组卷
|
8卷引用:天津外国语大学附属外国语学校2022-2023学年高二上学期期末考化学试题
天津外国语大学附属外国语学校2022-2023学年高二上学期期末考化学试题广东省广州市2023届高三年级调研测试化学试题广东省广州市2022-2023学年高三上学期12月调研考试化学试题(已下线)专题11 化学实验基础(测)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题08 元素及其化合物(测)-2023年高考化学二轮复习讲练测(新高考专用)上海市卢湾高级中学2022-2023学年高三下学期3月月考化学试题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(选择题1-5)广东省普宁市勤建学校2022-2023学年高二下学期学科竞赛化学试题
5 . 用下图所示装置进行气体x的性质实验,得出的实验结论正确的是
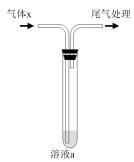

| 选项 | 实验操作 | 实验现象 | 实验结论 | |
| 制备气体x | 溶液a | |||
| A | 电石与水反应 | 溴水 | 黄色褪去 | C2H2与Br2发生加成反应 |
| B | 碳酸钠与醋酸溶液作用 | Na2SiO3溶液 | 产生白色沉淀 | H2CO3的酸性强于H2SiO3 |
| C | 乙醇与浓硫酸共热至170℃ | KMnO4酸性溶液 | 紫色褪去 | C2H4被氧化 |
| D | 溴乙烷与氢氧化钠醇溶液共热 | Br2的四氯化碳溶液 | 橙红色褪去 | C2H4与Br2发生加成反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-26更新
|
989次组卷
|
2卷引用:天津市南开区2022届高三下学期第三次模拟化学试题
名校
解题方法
6 . 向KI溶液中持续通入Cl2,发现溶液先由无色变为棕黄色,一段时间后褪色。探究溶液变色的原因。
(1)溶液变为棕黄色的原因是KI被Cl2氧化为I2,离子方程式是____ 。
[猜测]棕黄色褪去的原因是I2被氧化,氧化产物中I的化合价记为+x。
[实验Ⅰ]设计如表实验验证I2被氧化
(2)①本实验中,试剂a作____ 剂(填“氧化”或“还原”)。
②甲能证实I2被氧化而乙不能,原因是____ 。
[实验Ⅱ]通过如下实验可测定x
i.取vmLcmol·L-1KI溶液于锥形瓶中,通入过量Cl2至棕黄色褪去。
ii.边搅拌边加热锥形瓶中的溶液,一段时间后,操作A,试纸不变蓝。
iii.冷却至室温后,加入过量KI固体,生成大量紫黑色沉淀(I2)。
iv.立即用amol·L-1Na2S2O3溶液滴定。滴定过程中沉淀逐渐溶解,溶液颜色逐渐变深再变浅。当溶液变为浅黄色时,加入淀粉溶液,继续滴定至终点,消耗Na2S2O3溶液bmL。
已知:I2+2S2O =S4O
=S4O +2I-
+2I-
I-+I2 I
I (棕黄色)
(棕黄色)
I2在纯水中溶解度很小,饱和碘水呈浅黄色
(3)ii的目的是除去溶液中的Cl2,操作A是____ 。
(4)结合数据,计算可得x=____ (用代数式表示)。
[反思]
(5)实验过程中,在未知x具体数值的情况下,iii中为保证所加的KI固体过量,理论上加入的n(KI)应大于i中n(KI)的____ (填数字)倍。
(6)从平衡移动的角度解释iv中“溶液颜色逐渐变深再变浅”的原因:____ 。
(1)溶液变为棕黄色的原因是KI被Cl2氧化为I2,离子方程式是
[猜测]棕黄色褪去的原因是I2被氧化,氧化产物中I的化合价记为+x。
[实验Ⅰ]设计如表实验验证I2被氧化
| 装置 | 序号 | 试剂a | 现象 |
 | 甲 | Na2SO3溶液 | 溶液均变黄,遇淀粉变蓝 |
| 乙 | KI溶液 |
②甲能证实I2被氧化而乙不能,原因是
[实验Ⅱ]通过如下实验可测定x
i.取vmLcmol·L-1KI溶液于锥形瓶中,通入过量Cl2至棕黄色褪去。
ii.边搅拌边加热锥形瓶中的溶液,一段时间后,操作A,试纸不变蓝。
iii.冷却至室温后,加入过量KI固体,生成大量紫黑色沉淀(I2)。
iv.立即用amol·L-1Na2S2O3溶液滴定。滴定过程中沉淀逐渐溶解,溶液颜色逐渐变深再变浅。当溶液变为浅黄色时,加入淀粉溶液,继续滴定至终点,消耗Na2S2O3溶液bmL。
已知:I2+2S2O
 =S4O
=S4O +2I-
+2I-I-+I2
 I
I (棕黄色)
(棕黄色)I2在纯水中溶解度很小,饱和碘水呈浅黄色
(3)ii的目的是除去溶液中的Cl2,操作A是
(4)结合数据,计算可得x=
[反思]
(5)实验过程中,在未知x具体数值的情况下,iii中为保证所加的KI固体过量,理论上加入的n(KI)应大于i中n(KI)的
(6)从平衡移动的角度解释iv中“溶液颜色逐渐变深再变浅”的原因:
您最近一年使用:0次
2022-04-09更新
|
1034次组卷
|
6卷引用:天津市新华中学2023届高三下学期第一次统一练习化学试题
天津市新华中学2023届高三下学期第一次统一练习化学试题天津市新华中学2022-2023学年高三第一次模拟考试化学试题北京市东城区2022届高三一模化学试题(已下线)化学-2022年高考押题预测卷02(福建卷)(已下线)必刷卷03-2022年高考化学考前信息必刷卷(广东专用)广东省广州市广大附中、广外、铁一中学三校2022届高三三模联考化学试题
名校
解题方法
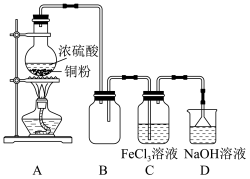
7 . 某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2并完成相关性质探究(不考虑水蒸气)。(已知:C+2H2SO4(浓) CO2+2SO2↑+2H2O)
CO2+2SO2↑+2H2O)
(1)有同学认为制得的SO2中可能混有杂质,其化学式为___________ 。
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。___________ ;装置C中品红溶液的作用是___________ 。
②装置H的作用为___________ 。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。___________ ;
②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是___________ (填Ⅰ、Ⅱ或Ⅲ);试管b中发生反应的离子方程式为___________ 。
 CO2+2SO2↑+2H2O)
CO2+2SO2↑+2H2O)(1)有同学认为制得的SO2中可能混有杂质,其化学式为
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。

②装置H的作用为
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。

②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是
您最近一年使用:0次
2024-02-28更新
|
650次组卷
|
7卷引用:天津市武清区黄花店中学2023-2024学年高一下学期第一次月考化学试题(理科)
天津市武清区黄花店中学2023-2024学年高一下学期第一次月考化学试题(理科)江西省丰城中学2023-2024学年高一下学期开学化学试题(已下线)专题03 常见气体的实验室制取(考题猜想)(6大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)江西省南昌市第十九中学2023-2024学年高一下学期3月月考化学试题河北省石家庄市河北正定中学2023-2024学年高一下学期第一次月考(3月)化学试题辽宁省长海县高级中学2023-2024下学期第一次月考高一化学试卷湖南省常德市第一中学2023-2024学年高一下学期第一次月考化学试题
2024·辽宁鞍山·二模
解题方法
8 . 某实验小组在探究 性质时,做了如下实验:
性质时,做了如下实验:
实验Ⅰ:向NaCl溶液中加入 溶液,溶液呈绿色。
溶液,溶液呈绿色。
实验Ⅱ:向 溶液中加入表面打磨掉氧化膜的金属Mg,产生大量气泡同时溶液中产生绿色沉淀。
溶液中加入表面打磨掉氧化膜的金属Mg,产生大量气泡同时溶液中产生绿色沉淀。
实验Ⅲ:向 溶液中加入适量氨水,溶液变为深蓝色。
溶液中加入适量氨水,溶液变为深蓝色。
实验Ⅳ:向实验Ⅲ的深蓝色溶液中加入 溶液,产生蓝色沉淀。
溶液,产生蓝色沉淀。
资料显示: 为黄色,
为黄色,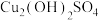 为绿色不溶物。
为绿色不溶物。
下列说法错误的是
 性质时,做了如下实验:
性质时,做了如下实验:实验Ⅰ:向NaCl溶液中加入
 溶液,溶液呈绿色。
溶液,溶液呈绿色。实验Ⅱ:向
 溶液中加入表面打磨掉氧化膜的金属Mg,产生大量气泡同时溶液中产生绿色沉淀。
溶液中加入表面打磨掉氧化膜的金属Mg,产生大量气泡同时溶液中产生绿色沉淀。实验Ⅲ:向
 溶液中加入适量氨水,溶液变为深蓝色。
溶液中加入适量氨水,溶液变为深蓝色。实验Ⅳ:向实验Ⅲ的深蓝色溶液中加入
 溶液,产生蓝色沉淀。
溶液,产生蓝色沉淀。资料显示:
 为黄色,
为黄色,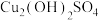 为绿色不溶物。
为绿色不溶物。下列说法错误的是
A.实验Ⅰ: 在NaCl溶液中部分转化为 在NaCl溶液中部分转化为 |
B.实验Ⅱ:Mg消耗了溶液中的 从而产生了 从而产生了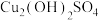 |
C.实验Ⅲ:有 生成 生成 |
D.实验Ⅳ:获得的蓝色沉淀为 |
您最近一年使用:0次
9 . 室温下,将充满NO2的试管倒立在水中,实验现象如图。下列分析不正确 的是
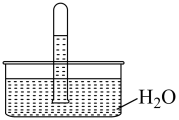
| A.NO2易溶于水,不能用排水法收集 |
| B.试管中剩余的无色气体是未溶解的NO2 |
| C.取试管中的溶液,滴加紫色石蕊溶液,溶液显红色,是因为NO2与H2O反应生成了酸 |
| D.向试管中再缓缓通入一定量的O2,试管中的液面上升 |
您最近一年使用:0次
2022-04-10更新
|
1129次组卷
|
12卷引用:天津市第五十四中学2023-2024学年高一下学期第一次月考 (3 月 )化学试卷
天津市第五十四中学2023-2024学年高一下学期第一次月考 (3 月 )化学试卷北京市西城区2022届高三一模化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)吉林省长春汽车经济技术开发区第三中学 2021-2022学年 高一下学期线上月考化学试题(已下线)专项06 元素及其化合物-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(北京卷)北京市第八十中学2021-2022学年高一下学期期中考试化学试题黑龙江省齐齐哈尔市八校联合体2022-2023学年高三上学期期中考试化学试题北京理工大学附属中学2022-2023学年高三上学期12月月考化学试题北京市第十五中学2023-2024学年高三上学期期中考试化学试题河南省漯河市高级中学2023-2024学年高一下学期3月月考化学试题北京市清华大学附属中学朝阳学校2023-2024学年高一下学期3月月考化学
21-22高三上·陕西咸阳·期末
名校
解题方法
10 . 某校化学兴趣小组探究 与
与 溶液的反应,装置如图所示。
溶液的反应,装置如图所示。
(1)①A装置中制备 的化学方程式为
的化学方程式为_______ ;②装置B的作用_______ 。
(2)该小组同学预测 与
与 溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:
溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:_______ (用离子方程式表示)。
(3)该小组探究实验的具体步骤如下:
根据步骤Ⅰ、Ⅱ、Ⅲ的现象,该小组学查阅资料获知:
ⅰ.生成红棕色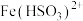 离子的反应为:
离子的反应为:
ⅱ.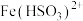 离子可以将
离子可以将 还原为
还原为
③溶液中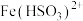 与
与 反应的离子方程式为
反应的离子方程式为_______
④由上述实验可知 与
与 溶液反应生成
溶液反应生成 所需时间较长,缩短该反应所用时间可以采取的措施
所需时间较长,缩短该反应所用时间可以采取的措施_______ (任写两条)
 与
与 溶液的反应,装置如图所示。
溶液的反应,装置如图所示。
(1)①A装置中制备
 的化学方程式为
的化学方程式为(2)该小组同学预测
 与
与 溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:
溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:(3)该小组探究实验的具体步骤如下:
| 步骤 | 现象 | 结论 |
Ⅰ。取   溶液于装置C中,并连接好装置,通入 溶液于装置C中,并连接好装置,通入 至饱和。 至饱和。 | 溶液很快由黄色变为红棕色。 | |
| Ⅱ.用激光笔照射步骤Ⅰ中的红棕色溶液。 | 溶液中无明显光路。 | ①红棕色溶液不是 |
| Ⅲ.将步骤Ⅰ中的溶液静置。 | 1小时后,溶液逐渐变为浅绿色。 | ②溶液中有 |
ⅰ.生成红棕色
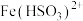 离子的反应为:
离子的反应为:
ⅱ.
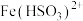 离子可以将
离子可以将 还原为
还原为
③溶液中
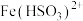 与
与 反应的离子方程式为
反应的离子方程式为④由上述实验可知
 与
与 溶液反应生成
溶液反应生成 所需时间较长,缩短该反应所用时间可以采取的措施
所需时间较长,缩短该反应所用时间可以采取的措施
您最近一年使用:0次
2022-04-04更新
|
582次组卷
|
4卷引用:三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)
(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)陕西省咸阳市武功县普集高级中学2021-2022学年高三上学期期末考试化学试题(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)辽宁省渤海大学附属高级中学2021-2022学年高一下学期第二次阶段性考试化学试题



