名校
解题方法
1 . 为研究含硫化合物的性质,某兴趣小组在老师的指导下设计了如下实验。
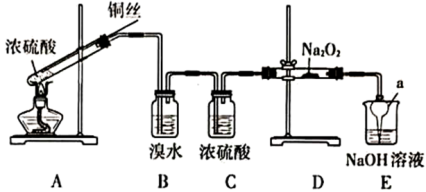
回答以下问题:
(1)A装置试管中主要反应的化学方程式是___________ 。反应中,浓硫酸表现出的性质是___________ (填正确选项的字母)。
A.酸性 B.氧化性 C.脱水性 D.吸水性
(2)仪器a的名称是___________ ,在本实验中的作用是___________ 。
(3)B中溴水出现的现象是___________ ,说明 具有的性质是
具有的性质是___________ 。
(4)D中 与
与 反应生成
反应生成 ,反应的化学方程式是
,反应的化学方程式是___________ 。
(5)同学们发现,A装置试管中铜和硫酸均有剩余时反应却自动停止了,由此推测反应与硫酸的浓度有关。同学们通过查阅资料知, 和浓硫酸反应会同时生成多种含硫化合物。在老师的指导下,同学们按如下步骤测定硫酸能与铜反应的最低浓度。
和浓硫酸反应会同时生成多种含硫化合物。在老师的指导下,同学们按如下步骤测定硫酸能与铜反应的最低浓度。
①在盛有过量铜粉的试管中加入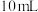 ,
, 浓硫酸进行反应。
浓硫酸进行反应。
②反应自动停止时,收集到 ,测得其他生成物中硫元素的质量共
,测得其他生成物中硫元素的质量共 ,由此可计算出硫酸能与铜反应的最低浓度是
,由此可计算出硫酸能与铜反应的最低浓度是___________  (忽略反应前后溶液体积的变化,计算结果保留一位小数)。
(忽略反应前后溶液体积的变化,计算结果保留一位小数)。

回答以下问题:
(1)A装置试管中主要反应的化学方程式是
A.酸性 B.氧化性 C.脱水性 D.吸水性
(2)仪器a的名称是
(3)B中溴水出现的现象是
 具有的性质是
具有的性质是(4)D中
 与
与 反应生成
反应生成 ,反应的化学方程式是
,反应的化学方程式是(5)同学们发现,A装置试管中铜和硫酸均有剩余时反应却自动停止了,由此推测反应与硫酸的浓度有关。同学们通过查阅资料知,
 和浓硫酸反应会同时生成多种含硫化合物。在老师的指导下,同学们按如下步骤测定硫酸能与铜反应的最低浓度。
和浓硫酸反应会同时生成多种含硫化合物。在老师的指导下,同学们按如下步骤测定硫酸能与铜反应的最低浓度。①在盛有过量铜粉的试管中加入
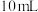 ,
, 浓硫酸进行反应。
浓硫酸进行反应。②反应自动停止时,收集到
 ,测得其他生成物中硫元素的质量共
,测得其他生成物中硫元素的质量共 ,由此可计算出硫酸能与铜反应的最低浓度是
,由此可计算出硫酸能与铜反应的最低浓度是 (忽略反应前后溶液体积的变化,计算结果保留一位小数)。
(忽略反应前后溶液体积的变化,计算结果保留一位小数)。
您最近一年使用:0次
2021-01-07更新
|
436次组卷
|
4卷引用:四川省南充高级中学2020-2021学年高一下学期3月阶段性检测化学试题
四川省南充高级中学2020-2021学年高一下学期3月阶段性检测化学试题安徽省淮北市树人高级中学2020-2021学年高一上学期期末考试化学试题广西桂林市2019-2020学年高一上学期期末质量检测化学试题(已下线)周末培优1 硫、氮及其化合物的相互转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)
名校
解题方法
2 . 某研究性学习小组设计如图实验装置进行探究。
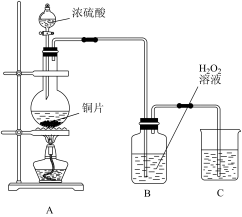
(1)装置A中反应的化学方程式为_______ 。
(2)实验结束后,欲验证反应生成的气体具有还原性,小组同学取装置 B中溶液少量于一洁净的试管中,应向试管中加入的试剂是_______ (填字母)。
a.品红溶液 b.酸性高锰酸钾溶液 c.BaCl2溶液 d.稀硝酸
(3)实验结束,小组同学立即熄灭酒精灯,可能导致的后果是_______ 。
(4)装置C中的试剂为_______ ,作用是_______ 。
(5)实验结束,发现在铜片表面附着黑色固体。查阅资料得知此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为CuO和SO2。该小组同学收集一定量黑色固体,按如图实验方案探究其成分:
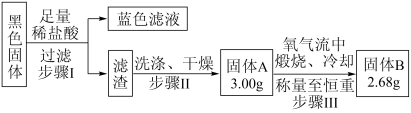
①步骤Ⅰ中所发生的化学方程式_______ 。
②检验步骤Ⅱ中滤渣洗涤干净的方法_______ 。
③黑色固体的成分是_______ 。

(1)装置A中反应的化学方程式为
(2)实验结束后,欲验证反应生成的气体具有还原性,小组同学取装置 B中溶液少量于一洁净的试管中,应向试管中加入的试剂是
a.品红溶液 b.酸性高锰酸钾溶液 c.BaCl2溶液 d.稀硝酸
(3)实验结束,小组同学立即熄灭酒精灯,可能导致的后果是
(4)装置C中的试剂为
(5)实验结束,发现在铜片表面附着黑色固体。查阅资料得知此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为CuO和SO2。该小组同学收集一定量黑色固体,按如图实验方案探究其成分:

①步骤Ⅰ中所发生的化学方程式
②检验步骤Ⅱ中滤渣洗涤干净的方法
③黑色固体的成分是
您最近一年使用:0次
3 . 利用“价类二维图”研究物质的性质,是一种有效的学习方法。以下是铁元素及其化合物的二维图的部分信息。

(1)X、Y的化学式分别为_________ 。_________ 、
(2)图中只具有还原性的物质是_________ (写化学式)。
(3)可以证明FeCl2既具有氧化性又具有还原性的试剂分别为_________ 、_________ 。
(4)某实验小组设计如下实验探究亚铁盐的性质。
实验I中最后生成红褐色沉淀的化学方程式是____________________________________ 。
②对实验II所得白色沉淀展开研究:(已知Fe(HCO3)2常温常压下在水中不能大量存在)
i.取II中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量H2O2,溶液立即变为红色。
根据以上现象,实验II中生成的白色沉淀的化学式为_________ 。
③研究过程中发现实验II中白色沉淀在空气中久置最终也变为红褐色。则该沉淀比实验I中所得的Fe(OH)2的还原性_________ (填“强”或“弱”)。

(1)X、Y的化学式分别为
(2)图中只具有还原性的物质是
(3)可以证明FeCl2既具有氧化性又具有还原性的试剂分别为
(4)某实验小组设计如下实验探究亚铁盐的性质。
实验方案 | 现象 | |
| Ⅰ | 1.0mL0.1mol/LFeSO4溶液中滴入1.0mL0.5mol/L NaOH溶液 | 生成白色沉淀,3min后沉淀基本变为红褐色 |
| Ⅱ | 1.0mL0.1mol/LFeSO4溶液中滴入1.0mL0.5mol/L NaHCO3溶液 | 生成白色沉淀,3min后沉淀颜色几乎不变 |
②对实验II所得白色沉淀展开研究:(已知Fe(HCO3)2常温常压下在水中不能大量存在)
i.取II中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量H2O2,溶液立即变为红色。
根据以上现象,实验II中生成的白色沉淀的化学式为
③研究过程中发现实验II中白色沉淀在空气中久置最终也变为红褐色。则该沉淀比实验I中所得的Fe(OH)2的还原性
您最近一年使用:0次
2020-03-03更新
|
190次组卷
|
3卷引用:四川省遂宁市射洪中学2021-2022学年高一上学期第三次(12月)月考(强基班)化学试题
四川省遂宁市射洪中学2021-2022学年高一上学期第三次(12月)月考(强基班)化学试题四川省成都市2019-2020学年高一上学期期末调研考试化学试题(已下线)第13讲 铁的氧化物和铁的氢氧化物-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)
名校
4 . 已知:①草酸是一种弱酸,草酸晶体( )易溶于水,受热易熔化、气化和分解.
)易溶于水,受热易熔化、气化和分解.
②草酸分解产生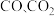 和
和 .
.
③草酸钙是白色固体,难溶于水.
根据上述信息,回答下列问题.
(1)草酸晶体受热分解的化学方程式是__________ .
(2)通过如图装置(部分夹持装置省略)验证草酸晶体分解的部分产物.
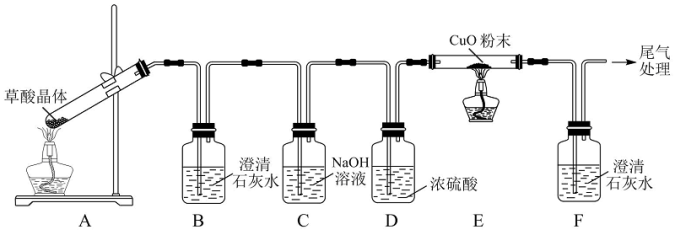
①B中澄清石灰水变浑浊,并不能证明产物中一定有 ,理由是
,理由是_____________ .
②能证明分解产物中有 气体生成的实验现象是
气体生成的实验现象是___________ .
(3)下列叙述能证明草酸是弱酸的是_____________(填字母序号).
(4)实验室常用 酸性
酸性 标准溶液来滴定未知浓度的草酸溶液,滴定原理是利用了草酸的
标准溶液来滴定未知浓度的草酸溶液,滴定原理是利用了草酸的_________________ (填“氧化性”、“还原性”或“酸性”),滴定过程中发生反应的离子方程式是____________ .
 )易溶于水,受热易熔化、气化和分解.
)易溶于水,受热易熔化、气化和分解.②草酸分解产生
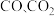 和
和 .
.③草酸钙是白色固体,难溶于水.
根据上述信息,回答下列问题.
(1)草酸晶体受热分解的化学方程式是
(2)通过如图装置(部分夹持装置省略)验证草酸晶体分解的部分产物.

①B中澄清石灰水变浑浊,并不能证明产物中一定有
 ,理由是
,理由是②能证明分解产物中有
 气体生成的实验现象是
气体生成的实验现象是(3)下列叙述能证明草酸是弱酸的是_____________(填字母序号).
A.将草酸晶体溶于含酚酞的 溶液中,溶液褪色 溶液中,溶液褪色 |
| B.用草酸溶液做导电试验,灯泡很暗 |
C. 的草酸溶液和稀硫酸,分别稀释100倍后前者 的草酸溶液和稀硫酸,分别稀释100倍后前者 小 小 |
D.将草酸晶体加入 溶液中,有 溶液中,有 放出 放出 |
 酸性
酸性 标准溶液来滴定未知浓度的草酸溶液,滴定原理是利用了草酸的
标准溶液来滴定未知浓度的草酸溶液,滴定原理是利用了草酸的
您最近一年使用:0次
5 . 某小组在做铜与浓硫酸反应时发现产生黑色固体。于是他们对黑色固体进行探究,实验步骤如下:
I.将光亮铜丝插入浓硫酸,加热;
II.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
III.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
(1)步骤II产生的气体是_______ 。
(2)该同学假设黑色沉淀是CuO。检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加 溶液,若产生红褐色沉淀,证明有Cu2+。
溶液,若产生红褐色沉淀,证明有Cu2+。
①将CuO放入稀硫酸中,一段时间后,再滴加 溶液,产生红褐色沉淀。
溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,滴加 溶液,未见红褐色沉淀。由该检验过程所得结论是:该黑色沉淀
溶液,未见红褐色沉淀。由该检验过程所得结论是:该黑色沉淀_______ CuO(填写“含有”或“不含”)
(3)再次假设,黑色沉淀是铜的硫化物。实验如下:
①现象2说明黑色沉淀具有_______ 性(填写“氧化性”或“还原性”)
②请写出在试管上方由无色气体转变为红棕色气体的化学方程式_______ 。
③能确认黑色沉淀中含有S元素的现象是_______ 。
④为确认黑色沉淀是否含有二价铜,需要进行的实验是_______ 。
(4)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入足量浓硫酸中加热一段时间后,黑色沉淀完全溶解,得到澄清溶液,其中CuS溶解的化学方程式是_______ 。
I.将光亮铜丝插入浓硫酸,加热;
II.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
III.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
(1)步骤II产生的气体是
(2)该同学假设黑色沉淀是CuO。检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加
 溶液,若产生红褐色沉淀,证明有Cu2+。
溶液,若产生红褐色沉淀,证明有Cu2+。①将CuO放入稀硫酸中,一段时间后,再滴加
 溶液,产生红褐色沉淀。
溶液,产生红褐色沉淀。②将黑色沉淀放入稀硫酸中,一段时间后,滴加
 溶液,未见红褐色沉淀。由该检验过程所得结论是:该黑色沉淀
溶液,未见红褐色沉淀。由该检验过程所得结论是:该黑色沉淀(3)再次假设,黑色沉淀是铜的硫化物。实验如下:
| 实验装置 | 现象 |
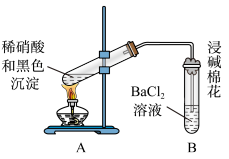 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
②请写出在试管上方由无色气体转变为红棕色气体的化学方程式
③能确认黑色沉淀中含有S元素的现象是
④为确认黑色沉淀是否含有二价铜,需要进行的实验是
(4)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入足量浓硫酸中加热一段时间后,黑色沉淀完全溶解,得到澄清溶液,其中CuS溶解的化学方程式是
您最近一年使用:0次
2021-07-07更新
|
157次组卷
|
2卷引用:四川省广安市2020-2021学年高一下学期期末考试化学试题
6 . I.某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验。请根据下列实验回答问题:

(1)甲同学用此装置验证物质的氧化性: ,则a中加浓盐酸,b中加
,则a中加浓盐酸,b中加 ,c中加
,c中加_______ 溶液。将浓盐酸滴入b中后,发生反应的离子方程式是_______ ;b中反应结束后再向c中加入少量 ,振荡静置后观察到c中的现象为
,振荡静置后观察到c中的现象为_______ 。
(2)乙同学用此装置制少量溴苯,a中盛液溴,b中为铁屑和苯,c中盛水。将液溴滴入b中后,发生反应的化学方程式是:_______ ,_______ 。向c中滴加 溶液,可观察到的现象是
溶液,可观察到的现象是_______ 。
II.已知乙烯能发生以下转化:

(1)乙烯的结构式为:_______ 。
(2)写出下列化合物官能团的名称:
B中含官能团名称_______ ;D中含官能团名称_______ 。
(3)写出反应的化学方程式及反应类型:
①B→C_______ ;反应类型:_______ 。
②B+D→乙酸乙酯_______ ;反应类型:_______ 。

(1)甲同学用此装置验证物质的氧化性:
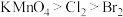 ,则a中加浓盐酸,b中加
,则a中加浓盐酸,b中加 ,c中加
,c中加 ,振荡静置后观察到c中的现象为
,振荡静置后观察到c中的现象为(2)乙同学用此装置制少量溴苯,a中盛液溴,b中为铁屑和苯,c中盛水。将液溴滴入b中后,发生反应的化学方程式是:
 溶液,可观察到的现象是
溶液,可观察到的现象是II.已知乙烯能发生以下转化:

(1)乙烯的结构式为:
(2)写出下列化合物官能团的名称:
B中含官能团名称
(3)写出反应的化学方程式及反应类型:
①B→C
②B+D→乙酸乙酯
您最近一年使用:0次
名校
解题方法
7 . SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成。向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是__________ 。(结合有关平衡方程式简要说明)
②欲验证酸性:H2SO3>HClO,选用下面的装置,其连接顺序为:
A
________ (按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___ 。
(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成。向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是
②欲验证酸性:H2SO3>HClO,选用下面的装置,其连接顺序为:
A

(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)
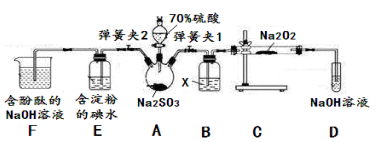
操作步骤 | 实验现象 | 解释原因 |
| 关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为① |
| 若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2=2Na2SO3+O2 | |
| 关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中。 | E中② | E中反应的离子方程式③ |
| F中④ | F中反应为2OH-+SO2=SO32-+H2O |
您最近一年使用:0次
2017-03-24更新
|
538次组卷
|
4卷引用:四川省成都艺术高级中学2021届高三上学期1月月考理综化学试题
名校
8 . 二氧化氯是高效、低毒的消毒剂。已知:ClO2 是一种黄绿色易溶于水的气体,具有强氧化性,用如图装置制备ClO2及性质探究,回答下列问题:
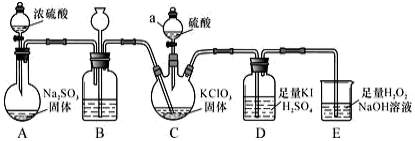
(1)仪器a的名称_______ ,装置B的作用是_______ 。
(2)装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为_______ ,装置 D 中滴有几滴淀粉溶液,其作用是_______ 。
(3)科学家在此基础上用H2C2O4代替Na2SO3研究出一种新的制备ClO2方法:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2 ↑+2H2O。试回答下列问题。
①该反应中氧化产物的化学式是_______ 。
②若反应共产生了4.48L气体(标准状况),则反应转移电子的物质的量为_______ ,消耗还原剂的物质的量为_______ 。
③在酸性条件下,标准状况下44. 8mL的ClO2气体恰好能与50mL0.1mol/L的Na2SO3溶液完全反应生成Na2SO4,请写出该反应的离子方程式_______ 。

(1)仪器a的名称
(2)装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为
(3)科学家在此基础上用H2C2O4代替Na2SO3研究出一种新的制备ClO2方法:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2 ↑+2H2O。试回答下列问题。
①该反应中氧化产物的化学式是
②若反应共产生了4.48L气体(标准状况),则反应转移电子的物质的量为
③在酸性条件下,标准状况下44. 8mL的ClO2气体恰好能与50mL0.1mol/L的Na2SO3溶液完全反应生成Na2SO4,请写出该反应的离子方程式
您最近一年使用:0次
2021-03-19更新
|
402次组卷
|
3卷引用:四川省广安代市中学校2020-2021学年高一下学期第二次月考化学试题
四川省广安代市中学校2020-2021学年高一下学期第二次月考化学试题(已下线)2021年高考化学押题预测卷(新课标Ⅰ卷)(02)(含考试版、答题卡、参考答案、全解全析)浙江省淳安县汾口中学2019-2020学年高一下学期期末联考化学试题
2019高三·全国·专题练习
名校
解题方法
9 . 用如图所示装置进行下列实验:将①中浓硫酸溶液滴入②中。预测的现象与结论相符的是
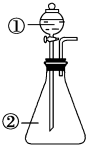

| 选项 | ② | 预测②中现象 | 实验结论 |
| A | 浓盐酸 | 产生大量气体 | 硫酸的酸性比盐酸强 |
| B | 铜片 | 铜片溶解,产生气泡,底部产生灰白色粉末 | 浓硫酸的酸性和强氧化性 |
| C | CuSO4•5H2O | 固体由蓝色变为白色 | 浓硫酸具有吸水性,发生物理变化 |
| D | 蔗糖 | 固体由白色变为黑色海绵状,并有刺激性气体放出 | 浓硫酸具有脱水性、强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-07-02更新
|
545次组卷
|
14卷引用:四川省雅安中学2020-2021学年高一下学期4月月考化学试题
四川省雅安中学2020-2021学年高一下学期4月月考化学试题合肥市第九中学2020-2021学年高一下学期期中考试化学试题辽宁省大连市第一中学2020-2021学年高一下学期4月月考化学试题河北省衡水市第十四中学2020-2021学年高一下学期摸底考试化学试题(已下线)2019年8月19日《每日一题》2020年高考一轮复习—— 浓硫酸的性质(已下线)第15讲 硫及其化合物(精练)-2021年高考化学一轮复习讲练测吉林省吉化第一高级中学校2021-2022学年高一下学期4月期中考试化学试题河南省叶县高级中学2021-2022学年高一下学期5月质量检测化学试题湖北省襄阳市襄州区第二高级中学2021-2022学年高一下学期期中考试化学试题新疆精河县高级中学2021-2022学年高一下学期期中考试化学试题广东省江门市第一中学2021-2022学年高一下学期第一次月考化学试题(已下线)题型51 浓硫酸的性质广东省佛山市第四中学2022-2023学年高一下学期3月月考化学试卷山西省实验中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
10 . Ⅰ.请根据下列实验装置图回答问题。
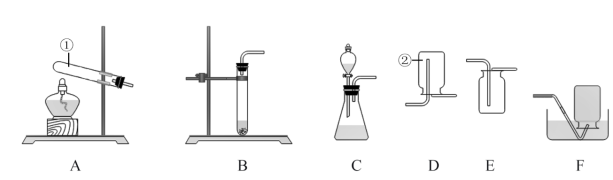
(1)写出标号仪器的名称:②是___ 。能用装置E收集的气体应具有的性质是___ 。
(2)实验室用过氧化氢溶液和MnO2混合制O2时MnO2的作用是___ 。收集较纯净的氧气,装置可用____ (填字母)。
(3)实验室可用铜片与浓硝酸在常温下反应制取少量二氧化氮(NO2)。通常状况下,二氧化氮是红棕色气体,溶于水时与水反应生成硝酸和一氧化氮(NO)。
①制取NO2的发生装置可用___ (填字母)。
②收集NO2不用装置F的原因是___ (用化学方程式表示)。
Ⅱ.铜及其化合物在生产生活中有重要应用。某同学对铜及某些含铜物质进行探究。
【温故知新】
(4)在①CuO②Cu(OH)2③CuCl2④Cu2(OH)2CO3[也可表示为CaCO3·Cu(OH)2]这4种物质中,属于碱的有___ (填序号);除①CuO外,其余3种物质在常温下易溶于水有___ (填序号)。
(5)考古出土的春秋末期制造的青铜剑,历经2500余年,其表面且有一层薄锈,但仍寒光逼人,剑刃锋利。由此可知,铜器表面的薄锈是铜与空气中的氧气、水、___ 等物质发生反应所形成。
【提出问题】
除H2、CO能还原CuO外,是否还有其他气体能够还原CuO得到金属铜?怎样从含CuCl2、FeCl3的某工业废液中回收金属铜和FeCl2溶液?
【查阅资料】
a.通常状况下,氨气极易溶于水形成溶液;加热时,氨气能与CuO反应生成氮气和金属铜等,可用如图所示装置验证。
b.在溶液中能发生反应2FeCl3+Fe=3FeCl2。
【进行实验1】
(6)按图示连接装置,检查气密性后,加(通)入相关药品,后续操作均按规范要求进行,完成实验。
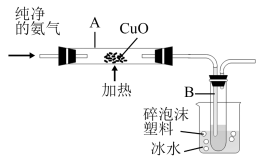
①实验时,在试管B中能够观察到的现象是有液体出现,该液体是__ (填“纯净物”或“混合物”)。
②从环保角度看该装置的不足之处是___ 。
【进行实验2】
(7)取适量含CuCl2、FeCl3的某工业废液样品,向其中加入过量铁粉并充分反应后,过滤,将滤渣和足量___ (填“稀盐酸”或“稀硫酸”)充分反应,再过滤、洗涤、干燥即可回收得到金属铜;所得滤液中含有需要回收的FeCl2。
【拓展延伸】
(8)已知:加热时,葡萄糖溶液与氢氧化铜悬浊液能发生反应。实验室可用CuSO4溶液等物质检验葡萄糖的存在,具体实验过程为:在试管中加入2mL10%NaOH溶液,滴加5%CuSO4溶液5滴(每滴溶液按0.04mL计算。两种溶液的密度均按1g/mL计算),混合均匀,充分反应,得混合物A。再向上述试管中加入几滴10%葡萄糖溶液,并在酒精灯上加热至沸腾,片刻后生成红色沉淀B。检验完成。则混合物A显___ (填“中性”或“碱性”);红色沉淀B是____ [填“CuO”或“Cu2O”或“Cu(OH)2”]。

(1)写出标号仪器的名称:②是
(2)实验室用过氧化氢溶液和MnO2混合制O2时MnO2的作用是
(3)实验室可用铜片与浓硝酸在常温下反应制取少量二氧化氮(NO2)。通常状况下,二氧化氮是红棕色气体,溶于水时与水反应生成硝酸和一氧化氮(NO)。
①制取NO2的发生装置可用
②收集NO2不用装置F的原因是
Ⅱ.铜及其化合物在生产生活中有重要应用。某同学对铜及某些含铜物质进行探究。
【温故知新】
(4)在①CuO②Cu(OH)2③CuCl2④Cu2(OH)2CO3[也可表示为CaCO3·Cu(OH)2]这4种物质中,属于碱的有
(5)考古出土的春秋末期制造的青铜剑,历经2500余年,其表面且有一层薄锈,但仍寒光逼人,剑刃锋利。由此可知,铜器表面的薄锈是铜与空气中的氧气、水、
【提出问题】
除H2、CO能还原CuO外,是否还有其他气体能够还原CuO得到金属铜?怎样从含CuCl2、FeCl3的某工业废液中回收金属铜和FeCl2溶液?
【查阅资料】
a.通常状况下,氨气极易溶于水形成溶液;加热时,氨气能与CuO反应生成氮气和金属铜等,可用如图所示装置验证。
b.在溶液中能发生反应2FeCl3+Fe=3FeCl2。
【进行实验1】
(6)按图示连接装置,检查气密性后,加(通)入相关药品,后续操作均按规范要求进行,完成实验。

①实验时,在试管B中能够观察到的现象是有液体出现,该液体是
②从环保角度看该装置的不足之处是
【进行实验2】
(7)取适量含CuCl2、FeCl3的某工业废液样品,向其中加入过量铁粉并充分反应后,过滤,将滤渣和足量
【拓展延伸】
(8)已知:加热时,葡萄糖溶液与氢氧化铜悬浊液能发生反应。实验室可用CuSO4溶液等物质检验葡萄糖的存在,具体实验过程为:在试管中加入2mL10%NaOH溶液,滴加5%CuSO4溶液5滴(每滴溶液按0.04mL计算。两种溶液的密度均按1g/mL计算),混合均匀,充分反应,得混合物A。再向上述试管中加入几滴10%葡萄糖溶液,并在酒精灯上加热至沸腾,片刻后生成红色沉淀B。检验完成。则混合物A显
您最近一年使用:0次



