名校
解题方法
1 . 某实验室利用 和
和 反应合成硫酰氯
反应合成硫酰氯 ,并对
,并对 和
和 的酸性强弱进行探究。已知
的酸性强弱进行探究。已知 的熔点为
的熔点为 ,沸点为
,沸点为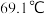 ,在空气中遇水蒸气发生剧烈反应,并产生大量
,在空气中遇水蒸气发生剧烈反应,并产生大量 白雾,
白雾, 以上分解生成
以上分解生成 和
和 。实验室合成
。实验室合成 的原理:
的原理: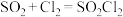 ,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:
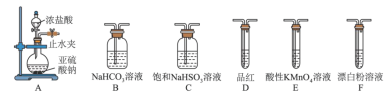
,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:
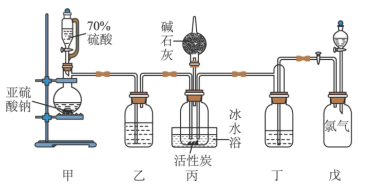
(1)盛装碱石灰固体的装置名称为:___________ ;碱石灰的作用为:___________ 。
(2)装置戊上方分液漏斗中最好选用___________ (填字母)。
a.蒸馏水 b.饱和食盐水 c.浓氢氧化钠溶液 d. 盐酸
盐酸
(3) 的实验室制备也可以用氯酸钾和浓盐酸在加热条件下反应,写出对应的离子反应方程式
的实验室制备也可以用氯酸钾和浓盐酸在加热条件下反应,写出对应的离子反应方程式___________ 。
(4)装置丙放置在冰水浴中的原因是___________ 。
(5) 和水发生非氧化还原反应的化学方程式为
和水发生非氧化还原反应的化学方程式为___________ 。
(6)选用下面的装置探究酸性: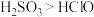 ,溶液均足量,其连接顺序为
,溶液均足量,其连接顺序为
___________ 。能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为___________ 。信息: 可以使品红褪色,通常用来检验
可以使品红褪色,通常用来检验 ;
; 难溶于饱和的
难溶于饱和的 溶液;
溶液; 酸性大于
酸性大于
 和
和 反应合成硫酰氯
反应合成硫酰氯 ,并对
,并对 和
和 的酸性强弱进行探究。已知
的酸性强弱进行探究。已知 的熔点为
的熔点为 ,沸点为
,沸点为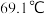 ,在空气中遇水蒸气发生剧烈反应,并产生大量
,在空气中遇水蒸气发生剧烈反应,并产生大量 白雾,
白雾, 以上分解生成
以上分解生成 和
和 。实验室合成
。实验室合成 的原理:
的原理: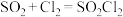 ,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:
,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:
(1)盛装碱石灰固体的装置名称为:
(2)装置戊上方分液漏斗中最好选用
a.蒸馏水 b.饱和食盐水 c.浓氢氧化钠溶液 d.
 盐酸
盐酸(3)
 的实验室制备也可以用氯酸钾和浓盐酸在加热条件下反应,写出对应的离子反应方程式
的实验室制备也可以用氯酸钾和浓盐酸在加热条件下反应,写出对应的离子反应方程式(4)装置丙放置在冰水浴中的原因是
(5)
 和水发生非氧化还原反应的化学方程式为
和水发生非氧化还原反应的化学方程式为(6)选用下面的装置探究酸性:
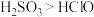 ,溶液均足量,其连接顺序为
,溶液均足量,其连接顺序为
 的酸性强于
的酸性强于 的实验现象为
的实验现象为 可以使品红褪色,通常用来检验
可以使品红褪色,通常用来检验 ;
; 难溶于饱和的
难溶于饱和的 溶液;
溶液; 酸性大于
酸性大于

您最近一年使用:0次
名校
解题方法
2 . 某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时简要与水接触。
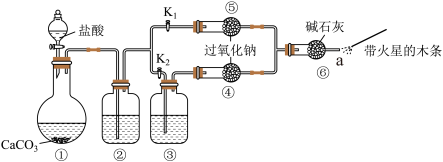
资料:碱石灰可做干燥剂,可以与酸性气体 等反应。
等反应。
【装置分析】
(1)装置②中的试剂是___________ (填序号)。装置③中的试剂是___________ (填序号)。
a.饱和 溶液 b.饱和
溶液 b.饱和 溶液 c.浓
溶液 c.浓
【进行实验】
步骤1:打开弹簧夹 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,
(2)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是___________ 。
(3)过氧化钠跟二氧化碳反应的化学方程式是___________ 。
【实验反思】
(4)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是___________ 。
(5)需要补充的实验操作是:取⑤中反应后的少量固体后,___________ 。
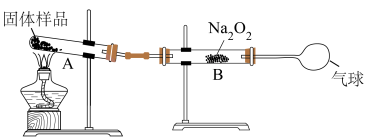
(6)侯氏制碱得到的碳酸钠产品中会含少量碳酸氢钠。某兴趣小组称量
 固体样品,利用下图装置测定产品纯度,装置A中生成的
固体样品,利用下图装置测定产品纯度,装置A中生成的
 和
和
 被B中的
被B中的
 全部吸收后,测得
全部吸收后,测得
 增重
增重
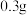 ,该碳酸钠产品的纯度为
,该碳酸钠产品的纯度为___________ %。

资料:碱石灰可做干燥剂,可以与酸性气体
 等反应。
等反应。【装置分析】
(1)装置②中的试剂是
a.饱和
 溶液 b.饱和
溶液 b.饱和 溶液 c.浓
溶液 c.浓
【进行实验】
步骤1:打开弹簧夹
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。步骤2:打开弹簧夹
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,(2)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是
(3)过氧化钠跟二氧化碳反应的化学方程式是
【实验反思】
(4)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是
(5)需要补充的实验操作是:取⑤中反应后的少量固体后,
(6)侯氏制碱得到的碳酸钠产品中会含少量碳酸氢钠。某兴趣小组称量
 固体样品,利用下图装置测定产品纯度,装置A中生成的
固体样品,利用下图装置测定产品纯度,装置A中生成的 和
和 被B中的
被B中的 全部吸收后,测得
全部吸收后,测得 增重
增重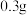 ,该碳酸钠产品的纯度为
,该碳酸钠产品的纯度为
您最近一年使用:0次
3 . 绿矾( )可作还原剂、着色剂、制药等,在不同温度下分解得各种铁的氧化物和硫的氧化物。
)可作还原剂、着色剂、制药等,在不同温度下分解得各种铁的氧化物和硫的氧化物。
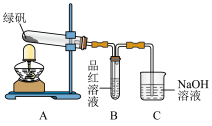
(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是_____ ,甲组由此得出绿矾的分解产物中含有 。
。
(2)乙组同学查阅资料发现绿矾受热分解还可能有 放出,为此,丙组同学选用甲组同学的A装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置(试剂均足量):
放出,为此,丙组同学选用甲组同学的A装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置(试剂均足量):
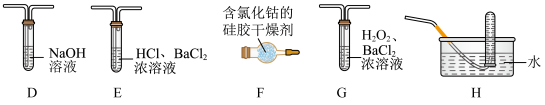
①乙组同学的实验装置中,依次连接的合理顺序为_____ 。
②E中HCl的作用是_____ 。
③反应结束,观察到A中固体变为红棕色,F由蓝色变粉红色,E、G中均有白色沉淀,将H中的试管从水槽取出,_____ (填实验操作和现象)证明绿矾分解产物中有 。
。
(3)将E、G混合物抽滤、洗涤、干燥、称重,发现固体质量之比1∶3.抽滤装置如下图,下列关于抽滤洗涤的操作正确的是_____ 。
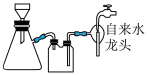
a.抽滤时,先打开水龙头,再将固液混合物转移至布氏漏斗
b.洗涤时,先关闭水龙头,向布氏漏斗中加蒸馏水至淹没沉淀,再打开水龙头
c.洗涤结束后,先将抽滤瓶上的橡胶管取下,再关闭水龙头
(4)取A中少量反应后固体于试管中,先加_____ (填化学式,下同)溶解,再将溶液分成两份,一份加入KSCN溶液,另一份加入_____ ,第一份溶液变红,第二份溶液无明显现象。
(5)综上实验,绿矾分解的化学方程式为_____ 。
 )可作还原剂、着色剂、制药等,在不同温度下分解得各种铁的氧化物和硫的氧化物。
)可作还原剂、着色剂、制药等,在不同温度下分解得各种铁的氧化物和硫的氧化物。
(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是
 。
。(2)乙组同学查阅资料发现绿矾受热分解还可能有
 放出,为此,丙组同学选用甲组同学的A装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置(试剂均足量):
放出,为此,丙组同学选用甲组同学的A装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置(试剂均足量):
①乙组同学的实验装置中,依次连接的合理顺序为
②E中HCl的作用是
③反应结束,观察到A中固体变为红棕色,F由蓝色变粉红色,E、G中均有白色沉淀,将H中的试管从水槽取出,
 。
。(3)将E、G混合物抽滤、洗涤、干燥、称重,发现固体质量之比1∶3.抽滤装置如下图,下列关于抽滤洗涤的操作正确的是

a.抽滤时,先打开水龙头,再将固液混合物转移至布氏漏斗
b.洗涤时,先关闭水龙头,向布氏漏斗中加蒸馏水至淹没沉淀,再打开水龙头
c.洗涤结束后,先将抽滤瓶上的橡胶管取下,再关闭水龙头
(4)取A中少量反应后固体于试管中,先加
(5)综上实验,绿矾分解的化学方程式为
您最近一年使用:0次
4 . 某化学小组拟设计实验探究 与钙盐溶液的反应情况。
与钙盐溶液的反应情况。
【文献资料】① 是难溶于水、易溶于盐酸的白色固体:②实验室用
是难溶于水、易溶于盐酸的白色固体:②实验室用 粉末和70%硫酸反应制备
粉末和70%硫酸反应制备 ;③浓硫酸与水混合时放出大量的热,产生大量“酸雾”。
;③浓硫酸与水混合时放出大量的热,产生大量“酸雾”。
【设计实验】
实验Ⅰ:探究二氧化硫与氯化钙溶液反应。___________ (填代号)。
(2)D装置作用是___________ (用离子方程式表示)。
(3)连接装置进行实验,发现C装置中产生白色沉淀。
①甲同学对白色沉淀成分提出如下假设:
假设1:白色固体是 ;
;
假设2:白色固体是 ;
;
假设3:白色固体是 和
和 。
。
②乙同学设计实验证明白色沉淀是 ,他的实验方案是
,他的实验方案是___________ 。
③丙同学认为C中生成硫酸钙的原因是装置内 氧化了
氧化了 。
。
排除装置内 干扰采取的措施是:在启动B中反应之前,
干扰采取的措施是:在启动B中反应之前,___________ (填实验步骤)
重新实验,C中无明显现象,所以 和
和 溶液不反应。
溶液不反应。
实验Ⅱ:探究 和
和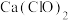 溶液反应。
溶液反应。
丁同学仅将上述实验C装置中氯化钙溶液换成漂白精溶液,进行实验时产生了大量白色沉淀。
(4)化学反应有两种情况。
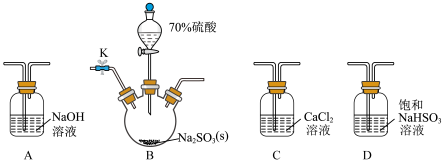
①若 过量,则发生反应为
过量,则发生反应为
②若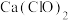 过量,则发生反应为
过量,则发生反应为___________ 。
(5)为了探究C中 是否过量,戊同学取少量c中上层清液于试管中,加入下列物质可以达到实验目的的是
是否过量,戊同学取少量c中上层清液于试管中,加入下列物质可以达到实验目的的是___________ (填字母)。
a.品红溶液 b. 溶液 c.紫色石蕊溶液
溶液 c.紫色石蕊溶液
 与钙盐溶液的反应情况。
与钙盐溶液的反应情况。【文献资料】①
 是难溶于水、易溶于盐酸的白色固体:②实验室用
是难溶于水、易溶于盐酸的白色固体:②实验室用 粉末和70%硫酸反应制备
粉末和70%硫酸反应制备 ;③浓硫酸与水混合时放出大量的热,产生大量“酸雾”。
;③浓硫酸与水混合时放出大量的热,产生大量“酸雾”。【设计实验】
实验Ⅰ:探究二氧化硫与氯化钙溶液反应。
(2)D装置作用是
(3)连接装置进行实验,发现C装置中产生白色沉淀。
①甲同学对白色沉淀成分提出如下假设:
假设1:白色固体是
 ;
;假设2:白色固体是
 ;
;假设3:白色固体是
 和
和 。
。②乙同学设计实验证明白色沉淀是
 ,他的实验方案是
,他的实验方案是③丙同学认为C中生成硫酸钙的原因是装置内
 氧化了
氧化了 。
。排除装置内
 干扰采取的措施是:在启动B中反应之前,
干扰采取的措施是:在启动B中反应之前,重新实验,C中无明显现象,所以
 和
和 溶液不反应。
溶液不反应。实验Ⅱ:探究
 和
和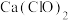 溶液反应。
溶液反应。丁同学仅将上述实验C装置中氯化钙溶液换成漂白精溶液,进行实验时产生了大量白色沉淀。
(4)化学反应有两种情况。
①若
 过量,则发生反应为
过量,则发生反应为
②若
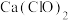 过量,则发生反应为
过量,则发生反应为(5)为了探究C中
 是否过量,戊同学取少量c中上层清液于试管中,加入下列物质可以达到实验目的的是
是否过量,戊同学取少量c中上层清液于试管中,加入下列物质可以达到实验目的的是a.品红溶液 b.
 溶液 c.紫色石蕊溶液
溶液 c.紫色石蕊溶液
您最近一年使用:0次
名校
5 . 某化学兴趣小组设计如下实验方案,用浓硫酸与铜片反应制备 ,并进行相关实验探究,实验装置如下图所示:
,并进行相关实验探究,实验装置如下图所示:
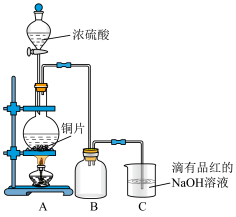
(1)装置 中发生反应的化学方程式是
中发生反应的化学方程式是___________ 。
(2)装置 的作用是
的作用是___________ 。
(3)装置 中的
中的 全部转化为
全部转化为 的标志是
的标志是___________ 。
(4)甲同学向 中得到的
中得到的 溶液中加入漂粉精(主要成分为次氯酸钙)溶液,观察到有白色沉淀生成,该白色沉淀是
溶液中加入漂粉精(主要成分为次氯酸钙)溶液,观察到有白色沉淀生成,该白色沉淀是___________ 静置一段时间后,甲同学取少量上层清液于试管中加入几小块 固体,发现有气泡产生。认为一定是按照
固体,发现有气泡产生。认为一定是按照 发生反应,请你写出甲同学认为发生反应的离子反应方程式
发生反应,请你写出甲同学认为发生反应的离子反应方程式___________ 。
(5)乙同学通过查阅工具书,得知H2SO3: ;
; ;
; ,他得出
,他得出 、
、 、
、 的酸性由强到弱为
的酸性由强到弱为___________ ;他预测只要 满足一定关系就能解释上述现象。 你认为下列比值能够解释上述现象的是
满足一定关系就能解释上述现象。 你认为下列比值能够解释上述现象的是___________ 。
A.1:1 B.3:1 C.1:2 D.4:1
于是他另取少量同样的上清液,滴加少量溴水,振荡,出现___________ 现象,证明自己预测正确。
 ,并进行相关实验探究,实验装置如下图所示:
,并进行相关实验探究,实验装置如下图所示:
(1)装置
 中发生反应的化学方程式是
中发生反应的化学方程式是(2)装置
 的作用是
的作用是(3)装置
 中的
中的 全部转化为
全部转化为 的标志是
的标志是(4)甲同学向
 中得到的
中得到的 溶液中加入漂粉精(主要成分为次氯酸钙)溶液,观察到有白色沉淀生成,该白色沉淀是
溶液中加入漂粉精(主要成分为次氯酸钙)溶液,观察到有白色沉淀生成,该白色沉淀是 固体,发现有气泡产生。认为一定是按照
固体,发现有气泡产生。认为一定是按照 发生反应,请你写出甲同学认为发生反应的离子反应方程式
发生反应,请你写出甲同学认为发生反应的离子反应方程式(5)乙同学通过查阅工具书,得知H2SO3:
 ;
; ;
; ,他得出
,他得出 、
、 、
、 的酸性由强到弱为
的酸性由强到弱为 满足一定关系就能解释上述现象。 你认为下列比值能够解释上述现象的是
满足一定关系就能解释上述现象。 你认为下列比值能够解释上述现象的是A.1:1 B.3:1 C.1:2 D.4:1
于是他另取少量同样的上清液,滴加少量溴水,振荡,出现
您最近一年使用:0次
2023-11-04更新
|
276次组卷
|
2卷引用:安徽省合肥一六八中学2023-2024学年高二上学期第二次月考化学试题
名校
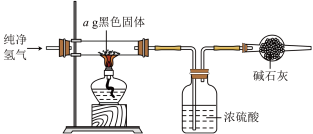
6 . 1841年美国学者Fremy首次合成了 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。
实验(一)制备 ,装置如图所示:
,装置如图所示:___________ 。
(2)甲装置中副产物为氯化钾,写出生成 的离子方程式:
的离子方程式:___________ ,实验完毕后,对甲装置中混合液进行___________ 过滤、洗涤、低温干燥。
实验(二)探究 性质及应用。
性质及应用。
取10g草酸溶于40mL水中,加入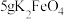 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有 ,经测定所得气体中还含有
,经测定所得气体中还含有 。
。
(3)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分,当黑色固体完全反应后,测得浓硫酸质量净增bg,当 等于
等于___________ (用最简分数比表示)时,黑色固体为 。
。 稳定性(用
稳定性(用 浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:
浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:___________ 。
②在相同条件下, 作消毒剂最佳温度是
作消毒剂最佳温度是___________ 。
(5)查阅资料可知, 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
方案1:在 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。
方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。___________ (填“1”或“2”)能证明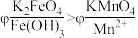 ,石墨极的电极反应式为
,石墨极的电极反应式为___________ 。
 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。实验(一)制备
 ,装置如图所示:
,装置如图所示: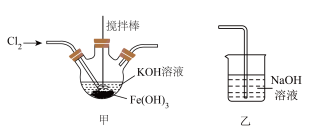
(2)甲装置中副产物为氯化钾,写出生成
 的离子方程式:
的离子方程式:实验(二)探究
 性质及应用。
性质及应用。取10g草酸溶于40mL水中,加入
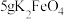 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有 ,经测定所得气体中还含有
,经测定所得气体中还含有 。
。(3)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分,当黑色固体完全反应后,测得浓硫酸质量净增bg,当
 等于
等于 。
。
 稳定性(用
稳定性(用 浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:
浓度表示)与pH关系如图,其消毒效率与温度关系如图所示: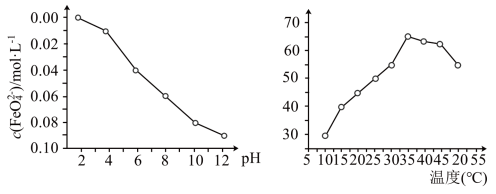
②在相同条件下,
 作消毒剂最佳温度是
作消毒剂最佳温度是(5)查阅资料可知,
 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)方案1:在
 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。
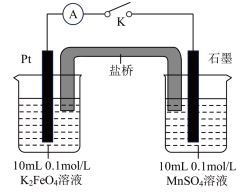
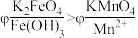 ,石墨极的电极反应式为
,石墨极的电极反应式为
您最近一年使用:0次
解题方法
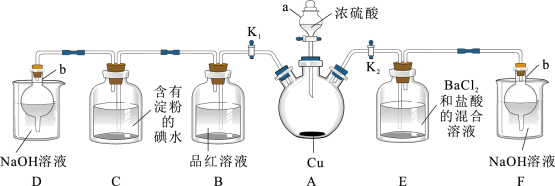
7 . 某化学兴趣小组同学利用如图所示装置(夹持及加热装置已略去,装置气密性良好)探究SO2的性质(实验前已事先除去装置中的空气)。请回答下列问题:
查阅资料得知浓硫酸的沸点为338℃,酒精灯火焰的温度为400~500℃。
(1)仪器a的名称___________ 。
(2)装置D和F的作用是___________ 。
(3)加热时,装置A中反应的化学方程式___________ 。
(4)打开K1,关闭K2,加热装置A一段时间后,装置B中的现象是___________ ,若要证明其过程是可逆的,还需要的操作是___________ 。
(5)装置C中溶液由蓝色变为无色,为了证实该过程中SO2已被氧化,具体的实验操作及现象是___________ 。

查阅资料得知浓硫酸的沸点为338℃,酒精灯火焰的温度为400~500℃。
(1)仪器a的名称
(2)装置D和F的作用是
(3)加热时,装置A中反应的化学方程式
(4)打开K1,关闭K2,加热装置A一段时间后,装置B中的现象是
(5)装置C中溶液由蓝色变为无色,为了证实该过程中SO2已被氧化,具体的实验操作及现象是
您最近一年使用:0次
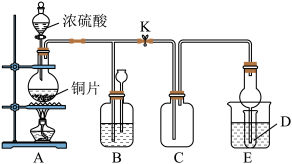
8 . 某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。
实验中某同学将 铜片和
铜片和 的浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的
的浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的 和
和 剩余,请回答:
剩余,请回答:
(1)请写出 与浓硫酸反应的化学方程式:
与浓硫酸反应的化学方程式:_______ ,反应中氧化剂和还原剂的物质的量之比为:_______ 。
(2)装置E中试管D内盛品红溶液,当C中气体收集满后,D中有可能观察到的现象是_______ 。
(3)足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是_______(填字母)。
(4)C中气体通入下列溶液中,溶液褪色且原理相同的两组是_______ (填序号)。
①滴有酚酞的 溶液 ②紫色石蕊试液 ③品红溶液 ④溴水 ⑤酸性高锰酸钾溶液
溶液 ②紫色石蕊试液 ③品红溶液 ④溴水 ⑤酸性高锰酸钾溶液
(5)实验中该同学向A中反应后溶液中加入 ,使铜片全部溶解且仅生成硫酸铜溶液,该反应的离子方程式是
,使铜片全部溶解且仅生成硫酸铜溶液,该反应的离子方程式是_______ 。
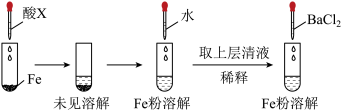
(6)根据下图操作及现象推断酸X为_______(填序号)。

实验中某同学将
 铜片和
铜片和 的浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的
的浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的 和
和 剩余,请回答:
剩余,请回答:(1)请写出
 与浓硫酸反应的化学方程式:
与浓硫酸反应的化学方程式:(2)装置E中试管D内盛品红溶液,当C中气体收集满后,D中有可能观察到的现象是
(3)足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是_______(填字母)。
A. | B. 溶液 溶液 | C. | D. 溶液 溶液 |
①滴有酚酞的
 溶液 ②紫色石蕊试液 ③品红溶液 ④溴水 ⑤酸性高锰酸钾溶液
溶液 ②紫色石蕊试液 ③品红溶液 ④溴水 ⑤酸性高锰酸钾溶液(5)实验中该同学向A中反应后溶液中加入
 ,使铜片全部溶解且仅生成硫酸铜溶液,该反应的离子方程式是
,使铜片全部溶解且仅生成硫酸铜溶液,该反应的离子方程式是(6)根据下图操作及现象推断酸X为_______(填序号)。

| A.浓盐酸 | B.浓硫酸 | C.浓硝酸 | D.稀硫酸 |
您最近一年使用:0次
9 . 某化学兴趣小组同学做了探究Cl2与Na2SO3溶液反应,实验装置如下。
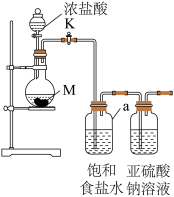
(1)装置中仪器a的名称是___________ ,饱和食盐水的作用是___________ ,发生装置的气密性检查操作方法是___________ 。
(2)试剂M是___________ (填名称)。写出制取氯气的化学方程式___________ 。
(3)该装置的不足之处___________ 。
(4)Cl2与Na2SO3溶液反应的离子方程式为___________ 。
(5)设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化___________ 。

(1)装置中仪器a的名称是
(2)试剂M是
(3)该装置的不足之处
(4)Cl2与Na2SO3溶液反应的离子方程式为
(5)设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化
您最近一年使用:0次
解题方法
10 . 某化学实验小组探究草酸盐的性质。
(1)文献表明:相同条件下, 的还原性强于Fe2+。为验证此结论,小组同学完成了如下实验:向10mL0.5mol·L-1FeCl3溶液中缓慢加入0.5mol·L-1K2C2O 4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
的还原性强于Fe2+。为验证此结论,小组同学完成了如下实验:向10mL0.5mol·L-1FeCl3溶液中缓慢加入0.5mol·L-1K2C2O 4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
已知:[K3Fe(C2O4)3·3H2O]为翠绿色晶体 Fe3+ + 3
 [Fe(C2O4)3]3- K= 1.6×1020
[Fe(C2O4)3]3- K= 1.6×1020
①取少量翠绿色晶体,洗净配成溶液,滴加KSCN溶液,不变红,继续加入硫酸,溶液变红。解释溶液变红的原因:________ 。
②经检验反应后的翠绿色溶液中无Fe2+,解释 和Fe3+未发生氧化还原反应的可能原因:
和Fe3+未发生氧化还原反应的可能原因:__ 。
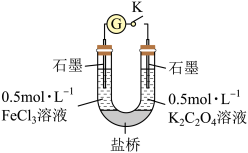
③某同学利用电化学原理来比较Fe2+和 的还原性强弱:闭合开关K,电流表指针发生偏转,经过一段时间后,
的还原性强弱:闭合开关K,电流表指针发生偏转,经过一段时间后,_______ (填操作与现象),则证明 的还原性大于Fe2+,该装置的优点是
的还原性大于Fe2+,该装置的优点是____________________________ 。
(2)利用Na2C2O4测定某KMnO4粗产品的纯度,实验步骤如下:
①称取 KMnO4粗产品,配成50mL溶液。
KMnO4粗产品,配成50mL溶液。
②称取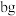 Na2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
Na2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
③将锥形瓶中溶液加热到75°C~80°C,恒温,用①中所配溶液滴定至终点,消耗①中的溶液VmL。进行滴定
时,①中所配溶液应置于__________ 中(填写仪器名称),步骤③中滴定终点的现象是_________ ,粗产品中KMnO4的质量分数表达式为__________________ 。
(1)文献表明:相同条件下,
 的还原性强于Fe2+。为验证此结论,小组同学完成了如下实验:向10mL0.5mol·L-1FeCl3溶液中缓慢加入0.5mol·L-1K2C2O 4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
的还原性强于Fe2+。为验证此结论,小组同学完成了如下实验:向10mL0.5mol·L-1FeCl3溶液中缓慢加入0.5mol·L-1K2C2O 4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。已知:[K3Fe(C2O4)3·3H2O]为翠绿色晶体 Fe3+ + 3

 [Fe(C2O4)3]3- K= 1.6×1020
[Fe(C2O4)3]3- K= 1.6×1020①取少量翠绿色晶体,洗净配成溶液,滴加KSCN溶液,不变红,继续加入硫酸,溶液变红。解释溶液变红的原因:
②经检验反应后的翠绿色溶液中无Fe2+,解释
 和Fe3+未发生氧化还原反应的可能原因:
和Fe3+未发生氧化还原反应的可能原因:③某同学利用电化学原理来比较Fe2+和
 的还原性强弱:闭合开关K,电流表指针发生偏转,经过一段时间后,
的还原性强弱:闭合开关K,电流表指针发生偏转,经过一段时间后, 的还原性大于Fe2+,该装置的优点是
的还原性大于Fe2+,该装置的优点是
(2)利用Na2C2O4测定某KMnO4粗产品的纯度,实验步骤如下:
①称取
 KMnO4粗产品,配成50mL溶液。
KMnO4粗产品,配成50mL溶液。②称取
 Na2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
Na2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。③将锥形瓶中溶液加热到75°C~80°C,恒温,用①中所配溶液滴定至终点,消耗①中的溶液VmL。进行滴定
时,①中所配溶液应置于
您最近一年使用:0次



