1 . 某小组探究Cu和 的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
【实验探究】
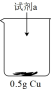
实验ⅰ:向装有0.5gCu的烧杯中加入20mL30% 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)①写出该化合反应的化学方程式:___________ 。
②电极反应式:氧化反应:___________ ;还原反应: 。
。
【继续探究】
针对该反应较慢,小组同学查阅资料,设计并完成了下列实验。
(2)实验ⅱ中:溶液变蓝的原因是___________ (用化学方程式表示)。经检验产生的气体为氧气,产生氧气的原因是___________ 。
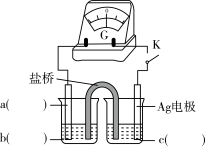
(3)对比实验ⅰ和ⅱ,为探究浓氨水对Cu的还原性或 氧化性的影响,该同学利用下图装置继续实验。
氧化性的影响,该同学利用下图装置继续实验。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加浓氨水后,电压减小了y。
c.继续向U型管左侧溶液中滴加浓氨水后,电压增大了z。
①从电极反应角度解释产生现象c的原因:___________ 。
②利用该方法也可证明酸性增强可提高 的氧化性,具体实验操作及现象是
的氧化性,具体实验操作及现象是___________ 。
(4)总结:从氧化还原半反应的角度总结物质氧化性和还原性变化的一般规律:___________ 。
(5)应用:Ag分别与 的盐酸、氢溴酸、氢碘酸混合,Ag只与氢碘酸发生置换反应,试根据所得规律解释原因
的盐酸、氢溴酸、氢碘酸混合,Ag只与氢碘酸发生置换反应,试根据所得规律解释原因___________ 。
 的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。【实验探究】
实验ⅰ:向装有0.5gCu的烧杯中加入20mL30%
 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。(1)①写出该化合反应的化学方程式:
②电极反应式:氧化反应:
 。
。【继续探究】
针对该反应较慢,小组同学查阅资料,设计并完成了下列实验。
| 装置 | 序号 | 试剂a | 现象 |
| ⅱ | 20mL30% 与4mL5mol/L 与4mL5mol/L 混合液 混合液 | Cu表面很快生成少量气泡,溶液逐渐变蓝,产生较多气泡 |
| ⅲ | 20mL30% 与4mL5mol/L氨水混合液 与4mL5mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(2)实验ⅱ中:溶液变蓝的原因是
(3)对比实验ⅰ和ⅱ,为探究浓氨水对Cu的还原性或
 氧化性的影响,该同学利用下图装置继续实验。
氧化性的影响,该同学利用下图装置继续实验。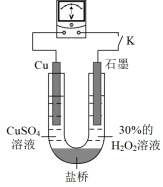
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加浓氨水后,电压减小了y。
c.继续向U型管左侧溶液中滴加浓氨水后,电压增大了z。
①从电极反应角度解释产生现象c的原因:
②利用该方法也可证明酸性增强可提高
 的氧化性,具体实验操作及现象是
的氧化性,具体实验操作及现象是(4)总结:从氧化还原半反应的角度总结物质氧化性和还原性变化的一般规律:
(5)应用:Ag分别与
 的盐酸、氢溴酸、氢碘酸混合,Ag只与氢碘酸发生置换反应,试根据所得规律解释原因
的盐酸、氢溴酸、氢碘酸混合,Ag只与氢碘酸发生置换反应,试根据所得规律解释原因
您最近一年使用:0次
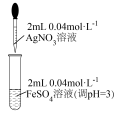
2 . 某小组同学欲探究AgNO3溶液与FeSO4溶液的反应,进行如表实验。
(1)根据Ksp(Ag2SO4)=1.2×10-5,推测试管底部的灰色沉淀中有Ag2SO4,写出生成Ag2SO4的离子方程式_______ 。
(2)取出少量灰黑色固体,洗涤后加入浓硝酸,沉淀溶解,产生红棕色气体,证明灰黑色固体中含有_______ 。
(3)依据“上层清液呈黄色”,推测上层清液中含有Fe3+
为进一步确认Fe3+的存在,该小组同学进行如表实验:
查阅资料:i.AgSCN为白色固体,Ksp(AgSCN)=1.03×10-12;
ii.Fe3++3SCN- Fe(SCN)3 K=2.24×103
Fe(SCN)3 K=2.24×103
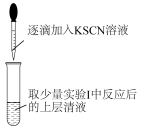
①实验II中,滴入KSCN后溶液先变红的原因是_______ 。
②稍振荡后红色消失并产生白色沉淀,请结合离子方程式解释现象:______ 。
(4)对Fe3+产生的原因做出如下假设,
假设a:溶液中Ag+具有氧化性,可将Fe2+氧化为Fe3+。
假设b:酸性溶液中硝酸根离子具有氧化性,可将Fe2+氧化为Fe3+;
假设c:空气中存在O2,可将Fe2+氧化为Fe3+。
①该小组同学进一步设计实验(填实验操作及现象)______ ,证实假设b、c不是产生Fe3+的主要原因。
②写出实验I中生成Fe3+的离子方程式_______ 。
(5)该小组同学査阅资料发现Ag+和Fe3+的氧化性差异不大,在一定条件下Ag+和Fe2+的反应是可逆反应,并用电化学装置进行验证,补全电化学装置示意图,写出操作及现象_______ 。
| 序号 | 实验操作 | 实验现象 |
| 实验I |
| 产生灰黑色沉淀,溶液变为黄色,数小时后,溶液颜色无变化,沉淀不增加 |
(1)根据Ksp(Ag2SO4)=1.2×10-5,推测试管底部的灰色沉淀中有Ag2SO4,写出生成Ag2SO4的离子方程式
(2)取出少量灰黑色固体,洗涤后加入浓硝酸,沉淀溶解,产生红棕色气体,证明灰黑色固体中含有
(3)依据“上层清液呈黄色”,推测上层清液中含有Fe3+
为进一步确认Fe3+的存在,该小组同学进行如表实验:
| 序号 | 实验操作 | 实验现象 |
| 实验II |
| 溶液先变红,稍振荡后红色消失,同时产生白色沉淀。 再次滴入KSCN溶液,上述现象再次出现。 |
ii.Fe3++3SCN-
 Fe(SCN)3 K=2.24×103
Fe(SCN)3 K=2.24×103①实验II中,滴入KSCN后溶液先变红的原因是
②稍振荡后红色消失并产生白色沉淀,请结合离子方程式解释现象:
(4)对Fe3+产生的原因做出如下假设,
假设a:溶液中Ag+具有氧化性,可将Fe2+氧化为Fe3+。
假设b:酸性溶液中硝酸根离子具有氧化性,可将Fe2+氧化为Fe3+;
假设c:空气中存在O2,可将Fe2+氧化为Fe3+。
①该小组同学进一步设计实验(填实验操作及现象)
②写出实验I中生成Fe3+的离子方程式
(5)该小组同学査阅资料发现Ag+和Fe3+的氧化性差异不大,在一定条件下Ag+和Fe2+的反应是可逆反应,并用电化学装置进行验证,补全电化学装置示意图,写出操作及现象
您最近一年使用:0次
名校
解题方法
3 . 某实验小组探究过量甲醛与新制氢氧化铜的反应。
提出猜想:
已知:ⅰ.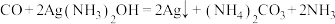
ⅱ.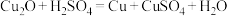
下列说法不正确 的是
提出猜想:

已知:ⅰ.
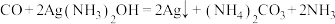
ⅱ.
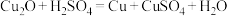

实验步骤 | 实验装置及内容 | 实验现象 |
步骤1 | 如上图装置 | 反应结束后,A中生成红色固体,C无明显变化 |
步骤2 | 将A中混合物过滤,洗涤所得固体,取少量固体于试管中,加入稀硫酸,振荡 | 无明显现象 |
步骤3 | 取步骤2中的滤液于试管中,加入足量稀盐酸 | 无明显现象 |
A.配制银氨溶液时,应向稀 溶液中加入稀氨水,至产生的沉淀恰好溶解 溶液中加入稀氨水,至产生的沉淀恰好溶解 |
B.步骤3目的是检验反应后溶液中是否存在 |
| C.装置B的主要作用是除去挥发的甲酸,防止干扰CO的检验 |
D.该实验中,过量甲醛与新制氢氧化铜可能发生的反应为: |
您最近一年使用:0次
2024-05-28更新
|
402次组卷
|
7卷引用:北京市东直门中学2023-2024学年高三下学期开学考化学试卷
北京市东直门中学2023-2024学年高三下学期开学考化学试卷2024届北京市中关村中学高三下学期化学学科练习(已下线)选择题6-10辽宁省沈阳市东北育才学校高中部2023-2024学年高二下学期第二次月考化学试题(已下线)暑假作业18 化学实验综合题-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)福建省厦门双十中学2023-2024学年高二下学期第二次月考化学试题北京市清华大学附属中学2023届高三三模化学试题
名校
解题方法
4 . 某兴趣小组的学生根据Mg与CO2反应的原理推测钠也能在CO2中燃烧,为了确定其产物并进行实验论证,某同学设计了下列装置进行实验(已知PdCl2能被CO还原为Pd),请回答下列问题:_______ (填字母)。
(2)检查装置的气密性完好并装好药品后,在点燃酒精灯前,应先进行装置1的操作,待装置_______ (填数字)中出现_______ 的现象时,再点燃酒精灯。
(3)①若装置6中有黑色沉淀(Pd)生成,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为_______ 。
②若装置6中无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为_______ 。
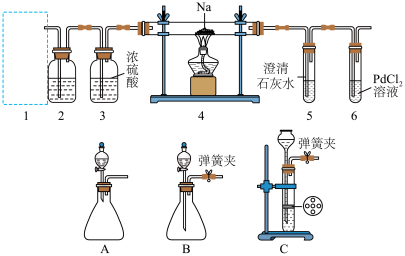
(2)检查装置的气密性完好并装好药品后,在点燃酒精灯前,应先进行装置1的操作,待装置
(3)①若装置6中有黑色沉淀(Pd)生成,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为
②若装置6中无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为
您最近一年使用:0次
名校
5 . 某小组设计了如下图所示的实验装置来探究过氧化钠的强氧化性。
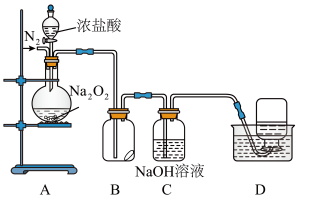
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接装置A、B、C。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
③待装置D中导管口产生连续气泡后,将导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,停止滴加浓盐酸,再通一段时间N2,直至装置中气体变为无色。
(1)装置D中收集的无色气体X能使带火星的木条复燃,据此推断该气体X为___________ (填化学式)。
(2)装置B中湿润的淀粉碘化钾试纸变蓝。
甲同学根据A中气体的颜色推测试纸变蓝时发生反应的离子方程式为___________ 。乙同学认为使试纸变蓝的原因也可能是___________ (填序号)。
a.挥发的HCl气体使试纸变蓝
b.在此实验过程中生成的X气体也能将I-氧化为I2
c.通入的N2使试纸变蓝
(3)Na2O2与干燥的HCl能发生化学反应生成Cl2、NaCl和H2O,该反应的化学方程式为___________ ,当反应生成标准状况下2.24L Cl2时,转移的电子数___________ mol。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接装置A、B、C。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
③待装置D中导管口产生连续气泡后,将导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,停止滴加浓盐酸,再通一段时间N2,直至装置中气体变为无色。
(1)装置D中收集的无色气体X能使带火星的木条复燃,据此推断该气体X为
(2)装置B中湿润的淀粉碘化钾试纸变蓝。
甲同学根据A中气体的颜色推测试纸变蓝时发生反应的离子方程式为
a.挥发的HCl气体使试纸变蓝
b.在此实验过程中生成的X气体也能将I-氧化为I2
c.通入的N2使试纸变蓝
(3)Na2O2与干燥的HCl能发生化学反应生成Cl2、NaCl和H2O,该反应的化学方程式为
您最近一年使用:0次
6 . 浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如图所示的实验,回答下列问题:___________ 。
(2)装置A中无水硫酸铜的作用为___________ 。
(3)装置B中的实验现象为___________ 。
(4)装置D中溶液不褪色,装置E中澄清石灰水变浑浊,证明产物中有___________ 。
(5)浓硝酸与木炭在加热条件下也可发生化学反应,对比分析下列实验,所得结论不正确的是___________。(已知:碎瓷片与浓硝酸不反应)
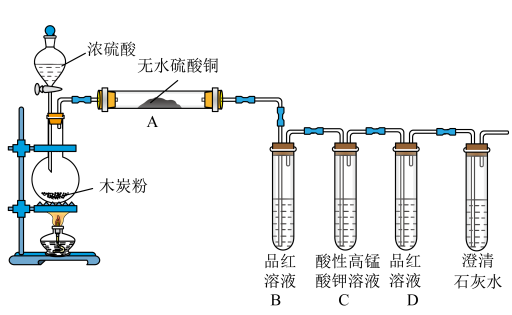
(2)装置A中无水硫酸铜的作用为
(3)装置B中的实验现象为
(4)装置D中溶液不褪色,装置E中澄清石灰水变浑浊,证明产物中有
(5)浓硝酸与木炭在加热条件下也可发生化学反应,对比分析下列实验,所得结论不正确的是___________。(已知:碎瓷片与浓硝酸不反应)

| A.试管①中产生红棕色气体,说明浓硝酸受热易分解 |
| B.试管②中产生红棕色气体,说明浓硝酸一定被木炭还原 |
C.试管③中产生红棕色气体,说明浓硝酸具有挥发性, 是氧化产物 是氧化产物 |
D.试管③的气体产物中检测出 ,说明木炭一定被浓硝酸氧化 ,说明木炭一定被浓硝酸氧化 |
您最近一年使用:0次
2024-07-02更新
|
57次组卷
|
2卷引用:江西省上饶市广丰一中2024-2025学年高三补习班上学期8月化学测试卷
解题方法
7 . 某同学为了探究某生铁(仅含C、Fe)与浓硫酸的反应并检验生成的气体的成分,设计了如图所示的实验装置(夹持仪器已省略)。回答下列问题:
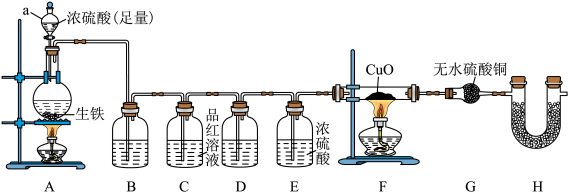
(1)仪器a的名称为___________ 。
(2)为验证并吸收SO2装置B中加入的试剂为___________ ,装置C中品红溶液的作用是___________ 。
(3)装置D的作用为___________ ,写出在加热条件下,C与浓H2SO4反应的化学方程式:___________
(4)若装置F和G亦有明显的现象,解释其原因___________ ;装置H中装有碱石灰,其作用是___________ 。
(5)待生铁(反应前为m g)完全溶解后,停止加热, 拆下装置D(装置中试剂足量并吸收完全)并称重。若装置D增重bg且装置C无明显变化,则生铁中铁的质量分数为___________ (用含m、b的表达式表示)。

(1)仪器a的名称为
(2)为验证并吸收SO2装置B中加入的试剂为
(3)装置D的作用为
(4)若装置F和G亦有明显的现象,解释其原因
(5)待生铁(反应前为m g)完全溶解后,停止加热, 拆下装置D(装置中试剂足量并吸收完全)并称重。若装置D增重bg且装置C无明显变化,则生铁中铁的质量分数为
您最近一年使用:0次
名校
8 . 自然界中含硫物质在一定条件下是可以相互转化的。某兴趣小组利用Na2SO3固体与70%的H2SO4溶液反应制取SO2气体,探究含硫物质在实验室里的转化,装置如下图。
(1)图中盛装硫酸的仪器名称为___________ ,装置A中发生化学反应的方程式为___________ 。
(2)装置C和E中的试剂作用相同,下列可选用的是___________(填字母)。
(3)关闭旋塞1,打开旋塞2,SO2进入装置D,可观察到的现象为___________ ,该现象可说明SO2具有___________ 性(选填“氧化”、“还原”或“氧化和还原”)。
(4)关闭旋塞2,打开旋塞1,将足量的SO2通入装置B中,有白色沉淀生成,该沉淀的化学式为___________ 。推测产生沉淀的原因可能是(不考虑空气的影响):
原因一:___________ ;
原因二:SO2在水溶液中被Fe3+氧化。
若原因二成立,请写出生成白色沉淀的离子方程式___________ 。
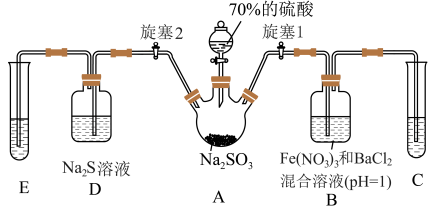
(1)图中盛装硫酸的仪器名称为
(2)装置C和E中的试剂作用相同,下列可选用的是___________(填字母)。
| A.NaOH溶液 | B.水 | C.氨水 | D.稀盐酸 |
(3)关闭旋塞1,打开旋塞2,SO2进入装置D,可观察到的现象为
(4)关闭旋塞2,打开旋塞1,将足量的SO2通入装置B中,有白色沉淀生成,该沉淀的化学式为
原因一:
原因二:SO2在水溶液中被Fe3+氧化。
若原因二成立,请写出生成白色沉淀的离子方程式
您最近一年使用:0次
2024-07-10更新
|
35次组卷
|
3卷引用:广西南宁市第八中学2024-2025学年高二上学期9月开学测试 化学试卷
名校
解题方法
9 . 实验小组设计图所示装置,验证 性质,对实验现象分析
性质,对实验现象分析不正确 的是
 性质,对实验现象分析
性质,对实验现象分析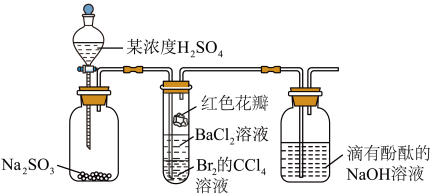
A.通入 一段时间后,试管内的 一段时间后,试管内的 溶液逐渐褪色,说明 溶液逐渐褪色,说明 具有还原性 具有还原性 |
B.一段时间后试管内有白色沉淀,说明 与 与 反应生成 反应生成 沉淀 沉淀 |
C.试管中的红色花瓣颜色变浅,说明 有漂白性 有漂白性 |
D.滴有酚酞的 溶液红色变浅,说明 溶液红色变浅,说明 能与碱溶液反应 能与碱溶液反应 |
您最近一年使用:0次
2024-01-27更新
|
336次组卷
|
3卷引用:北京市第四中学顺义分校2023-2024学年高三下学期3月开学考试化学试题
10 . 某化学实验小组同学为探究氯水的漂白性,设计了如图实验装置(夹持装置已略去)。
回答下列问题:
(1)装置Ⅰ中发生反应的化学方程式为 :
:
① 中
中 元素的化合价为
元素的化合价为_____ 。
②实验进行一段时间后,可观察到装置Ⅱ中的品红溶液褪色,其中 属于
属于_____ (填“酸”或“碱”)性氧化物。
③仪器 的名称为
的名称为_______ 。
④从其组成的阳离子来看, 属于
属于____ 盐。
(2)在装置Ⅳ和装置Ⅴ中:
①装置Ⅴ中发生反应的离子方程式为____ 。
②装置Ⅴ中可观察到的现象为____ 。
③实验进行一段时间后,可观察到装置Ⅳ中的品红溶液褪色,下列说法正确的是____ (填标号)。
A.起漂白作用的一定是
B.反应结束后,装置Ⅳ中溶液的 小于7
小于7
C.装置Ⅳ可能观察到 生成速率的快慢
生成速率的快慢
(3)装置Ⅲ中生成硫酸盐反应的化学方程式为______ 。

回答下列问题:
(1)装置Ⅰ中发生反应的化学方程式为
 :
:①
 中
中 元素的化合价为
元素的化合价为②实验进行一段时间后,可观察到装置Ⅱ中的品红溶液褪色,其中
 属于
属于③仪器
 的名称为
的名称为④从其组成的阳离子来看,
 属于
属于(2)在装置Ⅳ和装置Ⅴ中:
①装置Ⅴ中发生反应的离子方程式为
②装置Ⅴ中可观察到的现象为
③实验进行一段时间后,可观察到装置Ⅳ中的品红溶液褪色,下列说法正确的是
A.起漂白作用的一定是

B.反应结束后,装置Ⅳ中溶液的
 小于7
小于7C.装置Ⅳ可能观察到
 生成速率的快慢
生成速率的快慢(3)装置Ⅲ中生成硫酸盐反应的化学方程式为
您最近一年使用:0次
2024-04-26更新
|
25次组卷
|
2卷引用:湖南省岳阳市湘阴县知源高级中学等多校2023-2024学年高二下学期入学考试化学试题