解题方法
1 . 下图是工业生产纯碱的工艺流程示意图。
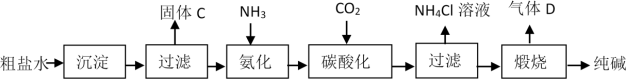
已知:①粗盐水中含有MgCl2、CaCl2;②常温下,NH3极易溶于水,CO2能溶于水,完成下列填空:
(1)粗盐水加入沉淀剂NaOH、___________ (填化学式)以分别除去MgCl2、CaCl2杂质,实验室过滤使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是___________ 。
(2)在工业生产纯碱工艺流程中,“碳酸化”时,NaCl、NH3、CO2和H2O相互作用析出NaHCO3,写出该反应的化学方程式___________ 。
(3)“煅烧”时,NaHCO3分解方程式是___________ 。
(4)鉴别产品纯碱中是否含有碳酸氢钠的方法是___________ 。

已知:①粗盐水中含有MgCl2、CaCl2;②常温下,NH3极易溶于水,CO2能溶于水,完成下列填空:
(1)粗盐水加入沉淀剂NaOH、
(2)在工业生产纯碱工艺流程中,“碳酸化”时,NaCl、NH3、CO2和H2O相互作用析出NaHCO3,写出该反应的化学方程式
(3)“煅烧”时,NaHCO3分解方程式是
(4)鉴别产品纯碱中是否含有碳酸氢钠的方法是
您最近一年使用:0次
名校
解题方法
2 . 实验室用 还原
还原 (沸点:31.85℃)制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是
(沸点:31.85℃)制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是

 还原
还原 (沸点:31.85℃)制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是
(沸点:31.85℃)制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是
| A.装置Ⅱ、Ⅲ中依次盛装的是浓硫酸、冰水 |
| B.实验时,应先加热管式炉,再打开活塞K |
| C.为鉴定制得硅中是否含有微量铁单质,需要用到的试剂为盐酸、双氧水、KSCN溶液 |
D.该实验中制备氢气的装置也可用于硫酸与 反应制备 反应制备 |
您最近一年使用:0次
2024-02-10更新
|
432次组卷
|
2卷引用:浙江省杭州学军中学2023-2024学年高一上学期期末模拟考试化学试卷
名校
解题方法
3 . 纳米铁可用于制作高密度磁性材料。以铁屑(含少量 杂质)为原料制备纳米铁粉流程如下:
杂质)为原料制备纳米铁粉流程如下: 是一种二元酸
是一种二元酸
(1)“酸溶”过程中可以加快反应速率和提高浸出率的方法有_______ 。(写出两种)。
(2)写出“酸溶”时氧化还原反应的离子方程式:_______ 、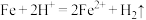 。
。
(3) 固体经灼烧后得到红棕色固体和
固体经灼烧后得到红棕色固体和 混合气体,若产物中
混合气体,若产物中 ,则“灼烧”过程中发生反应的化学方程式为
,则“灼烧”过程中发生反应的化学方程式为_______ 。
(4)取少量产品分散于水中,_______ (填操作步骤),可验证所得铁粉直径是否为纳米级
(5)纳米铁粉可用于处理含氧酸性废水中的 ,反应原理如图所示。
,反应原理如图所示。 的去除,原因是
的去除,原因是_______ 。
②该过程中体现了纳米铁粉的_______ 性(填“氧化”或“还原”)。
 杂质)为原料制备纳米铁粉流程如下:
杂质)为原料制备纳米铁粉流程如下:
 是一种二元酸
是一种二元酸(1)“酸溶”过程中可以加快反应速率和提高浸出率的方法有
(2)写出“酸溶”时氧化还原反应的离子方程式:
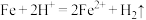 。
。(3)
 固体经灼烧后得到红棕色固体和
固体经灼烧后得到红棕色固体和 混合气体,若产物中
混合气体,若产物中 ,则“灼烧”过程中发生反应的化学方程式为
,则“灼烧”过程中发生反应的化学方程式为(4)取少量产品分散于水中,
(5)纳米铁粉可用于处理含氧酸性废水中的
 ,反应原理如图所示。
,反应原理如图所示。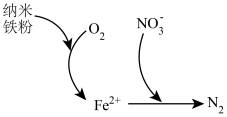
 的去除,原因是
的去除,原因是②该过程中体现了纳米铁粉的
您最近一年使用:0次
名校
解题方法
4 . 某同学通过如下流程制备氧化亚铜:

已知:CuCl难溶于水和稀硫酸;Cu2O+2H+=Cu2++Cu+H2O
下列说法不正确 的是

已知:CuCl难溶于水和稀硫酸;Cu2O+2H+=Cu2++Cu+H2O
下列说法
| A.步骤②中的SO2可用Na2SO3替换 |
| B.步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤 |
C.步骤④发生反应的离子方程式为2CuCl+2OHˉ Cu2O+2Clˉ+H2O Cu2O+2Clˉ+H2O |
| D.检验Cu2O试样中是否混有CuO杂质,可在试样中加入足量稀硫酸,若溶液变蓝色,则证明试样中含有CuO |
您最近一年使用:0次
名校
解题方法
5 . 高铁酸钾( )是一种高效的水处理剂,实验室制备
)是一种高效的水处理剂,实验室制备 的装置如图所示。(夹持装置略去)
的装置如图所示。(夹持装置略去)

查阅 资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成
资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成 和
和 。④KOH溶于醇,微溶于乙醚。
。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,盛放 的仪器名称是
的仪器名称是___________ ,盛放浓盐酸的仪器名称是___________ ,玻璃管的作用是___________ 。
(2)装置B中盛放的试剂是___________ 。
(3)装置C中生成 的离子方程式为
的离子方程式为___________ 。
(4)以下说法正确的是___________。
(5)装置D的作用是(用离子方程式说明)___________ 。
 )是一种高效的水处理剂,实验室制备
)是一种高效的水处理剂,实验室制备 的装置如图所示。(夹持装置略去)
的装置如图所示。(夹持装置略去)
查阅
 资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成
资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成 和
和 。④KOH溶于醇,微溶于乙醚。
。④KOH溶于醇,微溶于乙醚。回答下列问题:
(1)装置A为氯气发生装置,盛放
 的仪器名称是
的仪器名称是(2)装置B中盛放的试剂是
(3)装置C中生成
 的离子方程式为
的离子方程式为(4)以下说法正确的是___________。
A.装置C中KOH溶液过量的目的是 在碱性环境中能稳定存在。 在碱性环境中能稳定存在。 |
| B.搅拌操作,既可以防止因局部溶液碱性减弱,又可以使反应物充分接触,加快反应速率 |
C.该反应放热,不利于 固体析出,将装置C放入冰水浴中进行改进 固体析出,将装置C放入冰水浴中进行改进 |
D. 在水处理中仅起到净水作用 在水处理中仅起到净水作用 |
(5)装置D的作用是(用离子方程式说明)
您最近一年使用:0次
6 . 实验室为制备和收集少量干燥、纯净的氯气,选用如图所示仪器及药品:

(1)上述实验中,用来盛放浓盐酸的仪器的名称是___________ ,
(2)制取氯气的离子反应方程式为___________ 。
(3)选择上述仪器并按顺序连接(填各接口处的字母):a→___________ →k→g→i。
(4)如图是一组探究氯气性质的装置。

现关闭活塞K,若有色布条是干燥的,溶液A为浓硫酸,则有色布条___________ (填现象,下同)。
(5)现打开K,溶液A为氢氧化钠溶液,通入的氯气是湿润的,布条是干燥的,则有色布条___________ 。
(6)使用氯气消毒易产生危害人体健康的有机氯化物。用氯气和亚氯酸钠(NaClO2)溶液可制备新的绿色消毒剂二氧化氯(ClO2),反应中还可得到氯化钠。该反应的化学方程式为___________ 。
(7)若用含0.2molHCl的浓盐酸与足量的MnO2反应制取Cl2,制得Cl2体积___________ (填“>”“<”或“=”)1.12L(标准状况)。

(1)上述实验中,用来盛放浓盐酸的仪器的名称是
(2)制取氯气的离子反应方程式为
(3)选择上述仪器并按顺序连接(填各接口处的字母):a→
(4)如图是一组探究氯气性质的装置。

现关闭活塞K,若有色布条是干燥的,溶液A为浓硫酸,则有色布条
(5)现打开K,溶液A为氢氧化钠溶液,通入的氯气是湿润的,布条是干燥的,则有色布条
(6)使用氯气消毒易产生危害人体健康的有机氯化物。用氯气和亚氯酸钠(NaClO2)溶液可制备新的绿色消毒剂二氧化氯(ClO2),反应中还可得到氯化钠。该反应的化学方程式为
(7)若用含0.2molHCl的浓盐酸与足量的MnO2反应制取Cl2,制得Cl2体积
您最近一年使用:0次
解题方法
7 . 某兴趣小组在实验室用下图装置(夹持仪器已省略)制备无水FeCl3。

已知:FeCl3易潮解,300℃左右升华。请回答:
(1)虚框中仪器b的名称___________ ;
(2)装置A制备Cl2的化学方程式___________ ;装置B中的试剂是___________ 。
(3)实验开始时,应先点燃装置___________ 处酒精灯(填“A或D”),目的是___________ 。
(4)将上图组装完整,上图虚框中应选用___________ (填“a或b”),其作用是___________ 。
(5)反应结束后,某同学设计了以下实验来探究硬质玻璃管中固体成分,你认为正确的是_______ 。
A.取少量固体溶于水,若全部溶解,则说明无铁残留
B.取少量固体溶于水,若不能完全溶解,则说明有铁残留
C.取少量固体溶于足量的盐酸,先滴加3滴KSCN溶液,若溶液呈血红色,则说明只有氯化铁残留

已知:FeCl3易潮解,300℃左右升华。请回答:
(1)虚框中仪器b的名称
(2)装置A制备Cl2的化学方程式
(3)实验开始时,应先点燃装置
(4)将上图组装完整,上图虚框中应选用
(5)反应结束后,某同学设计了以下实验来探究硬质玻璃管中固体成分,你认为正确的是
A.取少量固体溶于水,若全部溶解,则说明无铁残留
B.取少量固体溶于水,若不能完全溶解,则说明有铁残留
C.取少量固体溶于足量的盐酸,先滴加3滴KSCN溶液,若溶液呈血红色,则说明只有氯化铁残留
您最近一年使用:0次
8 . FeCl3能用于金属蚀刻、污水处理、印染工业。某化学研究性学习小组模拟工业生产流程制备氯化铁并对产物做如下探究实验(部分夹持装置省略)。

已知:三氯化铁易升华,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。
(1)A中装浓HCl的仪器名称___________ ,D中装碱石灰的仪器名称___________ 。
(2)实验中制取氯气的离子方程式为___________ 。
(3)装置的连接顺序为:a→_________ →f。
(4)实验结束时,先移走_________ (选“A”或“B”)处的酒精灯。
(5)碱石灰的作用是___________ 。
(6)实验结束并冷却后,将收集器中的固体物质转移至锥形瓶中,进行如下实验:

用离子方程式表示淡红色溶液中加入过量H2O2后,溶液颜色变深的原因有:
a:____________________ ;
b:

已知:三氯化铁易升华,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。
(1)A中装浓HCl的仪器名称
(2)实验中制取氯气的离子方程式为
(3)装置的连接顺序为:a→
(4)实验结束时,先移走
(5)碱石灰的作用是
(6)实验结束并冷却后,将收集器中的固体物质转移至锥形瓶中,进行如下实验:

用离子方程式表示淡红色溶液中加入过量H2O2后,溶液颜色变深的原因有:
a:
b:

您最近一年使用:0次
名校
9 . 我国力争2060年前实现碳中和,利用NaOH溶液按如下流程捕捉回收CO2可以减少碳排放。
(1)下列说法正确的是___________。
(2)研究表明一水草酸钙(CaC2O4·H2O)热分解制得的CaO疏松多孔也可以捕捉回收CO2,写出一水草酸钙分解的反应方程式___________ 。
(3)工业上利用捕捉到的CO2可以制备Na2CO3,工艺流程图如下:___________ 。
②产品Na2CO3中含有NaHCO3,下列方案中不能测定Na2CO3质量分数的是___________ 。
A.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到b克固体
B.取a克混合物与足量稀盐酸充分反应,逸出气体用碱石灰吸收,质量增加b克
C.取a克混合物与足量NaOH溶液充分反应,加热、蒸干、灼烧,得到b克固体
D.取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
③产品Na2CO3中含有NaHCO3,如果用加热分解的方法测定产品中碳酸氢钠的质量分数。加热质量为m1g的该产品,最终测得剩余固体质量为m2g。则产品中碳酸氢钠的质量百分数可表示为___________ (用字母m1和m2表示)。
(4)实验室探究钠与CO2反应的过程中,发现钠在CO2中剧烈燃烧,并产生大量白烟和黑色固体,写出可能发生反应的方程式___________ 。

(1)下列说法正确的是___________。
| A.为了充分吸收CO2,捕捉室中NaOH溶液常喷成雾状 |
| B.捕捉室中反应生成的产物为Na2CO3 |
| C.整个过程中,发生的化学反应无氧化还原反应 |
| D.整个过程中,可以循环利用的物质只有CaO |
(2)研究表明一水草酸钙(CaC2O4·H2O)热分解制得的CaO疏松多孔也可以捕捉回收CO2,写出一水草酸钙分解的反应方程式
(3)工业上利用捕捉到的CO2可以制备Na2CO3,工艺流程图如下:

②产品Na2CO3中含有NaHCO3,下列方案中不能测定Na2CO3质量分数的是
A.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到b克固体
B.取a克混合物与足量稀盐酸充分反应,逸出气体用碱石灰吸收,质量增加b克
C.取a克混合物与足量NaOH溶液充分反应,加热、蒸干、灼烧,得到b克固体
D.取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
③产品Na2CO3中含有NaHCO3,如果用加热分解的方法测定产品中碳酸氢钠的质量分数。加热质量为m1g的该产品,最终测得剩余固体质量为m2g。则产品中碳酸氢钠的质量百分数可表示为
(4)实验室探究钠与CO2反应的过程中,发现钠在CO2中剧烈燃烧,并产生大量白烟和黑色固体,写出可能发生反应的方程式
您最近一年使用:0次
2023-10-07更新
|
74次组卷
|
2卷引用:浙江省杭州市四校2023-2024学年高一上学期10月联考化学试题
名校
解题方法
10 . 甘氨酸亚铁[(H2NCH2COO)2Fe,摩尔质量204g/mol]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组模拟其合成方法如下:
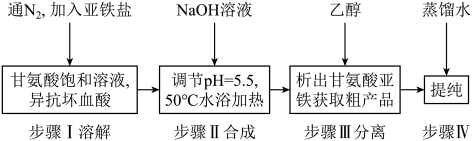
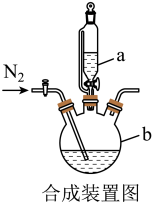
已知:
请回答:
(1)下列说法正确的是___________。
(2)合成过程中,本实验为了防止Fe2+被氧化,采取的措施是___________ 。
(3)合成过程需控制pH=5.5,pH过大或过小都对实验有影响,试说明理由___________ 。
(4)步骤Ⅲ加入无水乙醇的目的是___________ 。
(5)若甘氨酸的投料量为300kg,得到纯品306kg,则产品的产率为___________ 。


已知:
| 甘氨酸H2NCH2COOH | 异抗坏血酸 | 甘氨酸亚铁 | FeSO4·7H2O | FeCl2·4H2O |
| 易溶于水微溶于乙醇 | 易溶于水和乙醇有弱酸性和强环原性 | 易溶于水难溶于乙醇 | 易溶于水难溶于乙醇 | 易溶于水易溶于乙醇 |
(1)下列说法正确的是___________。
| A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞 |
| B.根据题中所给信息,亚铁盐应选用FeSO4·7H2O |
| C.步骤Ⅲ中的分离方法是过滤 |
| D.步骤Ⅳ,提纯操作中的干燥过程最好选用真空干燥 |
(3)合成过程需控制pH=5.5,pH过大或过小都对实验有影响,试说明理由
(4)步骤Ⅲ加入无水乙醇的目的是
(5)若甘氨酸的投料量为300kg,得到纯品306kg,则产品的产率为
您最近一年使用:0次



