1 . K2FeO4为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
(1)高铁酸钾(K2FeO4,M=198g/mol)是一种高效多功能的绿色消毒剂,用途广泛。在用高铁酸钾(K2FeO4)进行水处理时,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4属于_______ (填“酸”、“碱”或“盐”)。
②现取49.5g某高铁酸钾样品完全发生上述反应,生成标准状况下3.36LO2,则反应中转移了_______ mole-,该高铁酸钾样品的纯度为_______ 。(用质量分数表示)
③高铁酸钾可用于消毒的原因是_______ 。
K2FeO4的制备常用两种方法:
I.湿法制备K2FeO4(夹持装置略)

(2)下列试剂中,装置B的X溶液可以选用的_______(填字母)。
(3)C中Cl2与Fe(OH)3及KOH发生反应的化学方程式是_______ 。
II.干法制备高铁酸钾分两步进行。
(4)第一步反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2SO4+2Na2O+O2,第二步反应为:Na2FeO4+2KCl=K2FeO4↓+2NaCl。其中第一步该反应中还原剂是_______ ;
(1)高铁酸钾(K2FeO4,M=198g/mol)是一种高效多功能的绿色消毒剂,用途广泛。在用高铁酸钾(K2FeO4)进行水处理时,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4属于
②现取49.5g某高铁酸钾样品完全发生上述反应,生成标准状况下3.36LO2,则反应中转移了
③高铁酸钾可用于消毒的原因是
K2FeO4的制备常用两种方法:
I.湿法制备K2FeO4(夹持装置略)

(2)下列试剂中,装置B的X溶液可以选用的_______(填字母)。
| A.饱和食盐水 | B.浓盐酸 | C.氢氧化钠溶液 | D.饱和NaHCO3溶液 |
(3)C中Cl2与Fe(OH)3及KOH发生反应的化学方程式是
II.干法制备高铁酸钾分两步进行。
(4)第一步反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2SO4+2Na2O+O2,第二步反应为:Na2FeO4+2KCl=K2FeO4↓+2NaCl。其中第一步该反应中还原剂是
您最近一年使用:0次
名校
解题方法
2 . 碳酸亚铁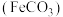 难溶于水,常用于制取铁或补血剂。一种
难溶于水,常用于制取铁或补血剂。一种 的制备装置如下图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得
的制备装置如下图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得 沉淀。
沉淀。
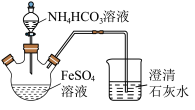
(1)恰好完全反应后,检验三颈烧瓶内溶液中阳离子的方法是___________ 。
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是___________ 。
(3) 在潮湿的空气中先转化为
在潮湿的空气中先转化为 ,最终变为
,最终变为 ,并进一步转化为
,并进一步转化为 。写出
。写出 在潮湿的空气中转化为
在潮湿的空气中转化为 的化学方程式:
的化学方程式:___________ 。
(4)某 固体被部分氧化,为测定其中
固体被部分氧化,为测定其中 的质量分数,现进行如下实验:称取
的质量分数,现进行如下实验:称取 固体样品,加足量盐酸充分溶解,将溶液稀释至
固体样品,加足量盐酸充分溶解,将溶液稀释至 。量取
。量取 该溶液,加入
该溶液,加入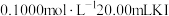 溶液,两者正好完全反应。已知实验过程中发生反应如下:
溶液,两者正好完全反应。已知实验过程中发生反应如下: 。计算
。计算 固体样品中
固体样品中 的质量分数,写出计算过程
的质量分数,写出计算过程___________ 。
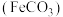 难溶于水,常用于制取铁或补血剂。一种
难溶于水,常用于制取铁或补血剂。一种 的制备装置如下图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得
的制备装置如下图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得 沉淀。
沉淀。
(1)恰好完全反应后,检验三颈烧瓶内溶液中阳离子的方法是
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是
(3)
 在潮湿的空气中先转化为
在潮湿的空气中先转化为 ,最终变为
,最终变为 ,并进一步转化为
,并进一步转化为 。写出
。写出 在潮湿的空气中转化为
在潮湿的空气中转化为 的化学方程式:
的化学方程式:(4)某
 固体被部分氧化,为测定其中
固体被部分氧化,为测定其中 的质量分数,现进行如下实验:称取
的质量分数,现进行如下实验:称取 固体样品,加足量盐酸充分溶解,将溶液稀释至
固体样品,加足量盐酸充分溶解,将溶液稀释至 。量取
。量取 该溶液,加入
该溶液,加入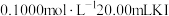 溶液,两者正好完全反应。已知实验过程中发生反应如下:
溶液,两者正好完全反应。已知实验过程中发生反应如下: 。计算
。计算 固体样品中
固体样品中 的质量分数,写出计算过程
的质量分数,写出计算过程
您最近一年使用:0次
名校
解题方法
3 . 二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如图,其中反应Ⅲ制取ClO2的化学方程式为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。

(1)试剂X是____ (填化学式)。
(2)NaOH及试剂X均需过量的原因是____ 。
(3)反应Ⅲ,若生成67.5gClO2,转移电子的物质的量为____ 。
(4)用ClO2处理过的饮用水常含有一定量有害的ClO2。我国规定饮用水中ClO2的含量在0.1~0.8mg·L-1。测定水样中ClO2的含量的过程如下:
①量取25.00mL水样加入锥形瓶中,并调节水样的pH为7.0~8.0。
②加入足量的KI晶体。此过程发生反应2ClO2+2I-=2ClO +I2。
+I2。
③加入少量淀粉溶液,再向上述溶液中滴加1.00×10-3mol·L-1Na2S2O3溶液至溶液蓝色刚好褪去,消耗Na2S2O3溶液7.45mL。此过程发生反应:2S2O +I2=S4O
+I2=S4O +2I-。
+2I-。
根据上述数据计算并判断该水样中ClO2的含量是否符合国家规定____ 。(请写出计算过程)

(1)试剂X是
(2)NaOH及试剂X均需过量的原因是
(3)反应Ⅲ,若生成67.5gClO2,转移电子的物质的量为
(4)用ClO2处理过的饮用水常含有一定量有害的ClO2。我国规定饮用水中ClO2的含量在0.1~0.8mg·L-1。测定水样中ClO2的含量的过程如下:
①量取25.00mL水样加入锥形瓶中,并调节水样的pH为7.0~8.0。
②加入足量的KI晶体。此过程发生反应2ClO2+2I-=2ClO
 +I2。
+I2。③加入少量淀粉溶液,再向上述溶液中滴加1.00×10-3mol·L-1Na2S2O3溶液至溶液蓝色刚好褪去,消耗Na2S2O3溶液7.45mL。此过程发生反应:2S2O
 +I2=S4O
+I2=S4O +2I-。
+2I-。根据上述数据计算并判断该水样中ClO2的含量是否符合国家规定
您最近一年使用:0次
名校
4 . 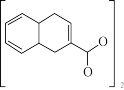 Co21(环烷酸钴)性质稳定,可作不饱和聚酯树脂固化的促进剂,作某些氧化反应的催化剂。实验室以金属钴、环烷酸为原料制备环烷酸钴。
Co21(环烷酸钴)性质稳定,可作不饱和聚酯树脂固化的促进剂,作某些氧化反应的催化剂。实验室以金属钴、环烷酸为原料制备环烷酸钴。
I.氯化钴的制备(以稀硝酸为催化剂)
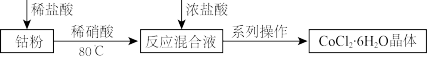
(1)加入浓盐酸的目的是____ 。
(2)基态钴原子核外电子占据的轨道总数为___ ,Co2+核外有____ 种运动状态不同的电子。
II.环烷酸钴的制备
控制温度在90~95℃,向环烷酸的水溶液中滴入一定浓度的NaOH溶液,反应约2h后,再加入一定浓度的CoCl2溶液进行反应,得到含有环烷酸钴粗产品的水溶液,经分离提纯得环烷酸钴产品。
(3)实验中应选____ (填“A”或“B”)装置,理由是____ 。
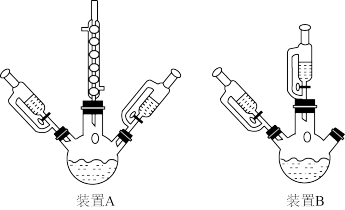
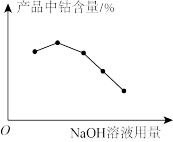
(4)实验中NaOH溶液的用量对产品中钴含量的影响如图所示,试分析NaOH溶液过量会导致产品中钴含量降低的可能原因:____ 。
III.环烷酸钴产品中钴含量的测定
准确称取7.00g环烷酸钴产品,配成250mL水溶液(经处理Co元素全部以Co2+的形式存在),取该溶液25.00mL,在pH为10的氨性介质中,加入0.0500mol·L-1的EDTA标准溶液25.00mL。充分反应后,以铬黑T为指示剂,用0.0500mol·L-1锌标准溶液滴定过量的EDTA,消耗锌标准溶液5.00mL。
已知:EDTA可与二价金属离子以1:1形成稳定络合物。
(5)下列操作会引起测量结果偏低的是____ (填字母)。
(6)上述环烷酸钴产品中钴的百分含量是多少____ ?(写出计算过程,结果保留3位有效数字)
 Co21(环烷酸钴)性质稳定,可作不饱和聚酯树脂固化的促进剂,作某些氧化反应的催化剂。实验室以金属钴、环烷酸为原料制备环烷酸钴。
Co21(环烷酸钴)性质稳定,可作不饱和聚酯树脂固化的促进剂,作某些氧化反应的催化剂。实验室以金属钴、环烷酸为原料制备环烷酸钴。I.氯化钴的制备(以稀硝酸为催化剂)
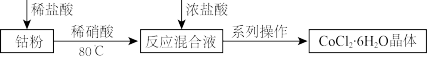
(1)加入浓盐酸的目的是
(2)基态钴原子核外电子占据的轨道总数为
II.环烷酸钴的制备
控制温度在90~95℃,向环烷酸的水溶液中滴入一定浓度的NaOH溶液,反应约2h后,再加入一定浓度的CoCl2溶液进行反应,得到含有环烷酸钴粗产品的水溶液,经分离提纯得环烷酸钴产品。
(3)实验中应选

(4)实验中NaOH溶液的用量对产品中钴含量的影响如图所示,试分析NaOH溶液过量会导致产品中钴含量降低的可能原因:

III.环烷酸钴产品中钴含量的测定
准确称取7.00g环烷酸钴产品,配成250mL水溶液(经处理Co元素全部以Co2+的形式存在),取该溶液25.00mL,在pH为10的氨性介质中,加入0.0500mol·L-1的EDTA标准溶液25.00mL。充分反应后,以铬黑T为指示剂,用0.0500mol·L-1锌标准溶液滴定过量的EDTA,消耗锌标准溶液5.00mL。
已知:EDTA可与二价金属离子以1:1形成稳定络合物。
(5)下列操作会引起测量结果偏低的是
| A.锥形瓶洗涤后未干燥 |
| B.滴定前平视读数,滴定后俯视读数 |
| C.滴定前滴定管尖嘴部分有气泡,滴定后无气泡 |
| D.滴定管未用待装液润洗 |
您最近一年使用:0次
名校
解题方法
5 . 某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(NaNO2),并对其进行纯度测定和相关性质的实验。
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是___ (填元素符号)。此时SO2从底部通入,硝酸从顶部以雾状喷下,其目的是___ 。
(2)若使“吸收”步骤中NOX完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为___ 。
(3)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00mL0.100mol·L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL0.100mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。(NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2)
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度___ (“偏大”、“偏小”或“无影响”),原因是___ 。
②通过计算,该样品中NaNO2的质量分数是___ ,可能含有的杂质有___ (写出其中一种即可)。
(4)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是___ 。

Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是
(2)若使“吸收”步骤中NOX完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为
(3)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00mL0.100mol·L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL0.100mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。(NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2)
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度
②通过计算,该样品中NaNO2的质量分数是
(4)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是
您最近一年使用:0次
2020-06-05更新
|
126次组卷
|
3卷引用:【市级联考】江苏省高邮市2018-2019学年高一下学期期中考试调研(选修)化学试题



