名校
解题方法
1 . 亚硝酸钠(NaNO2)是一种工业盐,实验室可用如图装置(略去部分夹持仪器)制备。

已知:
① ;
;
② ;
;
③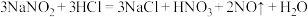 ;
;
④酸性条件下,NO和 都能与
都能与 反应生成
反应生成 和
和 ;
; 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是_______ ;
(2)装置A中发生反应的化学方程式为_______ ;
(3)实验结束后,B瓶溶液中溶质的主要成分是_______ (填化学式)。
(4)仪器C中盛放的药品为_______ (填名称)。
(5)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,_______ ,则产物是NaNO2 (注明试剂、现象)。
(6)装置F的作用是_______ ;
(7)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,再向锥形瓶中加入0.1000molL酸性KMnO4溶液20.00mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数_______ 。(写出计算过程)

已知:
①
 ;
;②
 ;
;③
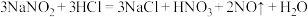 ;
;④酸性条件下,NO和
 都能与
都能与 反应生成
反应生成 和
和 ;
; 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。(1)加热装置A前,先通一段时间N2,目的是
(2)装置A中发生反应的化学方程式为
(3)实验结束后,B瓶溶液中溶质的主要成分是
(4)仪器C中盛放的药品为
(5)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,
(6)装置F的作用是
(7)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,再向锥形瓶中加入0.1000molL酸性KMnO4溶液20.00mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数
您最近一年使用:0次
2021-04-28更新
|
449次组卷
|
4卷引用:江苏省常熟市2020-2021学年高一下学期期中化学试题
名校
2 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。
已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。
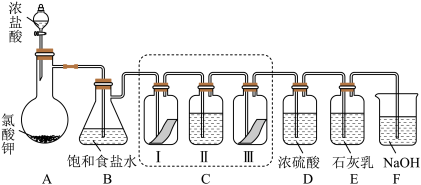
(1)用“双线桥”标出A中反应电子转移的方向和数目_______ 。
(2)B装置作用_______ 。
(3)装置C的目的是验证氯气是否有漂白性,C中I、II、III依次放入的物质正确的是_______ (填编号)。
(4)为测定所得漂白粉的有效成分含量。称取ag漂白粉样品溶解,往所得溶液中通入 CO2至产生沉淀最大值时,该过程的化学方程式为_______ ,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成份的质量分数为_______ (用含a、b的式子表示)。
已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)用“双线桥”标出A中反应电子转移的方向和数目
(2)B装置作用
(3)装置C的目的是验证氯气是否有漂白性,C中I、II、III依次放入的物质正确的是
| 编号 | I | II | III |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
您最近一年使用:0次
解题方法
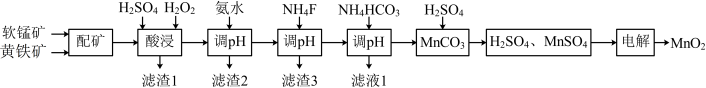
3 . 高品质MnO2可用于生产锂离子电池正极材料锰酸锂。以软锰矿与黄铁矿为主要原料采用“两矿一步浸出法”制备高品质MnO2的某工艺流程如图所示:
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下:
回答下列问题:
(1)“酸浸”操作中需先后分批加入H2SO4、H2O2。加入H2SO4后发生酸浸过程的主要反应离子方程式为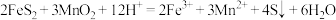 ,
,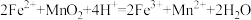 。
。
已知滤渣1的主要成分为S、SiO2、CaSO4等,其附着在矿粉颗粒表面使上述反应受阻,此时加入H2O2,利用其迅速分解产生的大量气泡可破除该不利影响。分析导致H2O2迅速分解的因素是____ 。
(2)加氨水“调pH”时调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为____ (填化学式)。
(3)加NH4F“调pH”时,溶液体系中的Ca2+和Mg2+形成氟化物沉淀。
①若沉淀后上层清液中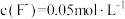 ,则
,则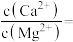
____ 。
②可以用MnF2代替NH4F,以Mg2+为例,结合反应的平衡常数解释能用MnF2除去Mg2+(和Ca2+)的原因是____ 。
(已知:Ksp(MnF2)=5×10-3,Ksp(MgF2)=5×10-11,Ksp(CaF2)=2.5×10-9)
(4)NH4HCO3“调pH”时,发生主要反应的离子方程式为____ 。
(5)利用惰性电极电解H2SO4—MnSO4—H2O体系获得MnO2的机理(部分)如图1所示,硫酸浓度与电流效率的关系如图2所示。硫酸浓度超过3.0 mol·L−1时,电流效率降低的原因是____ 。 +I2=2I-+
+I2=2I-+ ,计算粗品中MnO2的质量分数
,计算粗品中MnO2的质量分数_______ (写出计算过程)。
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下:
| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 6.9 | 1.9 | 6.6 | 9.1 | 3.4 |
沉淀完全(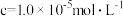 )的pH )的pH | 8.3 | 3.2 | 10.1 | 10.9 | 4.7 |
(1)“酸浸”操作中需先后分批加入H2SO4、H2O2。加入H2SO4后发生酸浸过程的主要反应离子方程式为
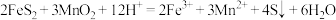 ,
,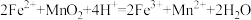 。
。已知滤渣1的主要成分为S、SiO2、CaSO4等,其附着在矿粉颗粒表面使上述反应受阻,此时加入H2O2,利用其迅速分解产生的大量气泡可破除该不利影响。分析导致H2O2迅速分解的因素是
(2)加氨水“调pH”时调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为
(3)加NH4F“调pH”时,溶液体系中的Ca2+和Mg2+形成氟化物沉淀。
①若沉淀后上层清液中
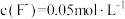 ,则
,则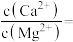
②可以用MnF2代替NH4F,以Mg2+为例,结合反应的平衡常数解释能用MnF2除去Mg2+(和Ca2+)的原因是
(已知:Ksp(MnF2)=5×10-3,Ksp(MgF2)=5×10-11,Ksp(CaF2)=2.5×10-9)
(4)NH4HCO3“调pH”时,发生主要反应的离子方程式为
(5)利用惰性电极电解H2SO4—MnSO4—H2O体系获得MnO2的机理(部分)如图1所示,硫酸浓度与电流效率的关系如图2所示。硫酸浓度超过3.0 mol·L−1时,电流效率降低的原因是
 +I2=2I-+
+I2=2I-+ ,计算粗品中MnO2的质量分数
,计算粗品中MnO2的质量分数
您最近一年使用:0次
名校
4 . 以黄铁矿(主要成分FeS2))为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如下图所示。
(1)煅烧前,黄铁矿需要研磨,目的是___________ 。
(2)煅烧黄铁矿的化学方程式是___________ 。
(3)过程①中处理尾气SO2的离子反应方程式为___________ 。
(4)已知1molSO2(g) 完全转化为1molSO3(g) 放热99kJ,写出SO2催化氧化的热化学方程式___________ 。
(5)因为Na2S2O5在保存过程中易被氧化,导致商品Na2S2O5中存在Na2SO4.欲检验Na2S2O5已变质的实验方法为___________ 。
(6)一般用K2Cr2O7滴定分析法测定还原铁粉的纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应方程式为(方程式未配平):
Cr2O72-+Fe2++H+→Cr3++Fe3++H2O。某次实验称取0.2800g样品,滴定时消耗浓度为0.0300mol/L的K2Cr2O7溶液25.00mL,则样品中铁的质量分数为___________ 。(请写出计算过程)

(1)煅烧前,黄铁矿需要研磨,目的是
(2)煅烧黄铁矿的化学方程式是
(3)过程①中处理尾气SO2的离子反应方程式为
(4)已知1molSO2(g) 完全转化为1molSO3(g) 放热99kJ,写出SO2催化氧化的热化学方程式
(5)因为Na2S2O5在保存过程中易被氧化,导致商品Na2S2O5中存在Na2SO4.欲检验Na2S2O5已变质的实验方法为
(6)一般用K2Cr2O7滴定分析法测定还原铁粉的纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应方程式为(方程式未配平):
Cr2O72-+Fe2++H+→Cr3++Fe3++H2O。某次实验称取0.2800g样品,滴定时消耗浓度为0.0300mol/L的K2Cr2O7溶液25.00mL,则样品中铁的质量分数为
您最近一年使用:0次
5 . 连二亚硫酸钠(Na2S2O4)广泛应用于造纸等行业。Na2S2O4易被氧化,129℃时分解,在碱性条件下较稳定,易溶于水,不溶于乙醇。
实验室用NaBH4碱性溶液和NaHSO3酸性溶液制取Na2S2O4,实验室制备装置如图1所示。

(1)实验前需打开K通入一段时间氮气,其目的是___________ 。
(2)在10℃~35℃下,向盛有一定浓度的NaHSO3溶液容器中滴加NaBH4溶液,生成Na2S2O4和NaBO2,制备Na2S2O4的化学方程式为___________ 。
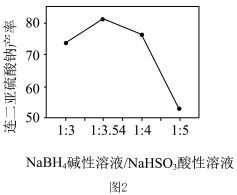
(3)Na2S2O4产率与加入NaBH4溶液与NaHSO3溶液质量比的关系如图2所示,NaBH4碱性溶液与NaHSO3酸性溶液加料质量比增大时,Na2S2O4产率下降的原因是___________ 。
(4)称量5.0g含Na2S2O4•2H2O晶体粗品溶于水配制成250mL溶液,准确量取25.00mL配制溶液于锥形瓶中,加入足量甲醛溶液,充分反应后,再滴加几滴淀粉溶液,用0.2000mol•L-1标准碘溶液滴定至反应终点,重复实验三次后,平均消耗标准碘溶液20.00mL。有关反应如下:Na2S2O4+2CH2O+H2O=NaHSO3•CH2O+NaHSO2•CH2O,NaHSO2•CH2O+2I2+2H2O=NaHSO4+4HI+CH2O,计算该粗品中Na2S2O4•2H2O晶体质量分数为___________ 。(写出计算过程)
实验室用NaBH4碱性溶液和NaHSO3酸性溶液制取Na2S2O4,实验室制备装置如图1所示。

(1)实验前需打开K通入一段时间氮气,其目的是
(2)在10℃~35℃下,向盛有一定浓度的NaHSO3溶液容器中滴加NaBH4溶液,生成Na2S2O4和NaBO2,制备Na2S2O4的化学方程式为
(3)Na2S2O4产率与加入NaBH4溶液与NaHSO3溶液质量比的关系如图2所示,NaBH4碱性溶液与NaHSO3酸性溶液加料质量比增大时,Na2S2O4产率下降的原因是

(4)称量5.0g含Na2S2O4•2H2O晶体粗品溶于水配制成250mL溶液,准确量取25.00mL配制溶液于锥形瓶中,加入足量甲醛溶液,充分反应后,再滴加几滴淀粉溶液,用0.2000mol•L-1标准碘溶液滴定至反应终点,重复实验三次后,平均消耗标准碘溶液20.00mL。有关反应如下:Na2S2O4+2CH2O+H2O=NaHSO3•CH2O+NaHSO2•CH2O,NaHSO2•CH2O+2I2+2H2O=NaHSO4+4HI+CH2O,计算该粗品中Na2S2O4•2H2O晶体质量分数为
您最近一年使用:0次
名校
解题方法
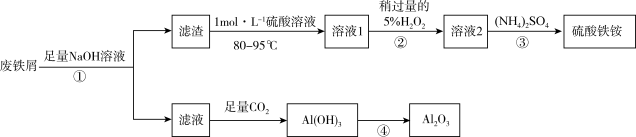
6 . 硫酸铁铵可用作媒染剂和制药,其晶体化学式为(NH4)aFeb(SO4)c·dH2O。实验室模拟用废铁屑(主要成分为Fe和少量的Al杂质)制取硫酸铁铵晶体并回收氧化铝,具体流程如下图所示:
(1)步骤①中发生的离子方程式为:___________ 。步骤④为灼烧,该过程在___________ 中进行(填仪器名称)。
(2)实验中需配制500 mL 1.00 mol·L-1的硫酸,则需要量取质量分数为98%,密度为1.84 g·mL-1的浓硫酸________ mL,配制过程中不需要用到的仪器是_______ (填字母)。除图中已有仪器外,还缺少的一种玻璃仪器是________ 。
(3)步骤②中加入足量H2O2的目的是氧化Fe2+,该步骤中发生的离子方程式为:_______ 。
(4)硫酸铁铵晶体组成的测定
步骤1:准确称取质量为4.820 g固体在酸性条件下溶于水配成100.00 mL溶液A;
步骤2:取25.00 mL溶液A,加入足量的BaCl2溶液,过滤得1.165 g沉淀;
步骤3:取25.00 mL溶液A,加入足量氢氧化钠溶液,过滤、洗涤并灼烧得0.2 g固体。
通过计算确定该晶体的化学式________ (写出计算过程)。

(1)步骤①中发生的离子方程式为:
(2)实验中需配制500 mL 1.00 mol·L-1的硫酸,则需要量取质量分数为98%,密度为1.84 g·mL-1的浓硫酸

(3)步骤②中加入足量H2O2的目的是氧化Fe2+,该步骤中发生的离子方程式为:
(4)硫酸铁铵晶体组成的测定
步骤1:准确称取质量为4.820 g固体在酸性条件下溶于水配成100.00 mL溶液A;
步骤2:取25.00 mL溶液A,加入足量的BaCl2溶液,过滤得1.165 g沉淀;
步骤3:取25.00 mL溶液A,加入足量氢氧化钠溶液,过滤、洗涤并灼烧得0.2 g固体。
通过计算确定该晶体的化学式
您最近一年使用:0次
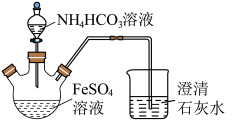
7 . 碳酸亚铁(FeCO3)难溶于水,常用于制取铁盐或补血剂。一种FeCO3的制备装置如图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得FeCO3沉淀。______________ 。
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是___________ 。
(3)FeCO3在潮湿的空气中会转化为Fe(OH)3并进步转化为Fe2O3。写出FeCO3在潮湿的空气中转化为Fe(OH)3的化学方程式:__________________ 。
(4)某FeCO3固体被部分氧化,为测定其中Fe3+的质量分数,现进行如下实验:称取5.000g固体样品,加足量盐酸溶解,将溶液稀释至100mL,量取20.00mL该溶液,加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.1000mol/LNa2S2O3溶液滴定,当滴定至终点时消耗Na2S2O3溶液20.00mL。已知实验过程中发生反应如下:2Fe3++2I-=2Fe2++I2,I2+2S2O =S4O
=S4O +2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
+2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程_________ 。
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是
(3)FeCO3在潮湿的空气中会转化为Fe(OH)3并进步转化为Fe2O3。写出FeCO3在潮湿的空气中转化为Fe(OH)3的化学方程式:
(4)某FeCO3固体被部分氧化,为测定其中Fe3+的质量分数,现进行如下实验:称取5.000g固体样品,加足量盐酸溶解,将溶液稀释至100mL,量取20.00mL该溶液,加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.1000mol/LNa2S2O3溶液滴定,当滴定至终点时消耗Na2S2O3溶液20.00mL。已知实验过程中发生反应如下:2Fe3++2I-=2Fe2++I2,I2+2S2O
 =S4O
=S4O +2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
+2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
您最近一年使用:0次
名校
解题方法
8 . 工业上电解精炼铜的阳极泥是重要的二次资源,从中间产物分金渣(主要成分为:AgCl、 Ag2S、PbSO4、 BaSO4)中获取高纯银的流程如图所示:
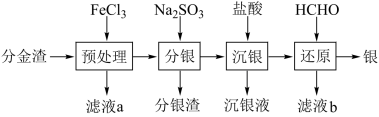
已知:在上述反应的温度下Ksp(AgCl)=1.8×10-10,Ksp(Ag2s)=6.38×10-50,
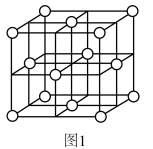
(1)银的一种晶胞如图1所示,银原子周围距离最近且相等的银原子为_______ 。
(2)“预处理”加入FeCl3溶液将Ag2S转化为AgCl。若将AgCl放在KI溶液中振荡,则有部分AgCl转化为AgI。 AgI有α、β、γ三种晶型,其中α- AgI在电场作用下,Ag+不需要克服太大的阻力,就可以发生迁移。因此α- AgI晶体在电池中,可作为_______ 。
(3)已知: Ag+ +2SO = [Ag(SO3)2]3-, K = 1.0 ×108.68,“分银”时,AgCl与Na2SO3反应生成[Ag(SO3)2]3-,该反应的平衡常数K=
= [Ag(SO3)2]3-, K = 1.0 ×108.68,“分银”时,AgCl与Na2SO3反应生成[Ag(SO3)2]3-,该反应的平衡常数K=_______ 。
(4)“分银”时,[Ag(SO3)2]3-的浓度与溶液pH的关系如图2; SO 及其与H+形成的微粒的浓度分数α随溶液pH变化的关系如图3。
及其与H+形成的微粒的浓度分数α随溶液pH变化的关系如图3。
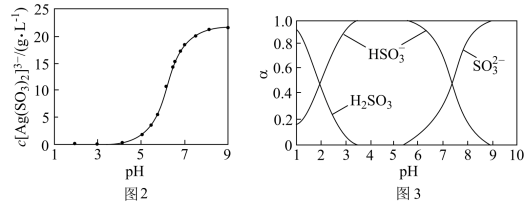
“沉银”时的终点pH需控制在3.5-5.5范围内,不能过低的原因是_______ 。
(5)“还原"时HCHO转化为HCOOH,其化学方程式为_______ 。
(6)已如Ag+ +SCN- =AgSCN↓ (白色),实验室可通过如下过程测定所制银样品的纯度(杂质不参与反应):
①称取制备的银样品1.000g,加适量稀硝酸溶解,定容到100mL容量瓶中。
②准确称取25.00 mL溶液置于锥形瓶中,般化后滴入几滴铁铵矾[NH4Fe(SO4)2]溶液作指示剂,再用0.1000 mol / L NH4SCN标准溶液滴定,滴定终点的实验现象为溶液变为(血)红色。
③重复②的操作两次,所用NH4SCN标准溶液的平均体积为22. 00mL。则样品中银的质量分数为_______ 。(写出计算过程)

已知:在上述反应的温度下Ksp(AgCl)=1.8×10-10,Ksp(Ag2s)=6.38×10-50,
(1)银的一种晶胞如图1所示,银原子周围距离最近且相等的银原子为

(2)“预处理”加入FeCl3溶液将Ag2S转化为AgCl。若将AgCl放在KI溶液中振荡,则有部分AgCl转化为AgI。 AgI有α、β、γ三种晶型,其中α- AgI在电场作用下,Ag+不需要克服太大的阻力,就可以发生迁移。因此α- AgI晶体在电池中,可作为
(3)已知: Ag+ +2SO
 = [Ag(SO3)2]3-, K = 1.0 ×108.68,“分银”时,AgCl与Na2SO3反应生成[Ag(SO3)2]3-,该反应的平衡常数K=
= [Ag(SO3)2]3-, K = 1.0 ×108.68,“分银”时,AgCl与Na2SO3反应生成[Ag(SO3)2]3-,该反应的平衡常数K=(4)“分银”时,[Ag(SO3)2]3-的浓度与溶液pH的关系如图2; SO
 及其与H+形成的微粒的浓度分数α随溶液pH变化的关系如图3。
及其与H+形成的微粒的浓度分数α随溶液pH变化的关系如图3。
“沉银”时的终点pH需控制在3.5-5.5范围内,不能过低的原因是
(5)“还原"时HCHO转化为HCOOH,其化学方程式为
(6)已如Ag+ +SCN- =AgSCN↓ (白色),实验室可通过如下过程测定所制银样品的纯度(杂质不参与反应):
①称取制备的银样品1.000g,加适量稀硝酸溶解,定容到100mL容量瓶中。
②准确称取25.00 mL溶液置于锥形瓶中,般化后滴入几滴铁铵矾[NH4Fe(SO4)2]溶液作指示剂,再用0.1000 mol / L NH4SCN标准溶液滴定,滴定终点的实验现象为溶液变为(血)红色。
③重复②的操作两次,所用NH4SCN标准溶液的平均体积为22. 00mL。则样品中银的质量分数为
您最近一年使用:0次
2022-12-29更新
|
409次组卷
|
3卷引用:江苏省南京市六校联合体2022-2023学年高三上学期11月联考化学试题
江苏省南京市六校联合体2022-2023学年高三上学期11月联考化学试题(已下线)广东省东莞市2022-2023学年高三上学期期末教学质量检查变式汇编(17-20)陕西师范大学附属中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
9 . 亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如下图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。

(1)装置A利用Na2SO3和硫酸制取SO2,导管b的作用是___________ 。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下化合制得NOSO4H,该反应为放热反应。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以采取的操作是______ 。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是______ 。
(3)该实验装置存在可能导致NOSO4H产量降低的缺陷是___________ 。
(4)测定亚硝酰硫酸NOSO4H的纯度。
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol/L、60.00mL的KMnO4溶液和10mL25%H2SO4溶液,摇匀。然后将0.2500mol/L草酸钠(Na2C2O4)溶液滴入碘量瓶中,消耗草酸钠溶液的体积为20.00mL。
已知:
①配平下面的方程式:___________ 。
_______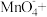 _______
_______ _______
_______ ______
______
 ______
______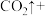 ______
______
②亚硝酰硫酸的质量分数=___________ 。(精确到0.1%)(写出计算过程)

(1)装置A利用Na2SO3和硫酸制取SO2,导管b的作用是
(2)装置B中浓HNO3与SO2在浓H2SO4作用下化合制得NOSO4H,该反应为放热反应。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以采取的操作是
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是
(3)该实验装置存在可能导致NOSO4H产量降低的缺陷是
(4)测定亚硝酰硫酸NOSO4H的纯度。
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol/L、60.00mL的KMnO4溶液和10mL25%H2SO4溶液,摇匀。然后将0.2500mol/L草酸钠(Na2C2O4)溶液滴入碘量瓶中,消耗草酸钠溶液的体积为20.00mL。
已知:

①配平下面的方程式:
_______
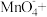 _______
_______ _______
_______ ______
______
 ______
______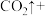 ______
______
②亚硝酰硫酸的质量分数=
您最近一年使用:0次
2023-04-10更新
|
458次组卷
|
2卷引用:江苏省苏州中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
10 . 高氯酸铵 是复合火箭推进剂的重要成分,实验室可通过下列反应制取。
是复合火箭推进剂的重要成分,实验室可通过下列反应制取。

(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为___________ 。

(2)反应得到的混合溶液中 和
和 的质量分数分别为
的质量分数分别为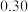 和
和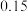 ,从混合溶液中获得较多
,从混合溶液中获得较多 晶体的实验操作依次为(填操作名称)
晶体的实验操作依次为(填操作名称)___________ 、___________ 、___________ 、冰水洗涤、干燥。用冰水洗涤的目的是___________ 。
若氯化铵溶液用氨气和浓盐酸代替,则该反应不需要加热就能进行,其原因是___________ 。
 是复合火箭推进剂的重要成分,实验室可通过下列反应制取。
是复合火箭推进剂的重要成分,实验室可通过下列反应制取。
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为

(2)反应得到的混合溶液中
 和
和 的质量分数分别为
的质量分数分别为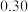 和
和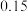 ,从混合溶液中获得较多
,从混合溶液中获得较多 晶体的实验操作依次为(填操作名称)
晶体的实验操作依次为(填操作名称)若氯化铵溶液用氨气和浓盐酸代替,则该反应不需要加热就能进行,其原因是
您最近一年使用:0次



