名校
1 . 焦亚硫酸钠(Na2S2O5)具有强还原性、漂白性,广泛用于食品、医药、印染等。工业上常以含硫废气为原料制得过饱和NaHSO3溶液,再将其结晶脱水制得Na2S2O5。实验室可用如图装置(略去部分夹持仪器)模拟该制备过程。 已知:常温下,
 5.6×10-11,Ka1 (H2SO3)=1.3×10-2、Ka2 (H2SO3)=6.2×10-8。回答下列问题:
5.6×10-11,Ka1 (H2SO3)=1.3×10-2、Ka2 (H2SO3)=6.2×10-8。回答下列问题:

(1)按图示组装仪器。
①A装置用于制备SO2,试剂X、Y的组合最好是_______________ (填字母)。
a.稀盐酸和 Na2SO3,固体 b.98%硫酸和铜
c.70%硫酸和K2SO3固体 d.稀硝酸和 NaHSO3固体
②D装置的作用是___________________
(2)检查装置的气密性后装入药品,先向C 中烧瓶滴加饱和Na2CO3溶液,再向 A 中烧瓶滴加 X,反应一段时间,待 C 中溶液的pH 为4.1 时,停止通SO2,写出SO2和饱和 Na2CO3溶液反应的化学方程式:__________________________________ 。
(3)将恒压分液漏斗更换为固体加料漏斗,先向三颈烧瓶中加入Na2CO3粉末至pH为7~8,再继续通入SO2至 pH=4.1,该步骤的目的是_________________________ 。将C 中溶液结晶脱水析出太量白色固体,经过滤、乙醇洗涤、真空干燥,得到产品 Na2S2O5。
(4)称取1.000g产品于碘量瓶中,加入50.00 mL 0.2000 mol·L-1过量标准碘溶液(杂质不参与反应),在暗处放置5分钟充分反应:______________________________ (填离子方程式)。再用 标准溶液滴定剩余碘,发生反应:
标准溶液滴定剩余碘,发生反应: , 加入淀粉指示剂,滴定至溶液蓝色刚好褪去。上述过程重复三次,消耗Na2S2O3溶液的体积分别是19.60 mL、20.22 mL、20.18 mL,产品中Na2S2O5的纯度为
, 加入淀粉指示剂,滴定至溶液蓝色刚好褪去。上述过程重复三次,消耗Na2S2O3溶液的体积分别是19.60 mL、20.22 mL、20.18 mL,产品中Na2S2O5的纯度为__________________________________ (结果保留四位有效数字)。
(5)产品中可能混有的杂质为_____________________________ ,为提高纯度,在不改变原有装置的基础上对(2)中的操作进行改进,改进后的操作是_________________________________ 。

 5.6×10-11,Ka1 (H2SO3)=1.3×10-2、Ka2 (H2SO3)=6.2×10-8。回答下列问题:
5.6×10-11,Ka1 (H2SO3)=1.3×10-2、Ka2 (H2SO3)=6.2×10-8。回答下列问题:
(1)按图示组装仪器。
①A装置用于制备SO2,试剂X、Y的组合最好是
a.稀盐酸和 Na2SO3,固体 b.98%硫酸和铜
c.70%硫酸和K2SO3固体 d.稀硝酸和 NaHSO3固体
②D装置的作用是
(2)检查装置的气密性后装入药品,先向C 中烧瓶滴加饱和Na2CO3溶液,再向 A 中烧瓶滴加 X,反应一段时间,待 C 中溶液的pH 为4.1 时,停止通SO2,写出SO2和饱和 Na2CO3溶液反应的化学方程式:
(3)将恒压分液漏斗更换为固体加料漏斗,先向三颈烧瓶中加入Na2CO3粉末至pH为7~8,再继续通入SO2至 pH=4.1,该步骤的目的是
(4)称取1.000g产品于碘量瓶中,加入50.00 mL 0.2000 mol·L-1过量标准碘溶液(杂质不参与反应),在暗处放置5分钟充分反应:
 标准溶液滴定剩余碘,发生反应:
标准溶液滴定剩余碘,发生反应: , 加入淀粉指示剂,滴定至溶液蓝色刚好褪去。上述过程重复三次,消耗Na2S2O3溶液的体积分别是19.60 mL、20.22 mL、20.18 mL,产品中Na2S2O5的纯度为
, 加入淀粉指示剂,滴定至溶液蓝色刚好褪去。上述过程重复三次,消耗Na2S2O3溶液的体积分别是19.60 mL、20.22 mL、20.18 mL,产品中Na2S2O5的纯度为(5)产品中可能混有的杂质为
您最近一年使用:0次
名校
解题方法
2 . 高氯酸铵(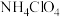 )受热或撞击可分解成
)受热或撞击可分解成 、
、 、
、 和
和 ,可用作火箭推进剂。一种以工业
,可用作火箭推进剂。一种以工业 (含少量的
(含少量的 和
和 )溶液制取高氯酸铵的流程如下,电解时使用惰性电极,电解后溶液中有
)溶液制取高氯酸铵的流程如下,电解时使用惰性电极,电解后溶液中有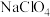 生成。
生成。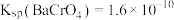 。
。
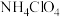 )受热或撞击可分解成
)受热或撞击可分解成 、
、 、
、 和
和 ,可用作火箭推进剂。一种以工业
,可用作火箭推进剂。一种以工业 (含少量的
(含少量的 和
和 )溶液制取高氯酸铵的流程如下,电解时使用惰性电极,电解后溶液中有
)溶液制取高氯酸铵的流程如下,电解时使用惰性电极,电解后溶液中有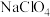 生成。
生成。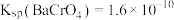 。
。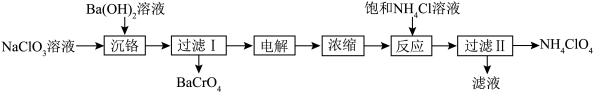
A.沉铬时加入 可以增加溶液的碱性,促进 可以增加溶液的碱性,促进 转化为 转化为 |
| B.电解时阴极附近溶液pH减小 |
C.加入饱和 溶液反应时可能有 溶液反应时可能有 生成 生成 |
D.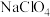 、 、 、 、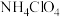 三种物质中, 三种物质中,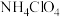 溶解度最大 溶解度最大 |
您最近一年使用:0次
2023-04-16更新
|
966次组卷
|
6卷引用:重庆市七校2023-2024学年高三上学期开学考试化学试题
3 . 疫情防控中,含氯消毒剂发挥了重要作用。含氯消毒剂有多种,如 、
、 、
、 、
、 、
、 。某化学兴趣小组利用
。某化学兴趣小组利用 溶液来制备含氯消毒剂。
溶液来制备含氯消毒剂。
I.配制一定物质的量浓度的 溶液
溶液
(1)配制 溶液,需用托盘天平称取
溶液,需用托盘天平称取______ 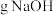 固体。
固体。
(2)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的玻璃仪器是__________ 。
(3)若向容量瓶加水定容时眼睛仰视液面,会造成所配溶液浓度__________ (“偏高”、“偏低”或“不变”)。
II.制备“84”消毒液

(4)仪器A的名称为__________ 。
(5)装置①中二氧化锰和浓盐酸反应制取氯气的化学方程式为__________ 。
(6)装置②中盛装的试剂为__________ ,用于除去 中的
中的 杂质。
杂质。
(7)装置③中制得“84”消毒液,其有效成分是__________ (填化学式)。
(8)清洗卫生间时,“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,用离子方程式解释其原因为__________ 。
(9)含氯消毒剂中有效氯含量,能反映含氯消毒剂消毒能力的大小,其定义是每克含氯消毒剂的氧化能力相当于多少克氯气的氧化能力。则 的有效氯含量为
的有效氯含量为__________ (保留小数点后两位)。
 、
、 、
、 、
、 、
、 。某化学兴趣小组利用
。某化学兴趣小组利用 溶液来制备含氯消毒剂。
溶液来制备含氯消毒剂。I.配制一定物质的量浓度的
 溶液
溶液(1)配制
 溶液,需用托盘天平称取
溶液,需用托盘天平称取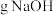 固体。
固体。(2)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的玻璃仪器是
(3)若向容量瓶加水定容时眼睛仰视液面,会造成所配溶液浓度
II.制备“84”消毒液

(4)仪器A的名称为
(5)装置①中二氧化锰和浓盐酸反应制取氯气的化学方程式为
(6)装置②中盛装的试剂为
 中的
中的 杂质。
杂质。(7)装置③中制得“84”消毒液,其有效成分是
(8)清洗卫生间时,“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,用离子方程式解释其原因为
(9)含氯消毒剂中有效氯含量,能反映含氯消毒剂消毒能力的大小,其定义是每克含氯消毒剂的氧化能力相当于多少克氯气的氧化能力。则
 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
名校
解题方法
4 . 钴及其化合物在化工生产中有重要的用途。三氯化六氨合钴(Ⅲ)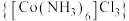 是黄色或橙黄色晶体,实验室以
是黄色或橙黄色晶体,实验室以 为原料经催化制备
为原料经催化制备 ,步骤如下:
,步骤如下:
Ⅰ. 的制备
的制备
 (易潮解)可以通过钴和氯气反应制得,实验室用下图实验装置制备纯净
(易潮解)可以通过钴和氯气反应制得,实验室用下图实验装置制备纯净 。
。
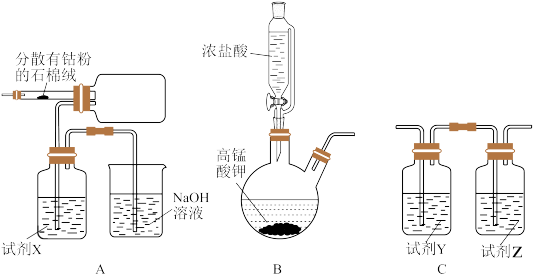
(1)装置的连接顺序为_______ (填字母),B装置用于制备氧气,其反应的化学方程式为_______ ,A装置中试剂X的名称为_______ 。
(2)组装好仪器进行实验时,要先加入浓盐酸,使B装置中开始生成氯气,待A装置内充满黄绿色气体,再加热A装置中的钴粉,目的是_______ 。
Ⅱ.三氯化六氨合钴(Ⅲ)的制备。其原理为: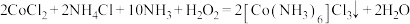 。
。

已知:三氯化六氨合钴不溶于乙醇,常温水中溶解度较小。
(3)水浴温度不超过 的原因是
的原因是_______ 。
(4)下列说法不正确的是_______(填标号)。
Ⅲ.晶体结构测定与钴含量分析。
(5)测定晶体结构最常见的仪器是_______ ,从而获取晶胞形状和大小、分子或原子在微观空间的有序排列。已知 具有正八面体的空间结构,
具有正八面体的空间结构, 中的2个
中的2个 被2个
被2个 取代,能得到
取代,能得到_______ 种产物。
(6)利用 将
将 氧化成
氧化成 ,
, 被还原后的产物为
被还原后的产物为 。然后用
。然后用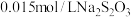 标准溶液滴定生成的
标准溶液滴定生成的 (已知:
(已知: )。若称取样品的质量为
)。若称取样品的质量为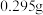 ,滴定
,滴定 时,达到终点消耗
时,达到终点消耗 标准溶液的平均体积为
标准溶液的平均体积为 。该样品中钴元素的质量分数为
。该样品中钴元素的质量分数为_______ %。
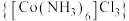 是黄色或橙黄色晶体,实验室以
是黄色或橙黄色晶体,实验室以 为原料经催化制备
为原料经催化制备 ,步骤如下:
,步骤如下:Ⅰ.
 的制备
的制备 (易潮解)可以通过钴和氯气反应制得,实验室用下图实验装置制备纯净
(易潮解)可以通过钴和氯气反应制得,实验室用下图实验装置制备纯净 。
。
(1)装置的连接顺序为
(2)组装好仪器进行实验时,要先加入浓盐酸,使B装置中开始生成氯气,待A装置内充满黄绿色气体,再加热A装置中的钴粉,目的是
Ⅱ.三氯化六氨合钴(Ⅲ)的制备。其原理为:
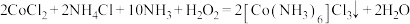 。
。
已知:三氯化六氨合钴不溶于乙醇,常温水中溶解度较小。
(3)水浴温度不超过
 的原因是
的原因是(4)下列说法不正确的是_______(填标号)。
A. 除作为反应物外,还有调节溶液的 除作为反应物外,还有调节溶液的 的作用 的作用 |
| B.活性炭是脱色剂,固体2是活性炭 |
C.加入浓盐酸,析出产品的反应方程式为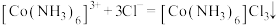 |
| D.可用乙醇水溶液洗涤产品 |
Ⅲ.晶体结构测定与钴含量分析。
(5)测定晶体结构最常见的仪器是
 具有正八面体的空间结构,
具有正八面体的空间结构, 中的2个
中的2个 被2个
被2个 取代,能得到
取代,能得到(6)利用
 将
将 氧化成
氧化成 ,
, 被还原后的产物为
被还原后的产物为 。然后用
。然后用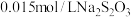 标准溶液滴定生成的
标准溶液滴定生成的 (已知:
(已知: )。若称取样品的质量为
)。若称取样品的质量为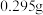 ,滴定
,滴定 时,达到终点消耗
时,达到终点消耗 标准溶液的平均体积为
标准溶液的平均体积为 。该样品中钴元素的质量分数为
。该样品中钴元素的质量分数为
您最近一年使用:0次
5 . 草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为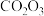 ,含少量
,含少量 等)制取
等)制取 工艺流程如图所示:
工艺流程如图所示:

已知:①浸出液含有的阳离子主要有 等;
等;
②酸性条件下, 不会氧化
不会氧化 ,
, 转化为
转化为 ;
;
③部分阳离子的氢氧化物形式沉淀时溶液的 见下表。
见下表。
回答下列问题:
(1)浸出过程中加入 的主要目的
的主要目的___________ ,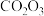 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)向浸出液中加入 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(3)“加 调
调 至5.2”,过滤所得到的沉淀的成分为
至5.2”,过滤所得到的沉淀的成分为___________ 。
(4)向滤液Ⅰ中加入 溶液得到的沉淀的主要成分是
溶液得到的沉淀的主要成分是___________ (写化学式)。
(5)萃取剂对金属离子的萃取率与 的关系如图1所示,萃取剂的作用是除锰离子,其使用的适宜
的关系如图1所示,萃取剂的作用是除锰离子,其使用的适宜 范围是
范围是___________ (填字母代号)。

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)①实验室里灼烧 晶体,所需要的硅酸盐质仪器除了酒精灯和玻璃棒外,还有
晶体,所需要的硅酸盐质仪器除了酒精灯和玻璃棒外,还有___________ (填仪器名称)
②
 热分解质量变化过程如图2所示。其中
热分解质量变化过程如图2所示。其中 以前是隔绝空气加热,
以前是隔绝空气加热, 以后是花空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
以后是花空气中加热。A、B、C均为纯净物,C点所示产物的化学式是___________ 。

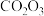 ,含少量
,含少量 等)制取
等)制取 工艺流程如图所示:
工艺流程如图所示:
已知:①浸出液含有的阳离子主要有
 等;
等;②酸性条件下,
 不会氧化
不会氧化 ,
, 转化为
转化为 ;
;③部分阳离子的氢氧化物形式沉淀时溶液的
 见下表。
见下表。| 沉淀物 |  |  |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 4.0 | 7.6 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 5.2 | 9.2 | 9.8 |
(1)浸出过程中加入
 的主要目的
的主要目的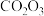 发生反应的离子方程式为
发生反应的离子方程式为(2)向浸出液中加入
 发生反应的离子方程式为
发生反应的离子方程式为(3)“加
 调
调 至5.2”,过滤所得到的沉淀的成分为
至5.2”,过滤所得到的沉淀的成分为(4)向滤液Ⅰ中加入
 溶液得到的沉淀的主要成分是
溶液得到的沉淀的主要成分是(5)萃取剂对金属离子的萃取率与
 的关系如图1所示,萃取剂的作用是除锰离子,其使用的适宜
的关系如图1所示,萃取剂的作用是除锰离子,其使用的适宜 范围是
范围是
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)①实验室里灼烧
 晶体,所需要的硅酸盐质仪器除了酒精灯和玻璃棒外,还有
晶体,所需要的硅酸盐质仪器除了酒精灯和玻璃棒外,还有②

 热分解质量变化过程如图2所示。其中
热分解质量变化过程如图2所示。其中 以前是隔绝空气加热,
以前是隔绝空气加热, 以后是花空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
以后是花空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
您最近一年使用:0次
2022-09-05更新
|
778次组卷
|
5卷引用:重庆市育才中学2022-2023学年高三上学期开学考试化学试题
重庆市育才中学2022-2023学年高三上学期开学考试化学试题重庆市育才中学校2023届高三上学期开学测试化学试题重庆市育才中学校2023届高三上学期开学测试化学试题(已下线)2022年辽宁省高考真题变式题(11-15)(已下线)2022年辽宁高考真题化学试题变式题(工业流程题)



