解题方法
1 . 硫酸的消耗量是衡量一个国家化学工业发展水平的标志。以黄铁矿(主要成分为 )为原料生产
)为原料生产 和
和 。
。
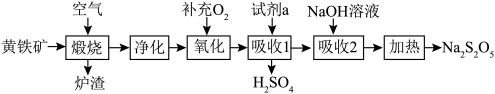
请回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为___________ ;试剂a为___________ 。
(2)若要增大煅烧过程的反应速率,应采取的措施是___________ (写两条即可)。
(3)煅烧时主要反应的化学方程式为___________ 。
(4)“氧化”时,反应的化学方程式为___________ 。
(5) 可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中
可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中 的含量。请配平其反应的化学方程式:
的含量。请配平其反应的化学方程式:_________
______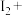 _______
_______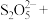 _______
_______ ________
________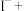 ______
______ ___________
___________
若要检验 是否变质生成了
是否变质生成了 ,所用的试剂是
,所用的试剂是___________ 。
(6)在测定某葡萄酒中 的含量时,取
的含量时,取 葡萄酒样品,消耗
葡萄酒样品,消耗 碘标准液
碘标准液 。样品中
。样品中 的含量为
的含量为___________  。
。
 )为原料生产
)为原料生产 和
和 。
。
请回答下列问题:
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)若要增大煅烧过程的反应速率,应采取的措施是
(3)煅烧时主要反应的化学方程式为
(4)“氧化”时,反应的化学方程式为
(5)
 可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中
可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中 的含量。请配平其反应的化学方程式:
的含量。请配平其反应的化学方程式:______
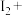 _______
_______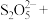 _______
_______ ________
________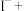 ______
______ ___________
___________
若要检验
 是否变质生成了
是否变质生成了 ,所用的试剂是
,所用的试剂是(6)在测定某葡萄酒中
 的含量时,取
的含量时,取 葡萄酒样品,消耗
葡萄酒样品,消耗 碘标准液
碘标准液 。样品中
。样品中 的含量为
的含量为 。
。
您最近一年使用:0次
名校
2 . 某化学小组模拟工业生产制取HNO3,设计如图所示装置,其中a为一个可持续鼓入空气的橡皮球。
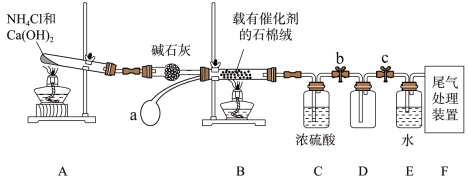
(1)装置图中盛装碱石灰的仪器名称是___________ ,分别写出装置A、装置B中发生反应的化学方程式___________ 、___________ 。
(2)装置D中发生反应的现象为___________ 。
(3)装置F可用盛有___________ 溶液的洗气瓶来进行尾气处理。
(4)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计如图所示装置(仪器固定装置省略未画)进行验证,实验步骤如下:
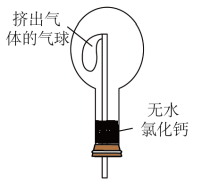
①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞。
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是___________ ,由此,该同学得出结论:不能用CaCl2代替碱石灰。
(5)反应结束后,向E中溶液中投入48.0gCu,当Cu反应完时,共产生标准状况下的20.16L气体(NO和NO2),则消耗的HNO3溶液中溶质的物质的量为___________ 。

(1)装置图中盛装碱石灰的仪器名称是
(2)装置D中发生反应的现象为
(3)装置F可用盛有
(4)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计如图所示装置(仪器固定装置省略未画)进行验证,实验步骤如下:

①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞。
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是
(5)反应结束后,向E中溶液中投入48.0gCu,当Cu反应完时,共产生标准状况下的20.16L气体(NO和NO2),则消耗的HNO3溶液中溶质的物质的量为
您最近一年使用:0次
2023-06-30更新
|
150次组卷
|
2卷引用:重庆市江津中学等七校2022-2023学年高一下学期期末联考化学试题
3 . 次磷酸钠(NaH2PO2)在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。
(1)NaH2PO2中P的化合价为___________ 价。
(2)将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍(在待镀零件表面形成一层金属镍)的目的,该过程中 被氧化为二元弱酸H3PO3,写出该反应的离子方程式
被氧化为二元弱酸H3PO3,写出该反应的离子方程式___________ 。
(3)次磷酸钠的制备
将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3(气体),PH3与NaClO溶液反应可生成次磷酸(H3PO2),实验装置如图:

①装置A中盛放烧碱溶液的仪器名称为___________ 。
②由装置A中发生化学反应可知,次磷酸(H3PO2)属于___________ 元弱酸。
③装置C中发生反应的化学方程式为___________ 。
④已知相关物质的溶解度如表:
充分反应后,将A、C中溶液混合,再将混合液(含极少量NaOH)加热浓缩,有大量杂质晶体析出,然后___________ (填操作名称),得到含NaH2PO2的溶液,进一步处理得到粗产品。
⑤反应结束后,向装置内通入N2的目的是___________ 。
(4)次磷酸钠的纯度测定
先取1.0g粗产品配成100mL溶液,再取25.00mL所配溶液于锥形瓶中,酸化后加入过量的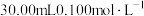 碘水。充分反应后,剩余碘水恰好可消耗
碘水。充分反应后,剩余碘水恰好可消耗 溶液(相关反应方程式为:
溶液(相关反应方程式为: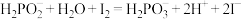 ,
, ),则产品纯度为
),则产品纯度为___________ 。(已知:NaH2PO2相对分子质量为88)
(1)NaH2PO2中P的化合价为
(2)将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍(在待镀零件表面形成一层金属镍)的目的,该过程中
 被氧化为二元弱酸H3PO3,写出该反应的离子方程式
被氧化为二元弱酸H3PO3,写出该反应的离子方程式(3)次磷酸钠的制备
将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3(气体),PH3与NaClO溶液反应可生成次磷酸(H3PO2),实验装置如图:

①装置A中盛放烧碱溶液的仪器名称为
②由装置A中发生化学反应可知,次磷酸(H3PO2)属于
③装置C中发生反应的化学方程式为
④已知相关物质的溶解度如表:
| 25℃ | 100℃ | |
| NaCl | 37g | 39g |
| NaH2PO2 | 100g | 667g |
⑤反应结束后,向装置内通入N2的目的是
(4)次磷酸钠的纯度测定
先取1.0g粗产品配成100mL溶液,再取25.00mL所配溶液于锥形瓶中,酸化后加入过量的
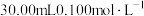 碘水。充分反应后,剩余碘水恰好可消耗
碘水。充分反应后,剩余碘水恰好可消耗 溶液(相关反应方程式为:
溶液(相关反应方程式为: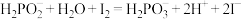 ,
, ),则产品纯度为
),则产品纯度为
您最近一年使用:0次
4 .  是中学化学重要的氧化物之一,在生产、生活中应用也十分广泛。某化学兴趣小组为制备、收集并探究
是中学化学重要的氧化物之一,在生产、生活中应用也十分广泛。某化学兴趣小组为制备、收集并探究 的性质。利用下图装置进行实验。
的性质。利用下图装置进行实验。

(1)装置A中,盛装浓硫酸的仪器名称是___________ 。
(2)装置B中盛装的也是浓硫酸,装置B的作用是___________ 。
(3)装置D中的现象为___________ ;体现了 的
的___________ 性。
(4)装置D中,浸有 溶液的碱性棉球的作用是
溶液的碱性棉球的作用是___________ 。若将碱性棉球改为浸 溶液,会在棉球上出现黄色固体,该反应的化学方程式为
溶液,会在棉球上出现黄色固体,该反应的化学方程式为___________ 。
(5)若将 通入
通入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为___________ 。检验生成的阴离子的实验操作及现象是___________ 。
 是中学化学重要的氧化物之一,在生产、生活中应用也十分广泛。某化学兴趣小组为制备、收集并探究
是中学化学重要的氧化物之一,在生产、生活中应用也十分广泛。某化学兴趣小组为制备、收集并探究 的性质。利用下图装置进行实验。
的性质。利用下图装置进行实验。
(1)装置A中,盛装浓硫酸的仪器名称是
(2)装置B中盛装的也是浓硫酸,装置B的作用是
(3)装置D中的现象为
 的
的(4)装置D中,浸有
 溶液的碱性棉球的作用是
溶液的碱性棉球的作用是 溶液,会在棉球上出现黄色固体,该反应的化学方程式为
溶液,会在棉球上出现黄色固体,该反应的化学方程式为(5)若将
 通入
通入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
5 . 电解饱和食盐水可获得多种产品。
(1)电解饱和食盐水的化学方程式:_______ 。
(2)一种电解饱和食盐水制备高氯酸钾的流程如图:(假设氧化产物、还原产物唯一)

①电解时得到的气体是_______ ;
②写出高温分解时的化学方程式_______ ;
③母液中主要含_______ (填化学式),能实现“转化”的原因是,在此条件下_______ 。
(3)一种三步法氯碱工艺工作原理的示意图如下:

①第一步中,当电路中转移1mole-时,阳极质量变化_______ g。
②第二步中,Ag的电极电势_______ (填“高”或“低”)。
③理论上,将第一步生产的NaOH和第三步生产的Cl2混合,充分反应的离子方程式为_______ 。
(1)电解饱和食盐水的化学方程式:
(2)一种电解饱和食盐水制备高氯酸钾的流程如图:(假设氧化产物、还原产物唯一)

①电解时得到的气体是
②写出高温分解时的化学方程式
③母液中主要含
(3)一种三步法氯碱工艺工作原理的示意图如下:

①第一步中,当电路中转移1mole-时,阳极质量变化
②第二步中,Ag的电极电势
③理论上,将第一步生产的NaOH和第三步生产的Cl2混合,充分反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 侯德榜为我国化工事业的发展作出了卓越贡献。“侯氏制碱法”的主要过程如下图(部分物质已略去)。

下列说法不正确的是

下列说法不正确的是
A.气体X为 |
B.氨盐水中通入气体X后,溶液中大量减少的阳离子是 |
C.悬浊液a中的不溶物主要是 |
| D.操作b为过滤 |
您最近一年使用:0次
2023-02-25更新
|
168次组卷
|
3卷引用:重庆市主城区七校2022-2023学年高一上学期期末考试化学试题
名校
解题方法
7 . 某同学设计了如下装置,用金属钠和空气反应制取纯度较高的 (不考虑空气中的
(不考虑空气中的 ,夹持装置已省略)。请回答下列问题:
,夹持装置已省略)。请回答下列问题:

(1) 的用途有
的用途有_______ (写两条即可)。
(2)仪器a的名称是_______ ;其中碱石灰的作用是_______
(3)装置B中的试剂是_______
(4)装置A中反应的离子方程式是_______ ;若没有该装置,可能会导致生成的 中含有
中含有_______ (填化学式)。
(5)取C中反应后的固体物质于试管中,并做如下实验。

①使酚酞变红的原因是_______ (用化学方程式解释)。
②加入酸性 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为_______
 (不考虑空气中的
(不考虑空气中的 ,夹持装置已省略)。请回答下列问题:
,夹持装置已省略)。请回答下列问题:
(1)
 的用途有
的用途有(2)仪器a的名称是
(3)装置B中的试剂是
(4)装置A中反应的离子方程式是
 中含有
中含有(5)取C中反应后的固体物质于试管中,并做如下实验。

①使酚酞变红的原因是
②加入酸性
 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为
您最近一年使用:0次
2023-02-11更新
|
427次组卷
|
2卷引用:重庆市南开中学校2022-2023学年高一上学期期末联合检测化学试题
名校
解题方法
8 . 黑钨矿的主要成分为FeWO4、MnWO4(含SiO2杂质)。
已知: ;
;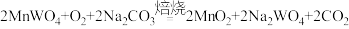 。
。
工业上以黑钨矿为原料利用纯碱烧结水浸法冶炼金属钨的流程如图。下列说法错误的是

已知:
 ;
;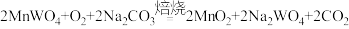 。
。工业上以黑钨矿为原料利用纯碱烧结水浸法冶炼金属钨的流程如图。下列说法错误的是

| A.为加快水浸的溶解速率,应将烧结物粉碎 |
| B.滤渣2为硅酸 |
C.同浓度的WO 离子结合质子的能力比SiO 离子结合质子的能力比SiO 离子强 离子强 |
| D.可采用铝热反应将WO3还原成单质W |
您最近一年使用:0次
2023-01-13更新
|
578次组卷
|
2卷引用:重庆市第一中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
9 . 如图是实验室制备氯气并进行一系列相关实验的装置。请回答下列问题:

(1)仪器a的名称是_______ 。
(2)按图组装好装置后,首先应进行的操作是_______ 。
(3)实验开始后,Ⅰ、Ⅱ处的有色布条褪色的是_______ 处(填“Ⅰ”或“Ⅱ”)
(4)装置A的烧瓶中发生反应的化学方程式_______ 。
(5)D中发生反应的离子方程式为_______ 。
(6)装置B中长颈漏斗的作用是_______ 。
(7)近年来,随着化学工业快速发展,氯气的需求迅速增加。如图是某制备氯气的原理示意图。CuO的作用是_______ ,总反应方程式为_______ 。
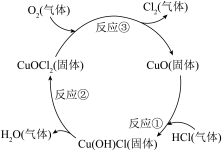

(1)仪器a的名称是
(2)按图组装好装置后,首先应进行的操作是
(3)实验开始后,Ⅰ、Ⅱ处的有色布条褪色的是
(4)装置A的烧瓶中发生反应的化学方程式
(5)D中发生反应的离子方程式为
(6)装置B中长颈漏斗的作用是
(7)近年来,随着化学工业快速发展,氯气的需求迅速增加。如图是某制备氯气的原理示意图。CuO的作用是

您最近一年使用:0次
2023-01-12更新
|
338次组卷
|
2卷引用:重庆市南开中学校2022-2023学年高一上学期1月期末考试化学试题
名校
解题方法
10 . 高纯硫化锂(Li2S)是一种潜在的锂离子电池电解质材料。一种制备Li2S的工艺流程如下:

已知Li2S易潮解,加热条件下易被氧化。
回答下列问题:
(1)上述流程中多次用到Ar,其目的是___________ 。
(2)实验室常用FeS与稀硫酸反应制备H2S,该反应的离子方程式为___________ ,所用发生装置与制备___________ (任写一种气体化学式)发生装置相同。
(3)“LiHS制备”过程所用实验装置(夹持仪器与加热装置均省略)如图:

①仪器X的名称为___________ ,冷却水从___________ (填“a”或“b”)进入。
②图中两个空锥形瓶的作用是___________ 。
③试剂Y为___________ 。
(4)“热解”时反应的化学方程式为___________ ,适宜的加热方式为___________ (填“ 油浴”或“水浴”)加热。
(5)该工艺中,Li2S的产率为___________ %(结果保留两位小数)。

已知Li2S易潮解,加热条件下易被氧化。
回答下列问题:
(1)上述流程中多次用到Ar,其目的是
(2)实验室常用FeS与稀硫酸反应制备H2S,该反应的离子方程式为
(3)“LiHS制备”过程所用实验装置(夹持仪器与加热装置均省略)如图:

①仪器X的名称为
②图中两个空锥形瓶的作用是
③试剂Y为
(4)“热解”时反应的化学方程式为
(5)该工艺中,Li2S的产率为
您最近一年使用:0次
2022-07-05更新
|
281次组卷
|
2卷引用:重庆市乌江新高考协作体2022-2023学年高一下学期7月期末考试化学试题



