名校
1 . 硫代硫酸钠(Na2S2O3)是硫酸钠中一个氧原子被硫原子取代的产物。硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g⋅mol−1)易溶于水,难溶于乙醇,在酸性环境中易分解。
Ⅰ.制备a2S2O3·5H2O
方法一:亚硫酸钠法。反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3固体于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌后,加到上述Na2SO3溶液中。水浴加热,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶析出Na2S2O3·5H2O晶体。
(1) 中心硫原子的杂化方式为
中心硫原子的杂化方式为___________ 。
(2)使用煮沸过的蒸馏水配制Na2SO3溶液的目的是___________ 。
方法二:硫化碱法。装置如图所示。
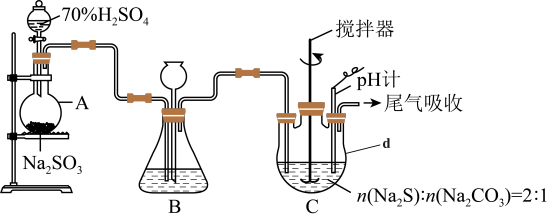
(3)①仪器d的名称为___________ 。
②装置A中发生反应的化学方程式为___________ 。
③装置C中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2.该反应的化学方程式为___________ 。
④实验过程中,为了保证Na2S2O3·5H2O的产量,实验中通入的SO2不能过量,原因是_________ 。
Ⅱ.Na2S2O3的应用
(4)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.0000g样品溶于水,配成100mL溶液。
步骤2:准确称取0.294gK2Cr2O7固体于碘量瓶中,加入20mL蒸馏水溶解,再加入10mL2mol⋅L−1H2SO4和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL某溶液作指示剂,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2 =2I−+
=2I−+ )
)
①步骤3中向碘量瓶中加入的指示剂是___________ 。
②由计算可得Na2S2O3·5H2O的纯度为___________ 。
Ⅰ.制备a2S2O3·5H2O
方法一:亚硫酸钠法。反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3固体于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌后,加到上述Na2SO3溶液中。水浴加热,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶析出Na2S2O3·5H2O晶体。
(1)
 中心硫原子的杂化方式为
中心硫原子的杂化方式为(2)使用煮沸过的蒸馏水配制Na2SO3溶液的目的是
方法二:硫化碱法。装置如图所示。

(3)①仪器d的名称为
②装置A中发生反应的化学方程式为
③装置C中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2.该反应的化学方程式为
④实验过程中,为了保证Na2S2O3·5H2O的产量,实验中通入的SO2不能过量,原因是
Ⅱ.Na2S2O3的应用
(4)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.0000g样品溶于水,配成100mL溶液。
步骤2:准确称取0.294gK2Cr2O7固体于碘量瓶中,加入20mL蒸馏水溶解,再加入10mL2mol⋅L−1H2SO4和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL某溶液作指示剂,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2
 =2I−+
=2I−+ )
)①步骤3中向碘量瓶中加入的指示剂是
②由计算可得Na2S2O3·5H2O的纯度为
您最近一年使用:0次
2 . 一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)制取MnSO4·H2O并回收单质硫的工艺流程如下:

回答下列问题:
(1)写出基态铁原子价层电子轨道表示式___________ 。
(2)步骤①混合研磨成细粉的主要目的是___________ 。
(3)步骤②浸取时若生成S、MnSO4及Fe2(SO4)3,化学方程式为___________ 。
(4)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入氧化剂___________ (填化学式),步骤⑤所得滤渣为___________ (填化学式)。
(5)步骤⑤所得滤液经过___________ (填操作)可得纯净干燥的MnSO4·H2O。
(6)步骤⑦中(NH4)2Sx+1分解需在90~100℃下进行,该反应除得到产品外,还产生一种酸性和一种碱性气体,写出其化学方程式___________ 。

回答下列问题:
(1)写出基态铁原子价层电子轨道表示式
(2)步骤①混合研磨成细粉的主要目的是
(3)步骤②浸取时若生成S、MnSO4及Fe2(SO4)3,化学方程式为
(4)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入氧化剂
(5)步骤⑤所得滤液经过
(6)步骤⑦中(NH4)2Sx+1分解需在90~100℃下进行,该反应除得到产品外,还产生一种酸性和一种碱性气体,写出其化学方程式
您最近一年使用:0次
名校
3 . 利用草酸(H2C2O4)制备草酸亚铁晶体(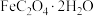 )的流程及组分测定方法如下:
)的流程及组分测定方法如下:

已知:pH>4时,Fe2+易被氧气氧化
(1)用稀硫酸调溶液pH至1~2的目的是:___________ 。
(2)某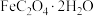 样品中可能含有的杂质为
样品中可能含有的杂质为 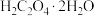 ,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
步骤I:将 1.26克样品置于锥形瓶中,加入稀H2SO4溶解。
步骤 Ⅱ: 用0.1 mol∙L−1的 KMnO4溶液滴定至终点,消耗KMnO4溶液 24.32mL。
步骤 Ⅲ:向上述溶液中加入适量还原剂(不含铁元素)将Fe3+完全还原为Fe2+ 加入稀H2SO4酸化后,继续用KMnO4溶液滴定至终点,又消耗KMnO4溶液bmL。
加入稀H2SO4酸化后,继续用KMnO4溶液滴定至终点,又消耗KMnO4溶液bmL。
①步骤Ⅱ中0.1 mol∙L−1的KMnO4溶液装在_______ 中(填“酸式滴定管”或“碱式滴定管”)。
②有关滴定管的正确操作顺序为:D_______ 。
A. 蒸馏水洗涤 B. 装入滴定液至零刻度以上 C. 调整滴定液液面至零刻度或零刻度以下 D. 检漏 E.排除气泡 F.用滴定液润洗2至3次 G.记录起始读数
③步骤Ⅱ中滴定达到终点时的实验现象是_______ 。
④步骤Ⅲ中若滴定开始和结束时,酸式滴定管中的液面如图所示,则b=_______ mL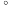
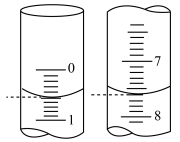
⑤下列关于步骤Ⅲ滴定的操作,导致测得样品中Fe元素含量偏高是_______ (填标号)。
A. 滴定终点读数时,俯视滴定管的刻度
B. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
C. 滴定管用蒸馏水润洗后,未用 KMnO4溶液润洗
D. 滴定过程中,锥形瓶中有少许溶液溅出
⑥计算样品中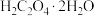 (M=126 g∙mol−1)的质量分数为
(M=126 g∙mol−1)的质量分数为_______ 。
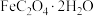 )的流程及组分测定方法如下:
)的流程及组分测定方法如下:
已知:pH>4时,Fe2+易被氧气氧化
(1)用稀硫酸调溶液pH至1~2的目的是:
(2)某
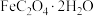 样品中可能含有的杂质为
样品中可能含有的杂质为 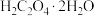 ,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
,采用KMnO4滴定法测定该样品的组成,实验步骤如下:步骤I:将 1.26克样品置于锥形瓶中,加入稀H2SO4溶解。
步骤 Ⅱ: 用0.1 mol∙L−1的 KMnO4溶液滴定至终点,消耗KMnO4溶液 24.32mL。
步骤 Ⅲ:向上述溶液中加入适量还原剂(不含铁元素)将Fe3+完全还原为Fe2+
 加入稀H2SO4酸化后,继续用KMnO4溶液滴定至终点,又消耗KMnO4溶液bmL。
加入稀H2SO4酸化后,继续用KMnO4溶液滴定至终点,又消耗KMnO4溶液bmL。①步骤Ⅱ中0.1 mol∙L−1的KMnO4溶液装在
②有关滴定管的正确操作顺序为:D
A. 蒸馏水洗涤 B. 装入滴定液至零刻度以上 C. 调整滴定液液面至零刻度或零刻度以下 D. 检漏 E.排除气泡 F.用滴定液润洗2至3次 G.记录起始读数
③步骤Ⅱ中滴定达到终点时的实验现象是
④步骤Ⅲ中若滴定开始和结束时,酸式滴定管中的液面如图所示,则b=
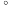

⑤下列关于步骤Ⅲ滴定的操作,导致测得样品中Fe元素含量偏高是
A. 滴定终点读数时,俯视滴定管的刻度
B. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
C. 滴定管用蒸馏水润洗后,未用 KMnO4溶液润洗
D. 滴定过程中,锥形瓶中有少许溶液溅出
⑥计算样品中
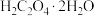 (M=126 g∙mol−1)的质量分数为
(M=126 g∙mol−1)的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 一氧化二氯( )是国际公认的高效安全灭菌消毒剂,其部分性质如下:现用如图所示装置制备少量
)是国际公认的高效安全灭菌消毒剂,其部分性质如下:现用如图所示装置制备少量 。
。
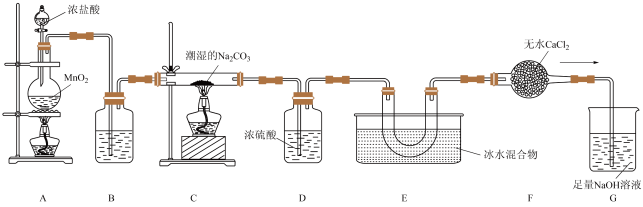
已知:常温下, 是棕黄色、有刺激性气味的气体,易溶于水,且与水反应生成HClO;熔点:-120.6℃:沸点2.0℃。
是棕黄色、有刺激性气味的气体,易溶于水,且与水反应生成HClO;熔点:-120.6℃:沸点2.0℃。
(1)盛有浓盐酸的仪器的名称是___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置B中的试剂是___________ (填名称)。
(4)装置C 中固体产物中有 和另一种常见的钠盐,写出该反应的化学方程式
和另一种常见的钠盐,写出该反应的化学方程式___________ 。
(5)为进一步探究 的性质,甲同学取E中
的性质,甲同学取E中 滴到湿润的有色布条上,观察到有色布条
滴到湿润的有色布条上,观察到有色布条___________ (填“能”或“不能”)褪色;乙同学取少量 滴入到淀粉-KI的酸性溶液中,观察到溶液变蓝,写出该反应的离子方程式
滴入到淀粉-KI的酸性溶液中,观察到溶液变蓝,写出该反应的离子方程式___________ 。
(6)装置G的作用是吸收氯气,查阅资料可知,氯气与NaOH溶液能发生如下反应: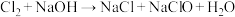 ,
,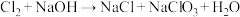 (未配平)。实验结束后测得G溶液中
(未配平)。实验结束后测得G溶液中 数目为8a,则上述两个反应共转移电子数为
数目为8a,则上述两个反应共转移电子数为___________ ;若还测得溶液中 的数目为a,则溶液中
的数目为a,则溶液中 的数目为
的数目为___________ 。
 )是国际公认的高效安全灭菌消毒剂,其部分性质如下:现用如图所示装置制备少量
)是国际公认的高效安全灭菌消毒剂,其部分性质如下:现用如图所示装置制备少量 。
。
已知:常温下,
 是棕黄色、有刺激性气味的气体,易溶于水,且与水反应生成HClO;熔点:-120.6℃:沸点2.0℃。
是棕黄色、有刺激性气味的气体,易溶于水,且与水反应生成HClO;熔点:-120.6℃:沸点2.0℃。(1)盛有浓盐酸的仪器的名称是
(2)装置A中发生反应的离子方程式为
(3)装置B中的试剂是
(4)装置C 中固体产物中有
 和另一种常见的钠盐,写出该反应的化学方程式
和另一种常见的钠盐,写出该反应的化学方程式(5)为进一步探究
 的性质,甲同学取E中
的性质,甲同学取E中 滴到湿润的有色布条上,观察到有色布条
滴到湿润的有色布条上,观察到有色布条 滴入到淀粉-KI的酸性溶液中,观察到溶液变蓝,写出该反应的离子方程式
滴入到淀粉-KI的酸性溶液中,观察到溶液变蓝,写出该反应的离子方程式(6)装置G的作用是吸收氯气,查阅资料可知,氯气与NaOH溶液能发生如下反应:
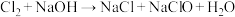 ,
,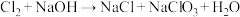 (未配平)。实验结束后测得G溶液中
(未配平)。实验结束后测得G溶液中 数目为8a,则上述两个反应共转移电子数为
数目为8a,则上述两个反应共转移电子数为 的数目为a,则溶液中
的数目为a,则溶液中 的数目为
的数目为
您最近一年使用:0次
5 . “84”消毒液(主要成分为 和
和 )是一种常用家庭消毒液,某小组同学对“84”消毒液的制备及漂白性进行如下探究。
)是一种常用家庭消毒液,某小组同学对“84”消毒液的制备及漂白性进行如下探究。
I.制备“84消毒液

(1)盛装 仪器的名称为
仪器的名称为___________ ;选择合适装置,按气流从左至右,导管连接顺序为a→___________ →b(填小写字母)。
(2)装置A中反应的离子方程式为___________ ,装置B的作用是___________ 。
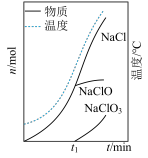
(3)装置E中得到“84”消毒液的化学方程式为___________ 。装置E中生成物的物质的量和溶液的温度随时间的变化如图所示,经分析发现实验过程中装置E中温度计的温度上升过快会导致产物中存在杂质,为避免此状况的发生,应进行的操作为___________ 。
(4)工业上是将氯气通入到 的
的 溶液中来制备“84”消毒液,则生产
溶液中来制备“84”消毒液,则生产 该溶液理论上至少需消耗氯气的质量为
该溶液理论上至少需消耗氯气的质量为___________  (保留整数)。
(保留整数)。
II.探究“84消毒液”的漂白性
资料:i.相同浓度时, 氧化性强于
氧化性强于 ;
;
ii. 反应水溶液中所有物质表现出来的氧化-还原性,
反应水溶液中所有物质表现出来的氧化-还原性, 越大,氧化性越强。
越大,氧化性越强。
某小组同学进行了如下实验:
①向 “84消毒液”中加入
“84消毒液”中加入 水后,放入红色纸片,观察到纸片慢慢褪色。
水后,放入红色纸片,观察到纸片慢慢褪色。
②向 “84消毒液”中加入
“84消毒液”中加入 白醋后,放入红色纸片,观察到纸片迅速褪色。
白醋后,放入红色纸片,观察到纸片迅速褪色。
③向 “84消毒液”中加入
“84消毒液”中加入 浓盐酸后,观察到大量黄绿色气体产生。
浓盐酸后,观察到大量黄绿色气体产生。
④测得“84消毒液”在不同温度时 随时间的变化曲线如下图。
随时间的变化曲线如下图。

(5)已知白醋显酸性,不具有漂白性。实验①、②现象不同的原因是___________ 。
(6)实验③现象表明,向“84消毒液”中加入浓盐酸时会产生氯气,该反应的离子方程式为_____ 。
(7)由实验④可得出的结论是 值与温度有关,且温度越高,
值与温度有关,且温度越高, 值越低。
值越低。 不同的原因可能是
不同的原因可能是___________ 。
 和
和 )是一种常用家庭消毒液,某小组同学对“84”消毒液的制备及漂白性进行如下探究。
)是一种常用家庭消毒液,某小组同学对“84”消毒液的制备及漂白性进行如下探究。I.制备“84消毒液

(1)盛装
 仪器的名称为
仪器的名称为(2)装置A中反应的离子方程式为
(3)装置E中得到“84”消毒液的化学方程式为

(4)工业上是将氯气通入到
 的
的 溶液中来制备“84”消毒液,则生产
溶液中来制备“84”消毒液,则生产 该溶液理论上至少需消耗氯气的质量为
该溶液理论上至少需消耗氯气的质量为 (保留整数)。
(保留整数)。II.探究“84消毒液”的漂白性
资料:i.相同浓度时,
 氧化性强于
氧化性强于 ;
;ii.
 反应水溶液中所有物质表现出来的氧化-还原性,
反应水溶液中所有物质表现出来的氧化-还原性, 越大,氧化性越强。
越大,氧化性越强。某小组同学进行了如下实验:
①向
 “84消毒液”中加入
“84消毒液”中加入 水后,放入红色纸片,观察到纸片慢慢褪色。
水后,放入红色纸片,观察到纸片慢慢褪色。②向
 “84消毒液”中加入
“84消毒液”中加入 白醋后,放入红色纸片,观察到纸片迅速褪色。
白醋后,放入红色纸片,观察到纸片迅速褪色。③向
 “84消毒液”中加入
“84消毒液”中加入 浓盐酸后,观察到大量黄绿色气体产生。
浓盐酸后,观察到大量黄绿色气体产生。④测得“84消毒液”在不同温度时
 随时间的变化曲线如下图。
随时间的变化曲线如下图。
(5)已知白醋显酸性,不具有漂白性。实验①、②现象不同的原因是
(6)实验③现象表明,向“84消毒液”中加入浓盐酸时会产生氯气,该反应的离子方程式为
(7)由实验④可得出的结论是
 值与温度有关,且温度越高,
值与温度有关,且温度越高, 值越低。
值越低。 不同的原因可能是
不同的原因可能是
您最近一年使用:0次
名校
6 . 已知某工业废水中含有大量的 ,还可能大量存在
,还可能大量存在 中的几种,以及部分污泥,通过下列流程可从该废水中回收
中的几种,以及部分污泥,通过下列流程可从该废水中回收 晶体及固体单质。已知氧化性:
晶体及固体单质。已知氧化性: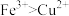 。
。
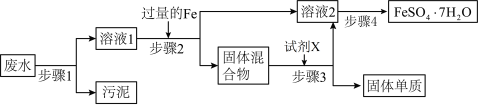
(1)不做任何实验就可以确定上述工业废水中一定不存在的离子是___________ (填离子符号)
(2)根据步骤2中得到固体混合物可以确定上述工业废水中肯定存在的离子是___________ (填离子符号)。
(3) 的存在对回收
的存在对回收 晶体的纯度
晶体的纯度___________ (填“有”或“无)影响,理由是___________ 。
(4)检验上述工业废水中是否存在 常用方法的名称是
常用方法的名称是___________ 。
(5)步骤3中加入的试剂X为________ (填试剂名称),发生反应的离子方程式为_________ 。
(6)步骤4中涉及的操作是:___________ 、___________ 、过滤、洗涤、烘干。烘干操作需在低温条件下进行,原因是___________ 。
 ,还可能大量存在
,还可能大量存在 中的几种,以及部分污泥,通过下列流程可从该废水中回收
中的几种,以及部分污泥,通过下列流程可从该废水中回收 晶体及固体单质。已知氧化性:
晶体及固体单质。已知氧化性: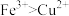 。
。
(1)不做任何实验就可以确定上述工业废水中一定不存在的离子是
(2)根据步骤2中得到固体混合物可以确定上述工业废水中肯定存在的离子是
(3)
 的存在对回收
的存在对回收 晶体的纯度
晶体的纯度(4)检验上述工业废水中是否存在
 常用方法的名称是
常用方法的名称是(5)步骤3中加入的试剂X为
(6)步骤4中涉及的操作是:
您最近一年使用:0次
名校
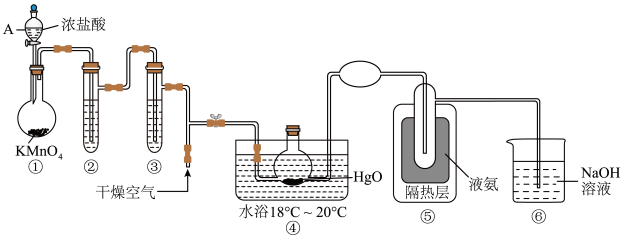
7 . 一氧化二氯(Cl2O)是一种氯化剂和氧化剂,极易溶于水,与水反应生成HClO,浓度过高时会发生爆炸,42℃以 上易分解。某化学兴趣小组设计如图装置以制备Cl2O(支撑及夹持装置已省略)。
已知:Cl2O的部分性质如表:
请回答下列问题。
(1)装置①中仪器A的名称为___________ 。
(2)装置②的作用是___________ ,装置③中盛有的试剂是___________ 。
(3)通入干燥空气的主要目的是___________ 。
(4)装置④中采用18°C~ 20℃水浴的原因之一是:如温度低,反应速率慢,另一个可能的原因是___________ 。
(5)Cl2O是市场上一种比较理想的饮用水消毒剂,ClO2和Cl2O在消毒时自身均被还原为Cl-,则ClO2的消毒效率(以单位质量得到的电子数表示)是等质量的Cl2O的___________ 倍(结果保留一位小数)
(6)据文献报道,Cl2O的另一种制备方法是利用Cl2与适量潮湿的Na2CO3反应来制得,同时产生氯化钠和碳酸氢钠两种盐,写出该反应的化学方程式__________ 。

已知:Cl2O的部分性质如表:
| 熔点 | 沸点 | 制备方法 |
| 120.69℃ | 3.8℃ | 2HgO+2Cl2=Cl2O+HgCl2·HgO(反应放热) |
(1)装置①中仪器A的名称为
(2)装置②的作用是
(3)通入干燥空气的主要目的是
(4)装置④中采用18°C~ 20℃水浴的原因之一是:如温度低,反应速率慢,另一个可能的原因是
(5)Cl2O是市场上一种比较理想的饮用水消毒剂,ClO2和Cl2O在消毒时自身均被还原为Cl-,则ClO2的消毒效率(以单位质量得到的电子数表示)是等质量的Cl2O的
(6)据文献报道,Cl2O的另一种制备方法是利用Cl2与适量潮湿的Na2CO3反应来制得,同时产生氯化钠和碳酸氢钠两种盐,写出该反应的化学方程式
您最近一年使用:0次
名校
8 . 水合氧化铁[ FeO(OH)]是一种重要的化工原料,用作磁性材料、颜料铁黄等。一种以硫铁矿烧渣(含Fe、FeO、SiO2和少量CuO)为原料生产FeO(OH)的工艺流程如下:

已知:SiO2难溶于水和硫酸
回答下列问题:
(1)FeO(OH)中Fe元素的化合价为___________ 。
(2)“酸浸”时FeO与硫酸发生反应的离子方程式为___________ 。
(3)“除杂”时滤渣②的成分为___________ ;“沉淀”时___________ (填“能”或“不能")用NaOH溶液代替氨水。
(4)某研究小组进行过滤步骤实验,所需要用到的玻璃仪器除烧杯外,还需要___________ 。
(5)“加热氧化”时Fe(OH)2发生的化学方程式为___________ 。
(6)“过滤"后需洗涤FeO(OH)沉淀,请设计实验检验FeO(OH)沉淀是否洗涤干净___________ 。
(7)测定产品的纯度:准确称取FeO(OH)样品10 g,完全溶解于稀硫酸中,用过量的NaOH溶液沉淀其中的铁元素,得到沉淀质量为11g。该样品纯度为___________ (保留3位有效数字)

已知:SiO2难溶于水和硫酸
回答下列问题:
(1)FeO(OH)中Fe元素的化合价为
(2)“酸浸”时FeO与硫酸发生反应的离子方程式为
(3)“除杂”时滤渣②的成分为
(4)某研究小组进行过滤步骤实验,所需要用到的玻璃仪器除烧杯外,还需要
(5)“加热氧化”时Fe(OH)2发生的化学方程式为
(6)“过滤"后需洗涤FeO(OH)沉淀,请设计实验检验FeO(OH)沉淀是否洗涤干净
(7)测定产品的纯度:准确称取FeO(OH)样品10 g,完全溶解于稀硫酸中,用过量的NaOH溶液沉淀其中的铁元素,得到沉淀质量为11g。该样品纯度为
您最近一年使用:0次
名校
9 . ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂。回答下列问题:
I.ClO2的制备,生产流程如下图所示:
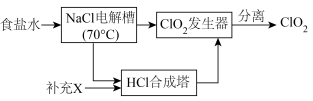
(1)用于电解的食盐水需先除去其中的 等杂质。向粗盐水中依次中加入过量的
等杂质。向粗盐水中依次中加入过量的___________ (填化学式)溶液、过量的 溶液和过量的
溶液和过量的___________ (填化学式)溶液,过滤后向滤液中加入盐酸至溶液呈中性。
(2)将经过净化后的食盐水加入电解槽中,70℃左右电解得到 和一种气体,则
和一种气体,则 合成塔中还需要补充的物质X为
合成塔中还需要补充的物质X为___________ (填化学式)。
(3)ClO2发生器中发生的反应为: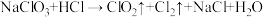 (反应未配平)。
(反应未配平)。
① 在该反应中表现的性质是
在该反应中表现的性质是___________ 。
②配平该反应的化学方程式,并用单线桥法标出电子转移的数目 ___________ 。
II.探究ClO2的某些性质,装置如下图所示:
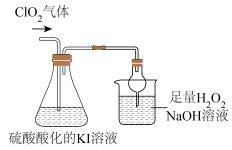
已知:①ClO2是极易溶于水的气体:②I2遇淀粉溶液变为蓝色
(4)反应结束后,往锥形瓶内滴加淀粉溶液,溶液变为蓝色,写出ClO2通入锥形瓶中反应的离子方程式___________ 。
(5)上图装置中,球形干燥管的作用是___________ 。烧杯内液体用于吸收未反应的CO2,若反应的氧化产物是 ,且氧化剂与还原剂的个数之比是
,且氧化剂与还原剂的个数之比是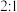 ,则还原产物是
,则还原产物是___________ (填化学式)。
I.ClO2的制备,生产流程如下图所示:

(1)用于电解的食盐水需先除去其中的
 等杂质。向粗盐水中依次中加入过量的
等杂质。向粗盐水中依次中加入过量的 溶液和过量的
溶液和过量的(2)将经过净化后的食盐水加入电解槽中,70℃左右电解得到
 和一种气体,则
和一种气体,则 合成塔中还需要补充的物质X为
合成塔中还需要补充的物质X为(3)ClO2发生器中发生的反应为:
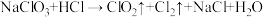 (反应未配平)。
(反应未配平)。①
 在该反应中表现的性质是
在该反应中表现的性质是②配平该反应的化学方程式,
II.探究ClO2的某些性质,装置如下图所示:

已知:①ClO2是极易溶于水的气体:②I2遇淀粉溶液变为蓝色
(4)反应结束后,往锥形瓶内滴加淀粉溶液,溶液变为蓝色,写出ClO2通入锥形瓶中反应的离子方程式
(5)上图装置中,球形干燥管的作用是
 ,且氧化剂与还原剂的个数之比是
,且氧化剂与还原剂的个数之比是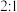 ,则还原产物是
,则还原产物是
您最近一年使用:0次
名校
10 . 高纯度硝酸高铈铵主要用作有机合成的催化剂和氧化剂、集成电路的腐蚀剂等。它的化学式为(NH4)2Ce(NO3)6,易溶于水,几乎不溶于浓硝酸。实验室用CeCl3溶液制备硝酸高铈铵的主要步骤如下:
Ⅰ.CeCl3与NH4HCO3反应制备Ce2(CO3)3。
制备Ce2(CO3)3的装置如图所示:

将装置A和D中所产生的气体通入B装置一段时间,再将CeCl3溶液滴入下方反应后的溶液中,从而制备Ce2(CO3)3固体。
已知:Ce3+易被空气氧化成Ce4+。
回答下列问题:
(1)装置D中盛放稀盐酸的实验仪器名称为___________ ,装置C的作用是___________ 。
(2)若装置A和装置D中所产生的气体体积比超过1:1,则B中会产生一种含铈的沉淀杂质,其化学式为___________ 。
(3)装置B中制备Ce2(CO3)3反应的离子方程式为___________ 。
(4)Ce2(CO3)3在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到纯品Ce2(CO3)3.检验是否洗涤干净的方法为___________ 。
Ⅱ.制备硝酸高铈铵。
取适量碳酸铈[Ce2(CO3)3]于铂皿中,用硝酸溶解生成硝酸铈溶液,然后加入双氧水、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到Ce(OH)4(黄色难溶物)。将Ce(OH)4于一定温度下加入硝酸加热至浆状,生成H2[Ce(NO3)6],再加入稍过量的NH4NO3晶体从而生成硝酸高铈铵沉淀,经过悲、洗涤、(自然烘无后得到产异。
(5)①写出生成Ce(OH)4的离子方程式___________ 。
②“氧化沉淀”时,加热的温度不宜过高,原因是___________ 。
Ⅰ.CeCl3与NH4HCO3反应制备Ce2(CO3)3。
制备Ce2(CO3)3的装置如图所示:

将装置A和D中所产生的气体通入B装置一段时间,再将CeCl3溶液滴入下方反应后的溶液中,从而制备Ce2(CO3)3固体。
已知:Ce3+易被空气氧化成Ce4+。
回答下列问题:
(1)装置D中盛放稀盐酸的实验仪器名称为
(2)若装置A和装置D中所产生的气体体积比超过1:1,则B中会产生一种含铈的沉淀杂质,其化学式为
(3)装置B中制备Ce2(CO3)3反应的离子方程式为
(4)Ce2(CO3)3在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到纯品Ce2(CO3)3.检验是否洗涤干净的方法为
Ⅱ.制备硝酸高铈铵。
取适量碳酸铈[Ce2(CO3)3]于铂皿中,用硝酸溶解生成硝酸铈溶液,然后加入双氧水、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到Ce(OH)4(黄色难溶物)。将Ce(OH)4于一定温度下加入硝酸加热至浆状,生成H2[Ce(NO3)6],再加入稍过量的NH4NO3晶体从而生成硝酸高铈铵沉淀,经过悲、洗涤、(自然烘无后得到产异。
(5)①写出生成Ce(OH)4的离子方程式
②“氧化沉淀”时,加热的温度不宜过高,原因是
您最近一年使用:0次
2024-01-03更新
|
341次组卷
|
4卷引用:重庆市巴蜀中学校2023-2024学年高三上学期11月期中化学试题



