名校
解题方法
1 . 海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是___________ (填序号)。
A.食盐 B.淡水 C.烧碱 D.纯碱 E.溴
(2)大量的镁从海水中提取,一种工业制备无水氯化镁的工艺流程如下:
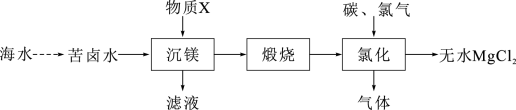
工业上常用“沉镁”物质X的是___________ ,“氯化”过程中的气态副产物常用作还原剂,“氯化”发生的化学方程式是___________ 。
(3)海带中含有碘元素。实验室提取碘的步骤如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是_______ 。海带灰中含有硫酸镁、碳酸钠等,在实验步骤___________ (填序号)中实现与碘分离。
②写出步骤④反应的离子方程式_______ 。反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈___________ 色。
③请设计实验检验用CCl4提取碘后的水溶液中是否还含有碘单质___________ (包括实验步骤、现象及结论)。
(1)无需经过化学变化就能从海水中获得的物质是
A.食盐 B.淡水 C.烧碱 D.纯碱 E.溴
(2)大量的镁从海水中提取,一种工业制备无水氯化镁的工艺流程如下:

工业上常用“沉镁”物质X的是
(3)海带中含有碘元素。实验室提取碘的步骤如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是
②写出步骤④反应的离子方程式
③请设计实验检验用CCl4提取碘后的水溶液中是否还含有碘单质
您最近一年使用:0次
2022-09-21更新
|
346次组卷
|
3卷引用:陕西师范大学附属中学2021-2022学年高一下学期期中考试化学试题
2 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。工业上从含碘海水中制备 的一种方法如图所示。已知氧化性
的一种方法如图所示。已知氧化性 ,还原性
,还原性 。回答下列问题:
。回答下列问题:
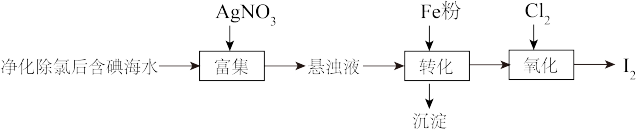
(1)海带中含有丰富的碘元素,处理时应将海带放入_______ (填仪器名称)中进行灼烧得含 的灰烬。
的灰烬。
(2)转化过程加入的Fe粉是过量的,发生的反应为: 。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为
。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为_______ ;若要检验转化过程所加Fe粉是否过量,可取适量转化所得的溶液于试管中,加入_______ 溶液,观察现象。
(3)氧化过程可以用适量的酸化的 代替
代替 ,则该反应的离子方程式为
,则该反应的离子方程式为_______ 。用 做氧化剂时也需控制
做氧化剂时也需控制 的用量,若反应物
的用量,若反应物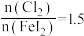 时,氧化产物为
时,氧化产物为 和
和_______ ,当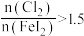 ,
, 会被过量的
会被过量的 进一步氧化从而导致单质碘的收率会降低。
进一步氧化从而导致单质碘的收率会降低。
(4)实验室从含碘废液(除 外,还含有
外,还含有 、
、 、
、 等)中回收碘,其实验过程如图所示:
等)中回收碘,其实验过程如图所示:
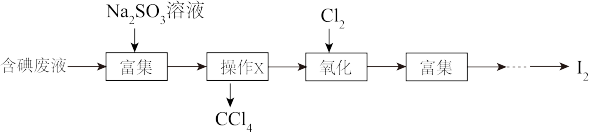
①操作X的名称为_______ 。
②向含碘废液中加入稍过量的 溶液,将废液中的
溶液,将废液中的 还原为
还原为 ,该操作的目的是
,该操作的目的是_______ 。
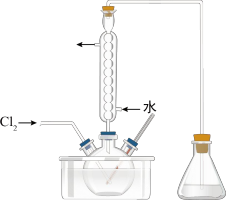
③氧化时,在三颈烧瓶中将含 的水溶液用盐酸调至pH约为2,缓慢通入
的水溶液用盐酸调至pH约为2,缓慢通入 ,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是_______ 。(选填字母编号)
A.增大 的溶解度 B.防止
的溶解度 B.防止 的升华 C.防止水发生分解
的升华 C.防止水发生分解
 的一种方法如图所示。已知氧化性
的一种方法如图所示。已知氧化性 ,还原性
,还原性 。回答下列问题:
。回答下列问题:
(1)海带中含有丰富的碘元素,处理时应将海带放入
 的灰烬。
的灰烬。(2)转化过程加入的Fe粉是过量的,发生的反应为:
 。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为
。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为(3)氧化过程可以用适量的酸化的
 代替
代替 ,则该反应的离子方程式为
,则该反应的离子方程式为 做氧化剂时也需控制
做氧化剂时也需控制 的用量,若反应物
的用量,若反应物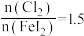 时,氧化产物为
时,氧化产物为 和
和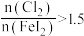 ,
, 会被过量的
会被过量的 进一步氧化从而导致单质碘的收率会降低。
进一步氧化从而导致单质碘的收率会降低。(4)实验室从含碘废液(除
 外,还含有
外,还含有 、
、 、
、 等)中回收碘,其实验过程如图所示:
等)中回收碘,其实验过程如图所示:
①操作X的名称为
②向含碘废液中加入稍过量的
 溶液,将废液中的
溶液,将废液中的 还原为
还原为 ,该操作的目的是
,该操作的目的是③氧化时,在三颈烧瓶中将含
 的水溶液用盐酸调至pH约为2,缓慢通入
的水溶液用盐酸调至pH约为2,缓慢通入 ,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
A.增大
 的溶解度 B.防止
的溶解度 B.防止 的升华 C.防止水发生分解
的升华 C.防止水发生分解
您最近一年使用:0次
解题方法
3 . 食盐中的加碘剂选用的是碘酸钾( )。实验室可用采用如图实验流程制备碘酸钾。
)。实验室可用采用如图实验流程制备碘酸钾。

(1)操作①的名称为______ 。
(2)操作②包括萃取、______ ,萃取后分液漏斗内的现象______ 。
(3)试剂X是18电子分子,写出溶液M与X反应的离子反应方程式为______ 。
(4)由单质碘制备碘酸钾的化学方程式为______ 。
(5)同学甲认为操作③可以用蒸馏的方法,但同学乙认为不可以,原因是______ ;于是改用下列分离法,具体流程如下:
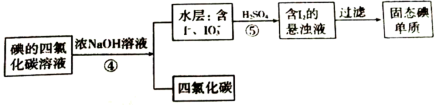
该分离方法叫______ 法,写出反应⑤离子反应方程式______ 。
 )。实验室可用采用如图实验流程制备碘酸钾。
)。实验室可用采用如图实验流程制备碘酸钾。
(1)操作①的名称为
(2)操作②包括萃取、
(3)试剂X是18电子分子,写出溶液M与X反应的离子反应方程式为
(4)由单质碘制备碘酸钾的化学方程式为
(5)同学甲认为操作③可以用蒸馏的方法,但同学乙认为不可以,原因是

该分离方法叫
您最近一年使用:0次
2021-04-10更新
|
212次组卷
|
2卷引用:山东省潍坊市2021-2022学年高一下学期3月阶段测试化学试题
名校
4 . 实验室用有机含碘(主要以 和
和 的形式存在)废水制备单质碘的实验流程如下:
的形式存在)废水制备单质碘的实验流程如下:
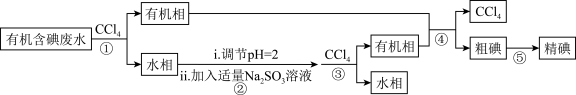
已知:碘的熔点为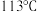 ,但固态的碘可以不经过熔化直接升华。下列说法错误的是
,但固态的碘可以不经过熔化直接升华。下列说法错误的是
 和
和 的形式存在)废水制备单质碘的实验流程如下:
的形式存在)废水制备单质碘的实验流程如下:
已知:碘的熔点为
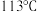 ,但固态的碘可以不经过熔化直接升华。下列说法错误的是
,但固态的碘可以不经过熔化直接升华。下列说法错误的是
| A.操作①和③中的有机相从分液漏斗下端放出 |
B.操作②中发生反应的离子方程式为 |
| C.操作④中用到的玻璃仪器仅需温度计、球形冷凝管、酒精灯、接引管及锥形瓶 |
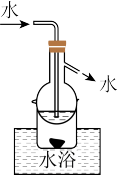
| D.操作⑤可用如图所示的水浴装置进行 |
您最近一年使用:0次
2022-09-01更新
|
134次组卷
|
2卷引用:河南省南阳市第一中学校2022-2023学年高三上学期第一次月考化学试题
名校
5 . 下列各实验中所选用的实验仪器(规格、数量不限,加持装置略去),能完成相应实验的是
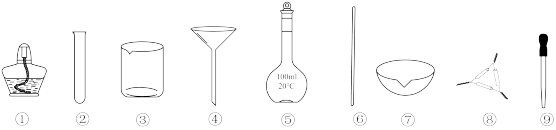

| A.用稀硫酸除去硫酸钡中的少量碳酸钡,只选用③和⑥ |
B.制备 并用于与葡萄糖反应得到银镜,只选用①、②、③和⑨ 并用于与葡萄糖反应得到银镜,只选用①、②、③和⑨ |
| C.将海带灼烧灰化,只选用①、⑦和⑧ |
D.用 的浓硫酸配制 的浓硫酸配制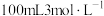 的稀硫酸,只选用③、⑤、⑥和⑨ 的稀硫酸,只选用③、⑤、⑥和⑨ |
您最近一年使用:0次
2021-12-25更新
|
193次组卷
|
3卷引用:3.3 醛 酮-2021-2022学年高二化学课后培优练(人教版2019选择性必修3)
(已下线)3.3 醛 酮-2021-2022学年高二化学课后培优练(人教版2019选择性必修3)山东省菏泽市东明县第一中学2021~2022学年高三上学期期中考试化学试题重庆市缙云教育联盟2021-2022学年高二12月月考化学试题
6 . 围绕海水的综合利用,化学课外兴趣小组进行下列实验:
(1)模拟工业制备氯气
装置如图所示,接通电源,当观察到石墨电极与滤纸接触的区域有细小的气泡产生时,停止通电。将pH试纸分别放在a、b处滤纸上,观察颜色变化。
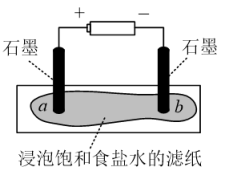
①在上述实验中观察a处pH试纸中心呈白色,边缘有一圈淡淡的红色,b处pH试纸呈___________ 色。
②实验结束后,将滤纸对折,使a、b处充分接触,可将a处残余的Cl2进一步处理。此时发生反应的化学反应方程式是___________ 。
(2)模拟反萃取法提取碘实验流程如下图:
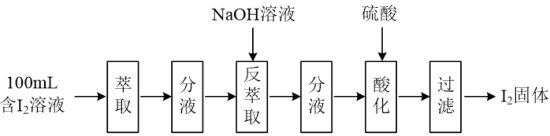
①“萃取”操作时须使用的玻璃仪器有烧杯、玻璃棒和___________ 。
②“反萃取”操作时溶液中有I-、IO 生成。“酸化”步骤发生反应的离子反应方程式为
生成。“酸化”步骤发生反应的离子反应方程式为___________ 。
(3)模拟浓海水提取镁实验流程如下图:
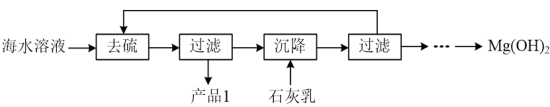
说明:模拟浓海水成分配制的“海水溶液”主要成分如下:
①产品1的化学式为___________ 。
②沉降阶段主要的化学反应方程式为___________ 。
(1)模拟工业制备氯气
装置如图所示,接通电源,当观察到石墨电极与滤纸接触的区域有细小的气泡产生时,停止通电。将pH试纸分别放在a、b处滤纸上,观察颜色变化。

①在上述实验中观察a处pH试纸中心呈白色,边缘有一圈淡淡的红色,b处pH试纸呈
②实验结束后,将滤纸对折,使a、b处充分接触,可将a处残余的Cl2进一步处理。此时发生反应的化学反应方程式是
(2)模拟反萃取法提取碘实验流程如下图:

①“萃取”操作时须使用的玻璃仪器有烧杯、玻璃棒和
②“反萃取”操作时溶液中有I-、IO
 生成。“酸化”步骤发生反应的离子反应方程式为
生成。“酸化”步骤发生反应的离子反应方程式为(3)模拟浓海水提取镁实验流程如下图:

说明:模拟浓海水成分配制的“海水溶液”主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO |
| 浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②沉降阶段主要的化学反应方程式为
您最近一年使用:0次



