名校
解题方法
1 . 海洋中蕴含着丰富的资源,我们通过“浓缩、氧化、提取”等步骤提取其中的溴、碘单质等资源。
为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:苦卤 含溴海水
含溴海水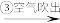 含溴空气
含溴空气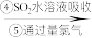 溴水混合物
溴水混合物 溴蒸气
溴蒸气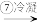 液溴
液溴
乙:苦卤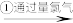 含溴海水
含溴海水 溴蒸气
溴蒸气 液溴
液溴
(1)步骤③通入热空气或水蒸气吹出Br2,利用了溴的__________ 性。甲同学步骤④所发生反应的化学反应方程式为___________________ 。步骤④中SO2被氧化生成 ,写出检验
,写出检验 的方法
的方法___________________ 。
(2)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是_______ (填“甲”或“乙”),理由_____________________________________ 。
海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:

(3)为寻找氯水的替代品,某同学将O2不断鼓入“溶液A”中。设计实验,判断O2是否能代替氯水。(简要说明所用的试剂、现象和结论)____________________ 。
(4)由于“溶液B”中I2的含量较低,“操作I”能将I2“富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂a”可以是_________ 。(选填编号)
(5)除操作I可以从碘的有机溶液中提取碘以外,还可用反萃取法,其流程如下:
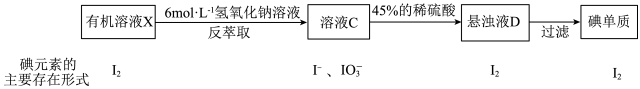
①“配制100g质量分数为45%H2SO4溶液”一定不会用到“配制100mL 6mol·L-1NaOH溶液”中的_____________ 仪器(填名称)。
②相较于操作II,反萃取法的优点在于_______________ 。
为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:苦卤
 含溴海水
含溴海水 含溴空气
含溴空气 溴水混合物
溴水混合物 溴蒸气
溴蒸气 液溴
液溴乙:苦卤
 含溴海水
含溴海水 溴蒸气
溴蒸气 液溴
液溴(1)步骤③通入热空气或水蒸气吹出Br2,利用了溴的
 ,写出检验
,写出检验 的方法
的方法(2)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是
海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:

(3)为寻找氯水的替代品,某同学将O2不断鼓入“溶液A”中。设计实验,判断O2是否能代替氯水。(简要说明所用的试剂、现象和结论)
(4)由于“溶液B”中I2的含量较低,“操作I”能将I2“富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂a”可以是
试剂 | A.乙醇 | B.氯仿 | C.四氯化碳 | D.裂化汽油 |
相关性质 | 与水互溶 不与I2反应 | 与水不互溶 不与I2反应 | 与水不互溶 不与I2反应 | 与水不互溶 与I2反应 |
(5)除操作I可以从碘的有机溶液中提取碘以外,还可用反萃取法,其流程如下:

①“配制100g质量分数为45%H2SO4溶液”一定不会用到“配制100mL 6mol·L-1NaOH溶液”中的
②相较于操作II,反萃取法的优点在于
您最近一年使用:0次
2022-12-14更新
|
729次组卷
|
2卷引用:上海市松江二中2021-2022学年高一上学期期末考试化学试题
2 . 回答下列问题:
(1)绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
① 下列各项符合“绿色化学”要求的是___ 。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
② 在我国西部大开发中,某地为筹建一大型化工基地,征集到下列方案,其中你认为可行的是___ 。
A.建在西部干旱区可以脱贫致富 B.应建在水资源丰富和交通方便且远离城市的郊区
C.企业有权自主选择厂址 D.不宜建在人口稠密的居民区
③ 某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。某同学设计了从该污水中回收纯净的金属铜的方案。
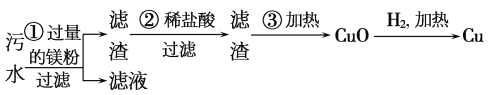
在能制得纯铜的方案中,哪一步操作会导致环境污染?___ ;应增加哪些措施防止污染___ 。
(2)海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:



i.实验操作③的名称是___ ,所用主要仪器名称为___ 。
ii.提取碘的过程中,可供选择的有机试剂是___ (填序号)。
A.酒精(沸点78 ℃) B.四氯化碳(沸点77 ℃) C.甘油(沸点290℃) D.苯(沸点80 ℃)
iii.在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量(填序号)___ 溶液,反应的离子方程式___ 。
A.KIO3 B.HClO C.KI D.Br2
iv.利用碘的有机溶液得到单质I2的方法是___ 。
(1)绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
① 下列各项符合“绿色化学”要求的是
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
② 在我国西部大开发中,某地为筹建一大型化工基地,征集到下列方案,其中你认为可行的是
A.建在西部干旱区可以脱贫致富 B.应建在水资源丰富和交通方便且远离城市的郊区
C.企业有权自主选择厂址 D.不宜建在人口稠密的居民区
③ 某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。某同学设计了从该污水中回收纯净的金属铜的方案。

在能制得纯铜的方案中,哪一步操作会导致环境污染?
(2)海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:


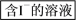
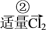
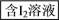
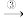
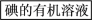

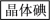
i.实验操作③的名称是
ii.提取碘的过程中,可供选择的有机试剂是
A.酒精(沸点78 ℃) B.四氯化碳(沸点77 ℃) C.甘油(沸点290℃) D.苯(沸点80 ℃)
iii.在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量(填序号)
A.KIO3 B.HClO C.KI D.Br2
iv.利用碘的有机溶液得到单质I2的方法是
您最近一年使用:0次
解题方法
3 . 浩瀚的海洋约占地球表面积的71%,它是一个巨大的宝藏,海水中水储量约为1.3×1018吨,约占地球上总水量的97%。请回答下列相关问题:
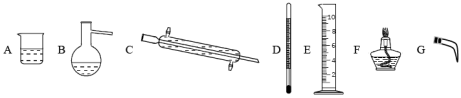
(1)海水淡化主要用蒸馏法。实验室蒸馏操作用到的主要仪器有___ (选填必要序号)。
(2)海水中主要含有Mg2+、SO 、K+、Cl-等离子,简述实验检验其中SO
、K+、Cl-等离子,简述实验检验其中SO 的实验操作与现象
的实验操作与现象___ ;简述实验检验其中Cl-的实验操作与现象___ 。
(3)海藻中富含碘元素,实验室模拟海藻提取KI的流程如图:

在灼烧、溶解、过滤、蒸发四个步骤中,均要使用到的一种实验仪器为___ 。小铭想要配制100mL0.2mol/L的KI溶液,需称量KI的质量为___ g,实验操作示意图如图,请你将其正确排序___ (填数字序号)。
(4)海水中含有大量矿物质,你认为海水中会富含石油吗?__ (填“会”或“不会”)。
(1)海水淡化主要用蒸馏法。实验室蒸馏操作用到的主要仪器有

(2)海水中主要含有Mg2+、SO
 、K+、Cl-等离子,简述实验检验其中SO
、K+、Cl-等离子,简述实验检验其中SO 的实验操作与现象
的实验操作与现象(3)海藻中富含碘元素,实验室模拟海藻提取KI的流程如图:

在灼烧、溶解、过滤、蒸发四个步骤中,均要使用到的一种实验仪器为
 | 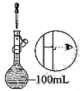 | 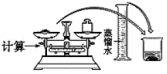 |  |  |  |
| ① | ② | ③ | ④ | ⑤ | ⑥ |
(4)海水中含有大量矿物质,你认为海水中会富含石油吗?
您最近一年使用:0次
名校
4 . 海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
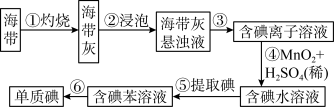
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是___________ (从下列仪器中选出所需的仪器,用标号字母填写在空自处)。
A.烧杯B.坩埚C.表面皿D.泥三角E.酒精灯F.干燥器
(2)步骤③的实验操作名称是___________ 。
(3)步骤④中还可以用 ,请写出
,请写出 氧化I- 的离子方程式:
氧化I- 的离子方程式:___________ 。
(4)检验水溶液中是否含有单质碘可以用___________ 溶液。

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是
A.烧杯B.坩埚C.表面皿D.泥三角E.酒精灯F.干燥器
(2)步骤③的实验操作名称是
(3)步骤④中还可以用
 ,请写出
,请写出 氧化I- 的离子方程式:
氧化I- 的离子方程式:(4)检验水溶液中是否含有单质碘可以用
您最近一年使用:0次
2021-11-04更新
|
259次组卷
|
2卷引用:云南省峨山彝族自治县第一中学2021-2022学年高二上学期9月月考化学试题
名校
5 . 海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是___ (填序号)。
A.Cl2 B.淡水 C.烧碱 D.粗盐
(2)如图是从海水中提取镁的简单流程。___ ,Mg(OH)2转化为MgCl2的离子方程式是___ 。
②由无水MgCl2制取Mg的化学方程式是___ 。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如图所示:
干海带 海带灰
海带灰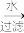 滤液
滤液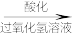
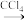
 I2
I2
①灼烧海带时所用的主要仪器名称是___ 。
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:___ 。
③反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈___ 。
(1)无需经过化学变化就能从海水中获得的物质是
A.Cl2 B.淡水 C.烧碱 D.粗盐
(2)如图是从海水中提取镁的简单流程。

②由无水MgCl2制取Mg的化学方程式是
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如图所示:
干海带
 海带灰
海带灰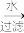 滤液
滤液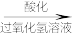
 I2
I2①灼烧海带时所用的主要仪器名称是
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:
③反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈
您最近一年使用:0次
2021-06-30更新
|
246次组卷
|
2卷引用:江西省南昌市第十中学2020-2021学年高一下学期期末考试化学试题
6 . H2O2是重要的化学试剂,在实验室和生产实际中应用广泛。
(1)写出H2O2的结构式:________ ,H2O2在MnO2催化下分解的化学方程式:__________ 。
(2) ①我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:_______________ 。
②在“海带提碘”的实验中,利用酸性H2O2得到碘单质的离子方程式是____________ 。
(3)H2O2还有一定的还原性,能使酸性KMnO4溶液褪色。
①写出反应的离子方程式:___________________ 。
②实验室常用酸性KMnO4标准液测定溶液中H2O2的浓度,酸性KMnO4溶液应盛放在________ (填“酸式”或“碱式”)滴定管中,判断到达滴定终点的现象是__________________ ;
(4)H2O2是一种二元弱酸,其与过量的Ba(OH)2反应的化学方程式为_____________ 。
(1)写出H2O2的结构式:
(2) ①我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:
②在“海带提碘”的实验中,利用酸性H2O2得到碘单质的离子方程式是
(3)H2O2还有一定的还原性,能使酸性KMnO4溶液褪色。
①写出反应的离子方程式:
②实验室常用酸性KMnO4标准液测定溶液中H2O2的浓度,酸性KMnO4溶液应盛放在
(4)H2O2是一种二元弱酸,其与过量的Ba(OH)2反应的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 我们知道海带中含有碘元素,工业上常以海带为原料提取碘单质。查有关资料可知碘单质易升华。下面是某校化学探究小组设计的从海带中提取单质碘的实验,请你完成下列实验。
(1)将干燥洁净的海带用酒精润湿后在__________ (填一种仪器名称)中灼烧成灰烬。
(2)将海带灰冷却至室温,然后转移到烧杯中,加蒸馏水后,搅拌、煮沸冷却、__________ (填一种操作名称)。
(3)在滤液中滴入几滴稀硫酸,再加入一定量的 溶液,把溶液注入分液漏斗中,然后再加入
溶液,把溶液注入分液漏斗中,然后再加入 振荡、静置,可以观察到
振荡、静置,可以观察到 层呈
层呈__________ 色。经分液得到碘的 溶液,在这一实验过程中,
溶液,在这一实验过程中, 起
起__________ 作用。
(4)取少量碘的 溶液于试管中,然后进行水浴加热,待
溶液于试管中,然后进行水浴加热,待 挥发完即可得到固体碘单质。不用酒精灯直接加热蒸发
挥发完即可得到固体碘单质。不用酒精灯直接加热蒸发 的原因是
的原因是____________________________________________________ 。
(5)证明得到的固体是碘单质的化学方法是_____________________________________________________ 。
(1)将干燥洁净的海带用酒精润湿后在
(2)将海带灰冷却至室温,然后转移到烧杯中,加蒸馏水后,搅拌、煮沸冷却、
(3)在滤液中滴入几滴稀硫酸,再加入一定量的
 溶液,把溶液注入分液漏斗中,然后再加入
溶液,把溶液注入分液漏斗中,然后再加入 振荡、静置,可以观察到
振荡、静置,可以观察到 层呈
层呈 溶液,在这一实验过程中,
溶液,在这一实验过程中, 起
起(4)取少量碘的
 溶液于试管中,然后进行水浴加热,待
溶液于试管中,然后进行水浴加热,待 挥发完即可得到固体碘单质。不用酒精灯直接加热蒸发
挥发完即可得到固体碘单质。不用酒精灯直接加热蒸发 的原因是
的原因是(5)证明得到的固体是碘单质的化学方法是
您最近一年使用:0次
2021-01-11更新
|
450次组卷
|
5卷引用:专题3 第三单元 海洋化学资源的综合利用-高中化学苏教2019版必修第一册
专题3 第三单元 海洋化学资源的综合利用-高中化学苏教2019版必修第一册(已下线)第4章 化学与自然资源的开发利用(培优提升卷)-2020-2021学年高一化学必修2章末集训必刷卷(人教版)(已下线)3.3.2 从海水中提取镁 从海水中提取碘-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)福建省南安市侨光中学2022-2023学年高一上学期12月月考化学试题福建省漳州市华安县第一中学2023-2024学年高一上学期10月月考化学试题
名校
解题方法
8 . 海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是___________ (填序号)
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是___________ 。
(3)下图是从海水中提取镁的简单流程。
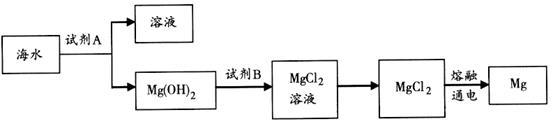
①工业上常用于沉淀Mg2+的试剂A是___________ ,转Mg(OH)2化为MgCl2的离子方程式是___________ 。
②由无水MgCl2制取Mg的化学方程式是___________ 。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
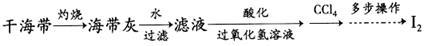
①灼烧海带至灰烬时所用的主要仪器名称是___________ 。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式___________ 。反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈___________ 色。
(1)无需经过化学变化就能从海水中获得的物质是
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是
(3)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+的试剂A是
②由无水MgCl2制取Mg的化学方程式是
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
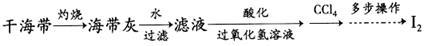
①灼烧海带至灰烬时所用的主要仪器名称是
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式
您最近一年使用:0次
2016-12-09更新
|
919次组卷
|
6卷引用:陕西省宝鸡市金台区2020-2021学年高一下学期期末考试化学试题



