鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇
全国
高二
课后作业
2020-11-15
230次
整体难度:
容易
考查范围:
化学反应原理、化学与STSE
鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇
全国
高二
课后作业
2020-11-15
230次
整体难度:
容易
考查范围:
化学反应原理、化学与STSE
一、单选题 添加题型下试题
单选题
|
较易(0.85)
1. 我国科学家研制出 与
与 合成甲醇的高效催化剂。下列有关该反应的说法错误的是
合成甲醇的高效催化剂。下列有关该反应的说法错误的是
 与
与 合成甲醇的高效催化剂。下列有关该反应的说法错误的是
合成甲醇的高效催化剂。下列有关该反应的说法错误的是A.有利于减排 | B.反应生成甲醇和水 |
| C.有利于碳资源循环利用 | D.该高效催化剂提高了 的平衡转化率 的平衡转化率 |
您最近一年使用:0次
单选题
|
较易(0.85)
2. 对于甲醇的合成反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),改变下列条件,不能使反应的平衡常数发生改变的是
CH3OH(g)+H2O(g),改变下列条件,不能使反应的平衡常数发生改变的是
 CH3OH(g)+H2O(g),改变下列条件,不能使反应的平衡常数发生改变的是
CH3OH(g)+H2O(g),改变下列条件,不能使反应的平衡常数发生改变的是| A.升高温度 | B.降低温度 | C.增大压强 | D.将该反应的化学计量数增大-倍 |
【知识点】 化学平衡常数的影响因素及应用解读
您最近一年使用:0次
2019-12-08更新
|
116次组卷
|
3卷引用:河北省廊坊市高中联合体2020届高三上学期期中考试化学试题
单选题
|
较易(0.85)
名校
解题方法
3. 工业上由CO2和H2合成气态甲醇的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50kJ•mol-1。下面表示合成甲醇的反应的能量变化示意图,其中正确 的是
A.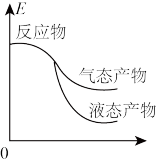 | B.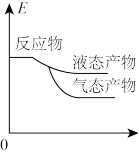 |
C.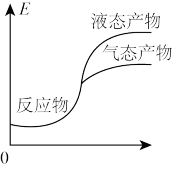 | D.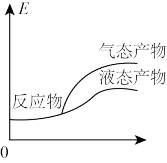 |
您最近一年使用:0次
2022-11-10更新
|
405次组卷
|
29卷引用:2015-2016学年湖北航天高中、安陆二中等五校高二上期中化学试卷
2015-2016学年湖北航天高中、安陆二中等五校高二上期中化学试卷2015-2016学年重庆市杨家坪中学高二上学期第三次月考化学试卷苏教版2017届高三单元精练检测六化学试题苏教版2017届高三单元精练检测六化学试题人教版2017届高三单元精练检测六化学试题湖北省随州市第二高级中学2018-2019学年高二9月起点考试(B+C班)化学试题辽宁省沈阳铁路实验中学2018-2019学年高一下学期4月月考化学试题黑龙江省牡丹江市第一高级中学2019-2020学年高二上学期开学检测化学试题西藏林芝市第二中学2019-2020学年高二上学期第一次月考理综化学试题云南省屏边县第一中学2019-2020学年高二上学期12月月考化学试题云南省云县第一中学2019-2020学年高二12月月考化学试题2山东省淄博市第七中学2019-2020学年高一3月线上考试化学试题辽宁省大连市瓦房店市实验高级中学2019-2020学年高二上学期12月月考化学试题山东省泰安第一中学2019-2020学年高一下学期期中考试化学试题(已下线)第09练 化学反应与能量的变化-2020年【衔接教材·暑假作业】新高二化学(人教版)鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇辽宁省阜新市第二高级中学2020-2021学年高二上学期第二次月考化学试题高中化学苏教2019版必修第二册-专题6 本专题复习提升山东省泰安市宁阳一中2020-2021学年高一下学期第一次考试化学试题选择性必修1(SJ)专题1第一单元课时1 化学反应的熔变陕西省延安市第一中学2021-2022学年高一下学期期末考试化学试题湖南师范大学附属中学2019-2020学年高二上学期第一次月考化学试题云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题湖北省荆州市沙市中学2022-2023学年高二上学期期末化学试题山西省怀仁市第一中学校2022-2023学年高一下学期4月期中考试化学试题甘肃省靖远县第一中学2022-2023学年高一下学期期末练习化学试题湖北省沙市中学2022-2023学年高二上学期1月期末考试化学试题甘肃省武威市天祝一中、民勤一中联考2023-2024学年高一下学期3月月考化学试题广西钦州市第四中学2023-2024学年高一下学期3月份考试化学试卷
单选题
|
较易(0.85)
名校
4. CO2催化加氢制取甲醇的研究,对于环境、能源问题都具有重要的意义。反应如下:CO2(g) + 3H2(g) ⇌ CH3OH(g) +H2O(g) ∆H1 =-58 kJ·mol-1,下列说法不正确的是:
| A.增大氢气浓度能提高二氧化碳的转化率 |
| B.升高温度,正、逆反应速率都加快 |
| C.增大压强,有利于向生成甲醇的方向进行 |
| D.选用理想的催化剂可以提高二氧化碳的转化率 |
您最近一年使用:0次
2019-09-24更新
|
224次组卷
|
2卷引用:广东省揭阳市揭西县河婆中学2018-2019学年高二上学期期末化学试题
二、填空题 添加题型下试题
填空题
|
适中(0.65)
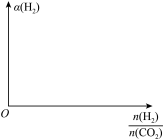
5. 甲醇是一种重要的试剂,氢气和二氧化碳在一定条件下可以合成甲醇: ,在密闭容器中充入
,在密闭容器中充入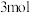 氢气和
氢气和 二氧化碳,测得混合气体中甲醇的体积分数
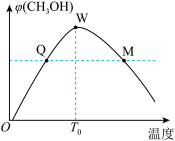
二氧化碳,测得混合气体中甲醇的体积分数 与温度的关系如图所示:
与温度的关系如图所示:
试回答下列问题。
(1)该反应是________ (填“放热”或“吸热”)反应。该反应的平衡常数的表达式为_______ 。为了降低合成甲醇的成本可采用的措施是_________ (写一条即可)。
(2)解释温度低于 时,甲醇的体积分数逐渐增大的原因:
时,甲醇的体积分数逐渐增大的原因:______ 。
(3)氢气在Q点的转化率______ (填“大于”“小于”或“等于”,下同)氢气在W点的转化率;其他条件相同时,甲醇在Q点的正反应速率_______ 甲醇在M点的正反应速率。
(4)下图表示氢气的转化率 与投料比
与投料比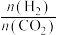 的关系,请在图中画出压强分别为
的关系,请在图中画出压强分别为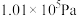 和
和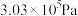 (其他条件相同)时对应的变化曲线并标出相应的条件
(其他条件相同)时对应的变化曲线并标出相应的条件______ 。
 ,在密闭容器中充入
,在密闭容器中充入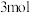 氢气和
氢气和 二氧化碳,测得混合气体中甲醇的体积分数
二氧化碳,测得混合气体中甲醇的体积分数 与温度的关系如图所示:
与温度的关系如图所示:
试回答下列问题。
(1)该反应是
(2)解释温度低于
 时,甲醇的体积分数逐渐增大的原因:
时,甲醇的体积分数逐渐增大的原因:(3)氢气在Q点的转化率
(4)下图表示氢气的转化率
 与投料比
与投料比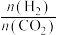 的关系,请在图中画出压强分别为
的关系,请在图中画出压强分别为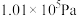 和
和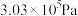 (其他条件相同)时对应的变化曲线并标出相应的条件
(其他条件相同)时对应的变化曲线并标出相应的条件
您最近一年使用:0次
三、单选题 添加题型下试题
单选题
|
适中(0.65)
6. CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
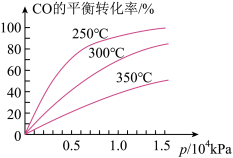
 CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
| A.该反应的△H>0 |
| B.实际生产选择的压强越高越好 |
| C.使用合适的催化剂,可以降低反应的活化能,提高CO的转化率 |
| D.平衡常数:K350℃<K250℃ |
【知识点】 化学平衡常数 转化率的相关计算及判断解读
您最近一年使用:0次
2019-10-22更新
|
180次组卷
|
2卷引用:辽宁省六校协作体2019-2020学年高二上学期10月月考化学试题
单选题
|
适中(0.65)
7. 工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g) CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是
CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是
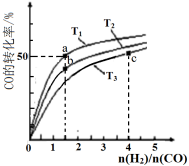
 CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是
CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是
| A.H2转化率:a>b>c |
| B.上述三种温度之间关系为T1>T2>T3 |
| C.a点状态下再通入0.5 mol CO和0.5 molCH3OH,平衡不移动 |
| D.c点状态下再通入1 molCO和4 mol H2,新平衡中H2的体积分数减小 |
您最近一年使用:0次
2018-12-29更新
|
708次组卷
|
6卷引用:【全国百强校】山东省师范大学附属中学2019届高三上学期第四次模拟理科综合化学试题
【全国百强校】山东省师范大学附属中学2019届高三上学期第四次模拟理科综合化学试题河北省衡水中学2020届高三上学期第四次调研考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡的图像分析(强化练习)鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇(已下线)【2022】【高二上】【期中考】【高中化学】59(已下线)【2022】【高二化学】【期中考】-178
单选题
|
适中(0.65)
8. 在容积为 的恒容密闭容器中充入
的恒容密闭容器中充入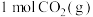 和
和 ,在一定条件下发生反应:
,在一定条件下发生反应: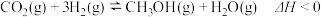 。反应进行
。反应进行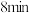 时达到平衡状态,测得
时达到平衡状态,测得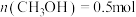 。该反应的平衡常数K与温度T的关系如图1所示,
。该反应的平衡常数K与温度T的关系如图1所示, 的平衡转化率如图2所示,下列说法错误的是
的平衡转化率如图2所示,下列说法错误的是
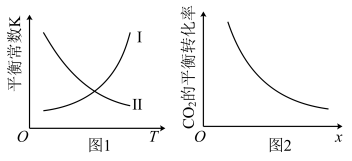
 的恒容密闭容器中充入
的恒容密闭容器中充入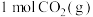 和
和 ,在一定条件下发生反应:
,在一定条件下发生反应: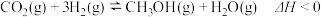 。反应进行
。反应进行 时达到平衡状态,测得
时达到平衡状态,测得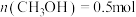 。该反应的平衡常数K与温度T的关系如图1所示,
。该反应的平衡常数K与温度T的关系如图1所示, 的平衡转化率如图2所示,下列说法错误的是
的平衡转化率如图2所示,下列说法错误的是
| A.在图1中,曲线Ⅱ表示该反应的平衡常数K与温度T的关系 |
B.该温度下,平衡常数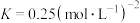 |
C.在其他条件不变的情况下,图2中x可表示温度、压强或 和 和 的投料比 的投料比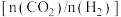 |
D.用二氧化碳合成甲醇体现了 减排理念 减排理念 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
9. CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g) ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。下列叙述不正确的是
CH3OH(g) ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。下列叙述不正确的是

 CH3OH(g) ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。下列叙述不正确的是
CH3OH(g) ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。下列叙述不正确的是
| A.该反应的ΔH<0 |
| B.在500℃条件下达平衡时CO 的转化率为60% |
| C.平衡常数K1(3000C)<K2(5000C) |
| D.图2中达化学平衡的点为c、d、e |
您最近一年使用:0次
2019-02-17更新
|
354次组卷
|
2卷引用:【校级联考】天津市七校(静海一中、宝坻一中、杨村一中等)2019届高三上学期期末考试化学试题
单选题
|
适中(0.65)
10. 在 恒容密闭容器中充入
恒容密闭容器中充入 、
、 ,在一定条件下发生如下反应:
,在一定条件下发生如下反应: ;CO的平衡转化率
;CO的平衡转化率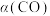 与温度、压强之间的关系如图所示。下列推断正确的是
与温度、压强之间的关系如图所示。下列推断正确的是
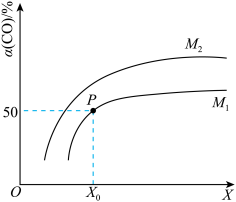
 恒容密闭容器中充入
恒容密闭容器中充入 、
、 ,在一定条件下发生如下反应:
,在一定条件下发生如下反应: ;CO的平衡转化率
;CO的平衡转化率 与温度、压强之间的关系如图所示。下列推断正确的是
与温度、压强之间的关系如图所示。下列推断正确的是
| A.工业上,利用上述反应合成甲醇,温度越高越好 |
B.图像中X代表压强,M代表温度,且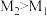 |
C.图像中P点代表的平衡常数K为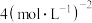 |
D.温度和容积不变,再充入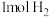 、 、 ,达到平衡时CO的转化率减小 ,达到平衡时CO的转化率减小 |
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
解题方法
11. 甲醇是重要的化工原料。利用合成气(主要成分为CO、 和
和 )在催化剂的作用下合成甲醇,可能发生的反应如下:
)在催化剂的作用下合成甲醇,可能发生的反应如下:
Ⅰ.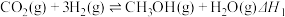
Ⅱ.
Ⅲ.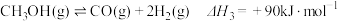
(1)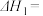
________ 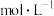 。
。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。

①温度为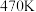 时,图中P点
时,图中P点______ (填“处于”或“不处于”)平衡状态,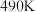 之后,甲醇的产率随温度的升高而减小的原因除了升高温度使反应Ⅰ平衡逆向移动以外,还有
之后,甲醇的产率随温度的升高而减小的原因除了升高温度使反应Ⅰ平衡逆向移动以外,还有________ 、______ 。
②一定能提高甲醇产率的措施是______ 。
A.增大压强 B.升高温度 C.加入大量催化剂
(3)下图为一定比例的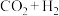 、
、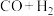 、
、 条件下甲醇生成速率与温度的关系。
条件下甲醇生成速率与温度的关系。
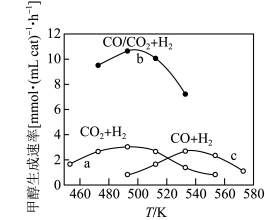
①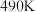 时,根据曲线a、c判断合成甲醇的反应机理是
时,根据曲线a、c判断合成甲醇的反应机理是________ 【填“(a)”或“(b)”】。
(a)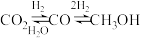
(b)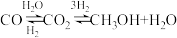
② 时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从平衡移动的角度,结合反应Ⅰ、Ⅱ分析原因:
时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从平衡移动的角度,结合反应Ⅰ、Ⅱ分析原因:_______ 。
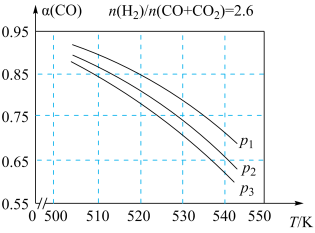
(4)合成气的组成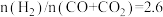 时体系中CO的平衡转化率(
时体系中CO的平衡转化率( )与温度和压强的关系如图所示。CO的平衡转化率随温度的升高而
)与温度和压强的关系如图所示。CO的平衡转化率随温度的升高而_________ (填“增大”或“减小”),图3中的压强由大到小的顺序为________ 。
 和
和 )在催化剂的作用下合成甲醇,可能发生的反应如下:
)在催化剂的作用下合成甲醇,可能发生的反应如下:Ⅰ.
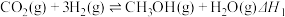
Ⅱ.

Ⅲ.
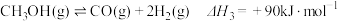
(1)
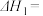
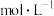 。
。(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。

①温度为
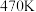 时,图中P点
时,图中P点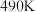 之后,甲醇的产率随温度的升高而减小的原因除了升高温度使反应Ⅰ平衡逆向移动以外,还有
之后,甲醇的产率随温度的升高而减小的原因除了升高温度使反应Ⅰ平衡逆向移动以外,还有②一定能提高甲醇产率的措施是
A.增大压强 B.升高温度 C.加入大量催化剂
(3)下图为一定比例的
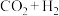 、
、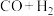 、
、 条件下甲醇生成速率与温度的关系。
条件下甲醇生成速率与温度的关系。
①
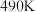 时,根据曲线a、c判断合成甲醇的反应机理是
时,根据曲线a、c判断合成甲醇的反应机理是(a)
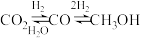
(b)
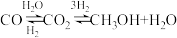
②
 时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从平衡移动的角度,结合反应Ⅰ、Ⅱ分析原因:
时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从平衡移动的角度,结合反应Ⅰ、Ⅱ分析原因:(4)合成气的组成
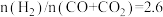 时体系中CO的平衡转化率(
时体系中CO的平衡转化率( )与温度和压强的关系如图所示。CO的平衡转化率随温度的升高而
)与温度和压强的关系如图所示。CO的平衡转化率随温度的升高而
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学反应原理、化学与STSE
试卷题型(共 11题)
题型
数量
单选题
9
填空题
1
解答题
1
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 催化剂对化学反应速率的影响 化学平衡的移动 低碳经济 | |
| 2 | 0.85 | 化学平衡常数的影响因素及应用 | |
| 3 | 0.85 | 化学反应热的计算 吸热反应和放热反应 | |
| 4 | 0.85 | 化学平衡的移动及其影响因素 化学平衡状态本质及特征 化学平衡状态的判断方法 | |
| 6 | 0.65 | 化学平衡常数 转化率的相关计算及判断 | |
| 7 | 0.65 | 影响化学反应速率的因素 化学平衡的移动及其影响因素 化学平衡图像分析 化学反应条件的控制及优化 | |
| 8 | 0.65 | 温度对化学平衡移动的影响 压强对化学平衡移动的影响 化学平衡常数的有关计算 与转化率变化有关图像的分析 | |
| 9 | 0.65 | 化学平衡图像分析 勒夏特列原理的应用 化学平衡常数的影响因素及应用 转化率的相关计算及判断 | |
| 10 | 0.65 | 化学平衡的移动 化学平衡常数的有关计算 与转化率变化有关图像的分析 | |
| 二、填空题 | |||
| 5 | 0.65 | 化学平衡的移动及其影响因素 化学平衡常数的概念及表达方式 与转化率变化有关图像的分析 | |
| 三、解答题 | |||
| 11 | 0.65 | 盖斯定律及其有关计算 化学平衡常数的有关计算 与转化率变化有关图像的分析 化学反应条件的控制及其应用 | 原理综合题 |



