X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,Y、Z间形成的某种化合物是一种常用的漂白剂、供氧剂,R和Z位于同一周期且基态原子中有3个电子能量最高,M2+与过量氨水作用先得到蓝色沉淀,后转化为深蓝色溶液Q。请回答下列问题:
(1)基态M2+的核外电子排布式为__ ,Y、Z、R、M四种元素的第一电离能由大到小的顺序为__ (用元素符号表示)。
(2)化合物XCl3的中心原子的杂化类型为__ ,RCl3的立体构型为__ ,XCl3、RCl3分子中属于非极性分子的是__ ;导致Q溶液显色的粒子中存在的化学键类型有__ 与配位键。
(3)已知H2Y2的熔点为-0.43℃、沸点为158℃,RH3的熔点为-133℃、沸点为-87.7℃,但H2Y2、RH3的相对分子质量相同,其主要原因是__ 。
(4)X、R两元素可形成一种具体立体网状结构的化合物,其晶胞结构如图所示。

①该化合物的晶体类型是__ ,该晶体的化学式为___ 。
②设两个X原子最近距离为apm,列式计算该晶胞的密度ρ=__ g·cm-3。
(1)基态M2+的核外电子排布式为
(2)化合物XCl3的中心原子的杂化类型为
(3)已知H2Y2的熔点为-0.43℃、沸点为158℃,RH3的熔点为-133℃、沸点为-87.7℃,但H2Y2、RH3的相对分子质量相同,其主要原因是
(4)X、R两元素可形成一种具体立体网状结构的化合物,其晶胞结构如图所示。

①该化合物的晶体类型是
②设两个X原子最近距离为apm,列式计算该晶胞的密度ρ=
更新时间:2020-04-21 14:39:24
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】锌及其化合物在科学技术发展和人类生产生活中发挥着重要作用。
(1)明朝《天工开物》中就已经记载了我国古代的炼锌技术:以炉甘石(ZnCO3)和木炭为原料高温制取锌。请写出Zn2+的核外电子排布式___ ,ZnCO3中C原子的杂化形式为__ ,Zn、C、O的电负性由小到大的顺序是___ 。
(2)“此物(“锌火”)无铜收伏,入火即成烟飞去”,意思是锌的沸点(907℃)较低,宜与铜熔合制成黄铜。已知Zn与Cu的能量变化如下所示:
Cu(g)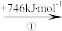 Cu+(g)
Cu+(g) Cu2+(g)
Cu2+(g)
Zn(g)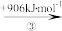 Zn+(g)
Zn+(g)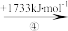 Zn2+(g)
Zn2+(g)
①铜和锌的第一电离能大小比较为I(Cu)__ I(Zn),试解释步骤②吸收能量大于步骤④的原因__ 。
②金属锌采取如图1所示堆积方式:
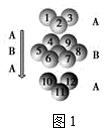
该堆积方式类型为___ 堆积,与金属铜的堆积方式__ (填“相同”或“不相同”)。
(3)我国科学家最新研制成功了一种纳米半导体材料可以高效实现光化学转换,该种材料主要成分为硫化镉和硫化锌。Cd与Zn位于同一副族,且在Zn的下一周期。已知ZnS熔点为2830℃;CdS熔点为1750℃,ZnS熔点更高的原因为__ 。
(4)图2为ZnS晶胞,图3为晶胞沿z轴的1∶1投影平面图:
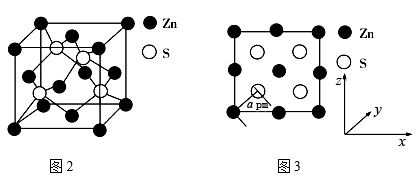
①晶胞中最近的两个S原子之间的距离为___ pm(写计算表达式)。
②已知S2-半径为bpm,若晶胞中S2-、Zn2+相切,则Zn2+半径为__ pm(写计算表达式)。(写计算表达式)。
(1)明朝《天工开物》中就已经记载了我国古代的炼锌技术:以炉甘石(ZnCO3)和木炭为原料高温制取锌。请写出Zn2+的核外电子排布式
(2)“此物(“锌火”)无铜收伏,入火即成烟飞去”,意思是锌的沸点(907℃)较低,宜与铜熔合制成黄铜。已知Zn与Cu的能量变化如下所示:
Cu(g)
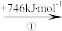 Cu+(g)
Cu+(g) Cu2+(g)
Cu2+(g)Zn(g)
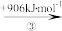 Zn+(g)
Zn+(g)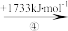 Zn2+(g)
Zn2+(g)①铜和锌的第一电离能大小比较为I(Cu)
②金属锌采取如图1所示堆积方式:

该堆积方式类型为
(3)我国科学家最新研制成功了一种纳米半导体材料可以高效实现光化学转换,该种材料主要成分为硫化镉和硫化锌。Cd与Zn位于同一副族,且在Zn的下一周期。已知ZnS熔点为2830℃;CdS熔点为1750℃,ZnS熔点更高的原因为
(4)图2为ZnS晶胞,图3为晶胞沿z轴的1∶1投影平面图:

①晶胞中最近的两个S原子之间的距离为
②已知S2-半径为bpm,若晶胞中S2-、Zn2+相切,则Zn2+半径为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】含卤族元素的化合物在科研和生产中有许多重要用途。如:2molSb(CH3)3、2molSb(CH3)2Br和2molSb(CH3)Br2进行重组反应可生成空间位阻最小的离子化合物: [Sb2(CH3)5]2 [Sb2(CH3)2Br6],已知Sb与N同主族。请回答:
(1)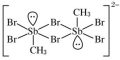 中,H、C、Br的电负性由小到大的顺序为
中,H、C、Br的电负性由小到大的顺序为________ ,溴原子的价电子排布式为_____________________ 。
(2)[Sb2(CH3)5] +的结构式为 ,Sb原子的杂化轨道类型为
,Sb原子的杂化轨道类型为_________ 。写出一种与CH3-互为等电子体的分子______________ 。
(3)X射线衍射测定等发现,I3ASF6中存在I3+离子。I3+离子的几何构型为___________ 。
(4)一定条件下SbCl3与GaCl3以物质的量之比为l:l混合得到一种固态离子化合物,其结构组成可能为:(a) [GaCl2+][SbCl4—]或(b) [SbCl2+][GaCl4—],该离子化合物最可能的结构组成为______ (填“a”或“b”),理由是______________________ 。
(5)固态PCl5结构中存在PCl4+和PCl6-两种离子,其晶胞如图所示。
已知晶胞的边长为a pm,阿伏伽德罗常数值用NA表示。则PCl4+和PCl6-之间的最短距离为_______ pm,固态PCl5的密度为______ g•cm-3。
(1)
 中,H、C、Br的电负性由小到大的顺序为
中,H、C、Br的电负性由小到大的顺序为(2)[Sb2(CH3)5] +的结构式为
 ,Sb原子的杂化轨道类型为
,Sb原子的杂化轨道类型为(3)X射线衍射测定等发现,I3ASF6中存在I3+离子。I3+离子的几何构型为
(4)一定条件下SbCl3与GaCl3以物质的量之比为l:l混合得到一种固态离子化合物,其结构组成可能为:(a) [GaCl2+][SbCl4—]或(b) [SbCl2+][GaCl4—],该离子化合物最可能的结构组成为
(5)固态PCl5结构中存在PCl4+和PCl6-两种离子,其晶胞如图所示。
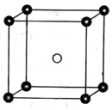
已知晶胞的边长为a pm,阿伏伽德罗常数值用NA表示。则PCl4+和PCl6-之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】在稀土开采技术方面,我国遥遥领先,无论是美国的芒廷帕斯还是澳大利亚的稀土矿山,均为在我国技术的参与下才实现产出。我国科学家最早研究的是稀土—钴化合物的结构。请回答下列问题:
(1)钴原子的价层电子的电子排布式为____ ,Co4+中存在____ 种不同能级的电子。
(2)Co3+在水中易被还原成Co2+,而在氨水中可稳定存在,其原因为___ 。
(3)已知:过渡金属价层达到18电子时,配位化合物较稳定。比较稳定性:[Ni(CO)4]__ [Co(C5H5)2](填“>”“<”)。
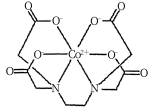
(4)一种钴的配合物乙二胺四乙酸合钴的结构如图,lmol该配合物形成的配位键有_ mol,配位原子是_ ,碳原子的杂化类型有_ 。
(5)钴蓝晶胞结构如下图所示,该立方晶胞由4个I型和4个II型小立方体构成,其化学式为___ ,晶体中Al3+占据O2-形成的____ (填“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为___ g·cm-3(列计算式;1nm=10-9m)。。

(1)钴原子的价层电子的电子排布式为
(2)Co3+在水中易被还原成Co2+,而在氨水中可稳定存在,其原因为
(3)已知:过渡金属价层达到18电子时,配位化合物较稳定。比较稳定性:[Ni(CO)4]
(4)一种钴的配合物乙二胺四乙酸合钴的结构如图,lmol该配合物形成的配位键有

(5)钴蓝晶胞结构如下图所示,该立方晶胞由4个I型和4个II型小立方体构成,其化学式为

您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】已知 A、B、C、D、E 是五种短周期的主族元素,它们的原子序数依次增大, A 是所有元素中原子半径最小的元素,B、C 组成的某一种化合物能引起温室效应;常温下, 金属 D 单质投入水中能与水剧烈反应;E 的单质在常温下是一种有色的气体。请按要求回答下列几个问题:
(1)B、D 的元素名称分别为:_____ 、_____ ;
(2)E 的最高价氧化物对应的水化物的化学式为:_____ ;
(3)C 离子的结构示意图为:_____ ;
(4)B、C、D 三种元素的原子半径从大到小的顺序为_____ (用元素符号表示);
(5)B、E 的最高价氧化物对应水化物的酸性从强到弱的顺序为:_____ (用对应的化学式表示)
(6) 写出 C、D 两种元素组成的阴、阳离子个数比为 1:2 且既含离子键又含有非极性共价键的化合物的电子式:_____ 。
(1)B、D 的元素名称分别为:
(2)E 的最高价氧化物对应的水化物的化学式为:
(3)C 离子的结构示意图为:
(4)B、C、D 三种元素的原子半径从大到小的顺序为
(5)B、E 的最高价氧化物对应水化物的酸性从强到弱的顺序为:
(6) 写出 C、D 两种元素组成的阴、阳离子个数比为 1:2 且既含离子键又含有非极性共价键的化合物的电子式:
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素。A、C位于同一主族,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等。请回答下列问题:
(1)D 在元素周期表中的位置是_______ ,其最高价氧化物对应水化物的名称为________________ 。
(2)A、B、C三种元素组成的化合物的电子式为___________ ,其中含有的化学键类型为___________________ ;该化合物与 D 单质发生化学反应的离子方程式为_________________ 。当反应中转移0.2 mol电子时,参加反应的D单质的体积(标准状况)为____
(1)D 在元素周期表中的位置是
(2)A、B、C三种元素组成的化合物的电子式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,D+具有与Ne原子相同的电子层结构。
(1)试判断A、B、C、D四种元素的名称。
A__________ ,B______________ , C___________ ,D____________ 。
(2)由A、B、D三种元素组成的化合物的电子式为_________________ ,
其所包含的具体化学键型为__________________________________ 。
(3)用电子式表示A2B的形成过程________________________________ 。
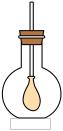
(4)如上图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到气球膨胀的现象,请用离子方程式解释其原因:_____________________
(1)试判断A、B、C、D四种元素的名称。
A
(2)由A、B、D三种元素组成的化合物的电子式为
其所包含的具体化学键型为
(3)用电子式表示A2B的形成过程

(4)如上图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到气球膨胀的现象,请用离子方程式解释其原因:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(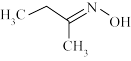 )。回答下列问题:
)。回答下列问题:
(1)基态硅原子的核外电子空间运动状态有____ 种。
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为____ ,氮原子的杂化方式为____ ,C=N与C—C键夹角____ (填“<”“>”或“=”)C=N与N—O键夹角。
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为____ ,其空间构型为____ 。
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因____ 。
(4)研究表明,在TiO2通过氮掺杂反应生成TiO2-mNn,能使TiO2对可见光具有活性,反应如图所示。

若TiO2晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=____ ,TiO2-mNn晶体中m=____ 。
 )。回答下列问题:
)。回答下列问题:(1)基态硅原子的核外电子空间运动状态有
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因
(4)研究表明,在TiO2通过氮掺杂反应生成TiO2-mNn,能使TiO2对可见光具有活性,反应如图所示。

若TiO2晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】Cu元素及其化合物在工农业生产和生活中有重要用途。请回答下列问题:
(1)基态Cu原子价电子排布图为_______ ,其原子核外电子占据的最高能层符号为_______ ,其最外层电子的电子云形状为_______ 。
(2)4-甲基咪唑(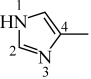 )可与Cu+形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
)可与Cu+形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
①4-甲基咪唑中_______ (填“1”或“3”)号N原子更容易与Cu+形成配位键。4-甲基咪唑中的大π键可表示为_______ 。(表示方法为Π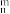 ,n为成环原子个数,m为形成大π键电子个数)
,n为成环原子个数,m为形成大π键电子个数)
②配位原子提供孤电子对的能力是影响配体与Cu+之间配位键强度的一个重要因素。若用某结构相似的含O配体与Cu+配位,所得配合物的稳定性比含N配体低,可能的原因是_______ 。
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如图。
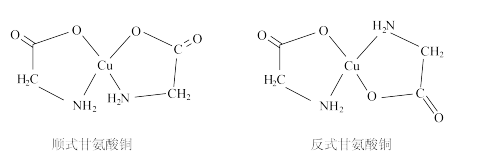
甘氨酸铜中铜原子的杂化方式为_______ 。(填“sp3”或“dsp2”)
(4)O、Cu、Ba、Hg形成的某种超导材料的晶胞如图所示。设阿伏加德罗常数的值为NA,该晶体的密度为_______ g•cm-3。

(1)基态Cu原子价电子排布图为
(2)4-甲基咪唑(
 )可与Cu+形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
)可与Cu+形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。①4-甲基咪唑中
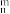 ,n为成环原子个数,m为形成大π键电子个数)
,n为成环原子个数,m为形成大π键电子个数)②配位原子提供孤电子对的能力是影响配体与Cu+之间配位键强度的一个重要因素。若用某结构相似的含O配体与Cu+配位,所得配合物的稳定性比含N配体低,可能的原因是
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如图。

甘氨酸铜中铜原子的杂化方式为
(4)O、Cu、Ba、Hg形成的某种超导材料的晶胞如图所示。设阿伏加德罗常数的值为NA,该晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
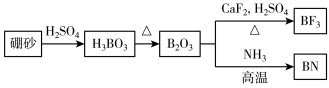
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式是___ 、___ 。
(2)基态B原子的电子排布式为___ ;B和N相比,非金属性较强的是___ ,BN中B元素的化合价为___ ;
(3)在BF3分子中,F﹣B﹣F的键角是___ ,该分子为___ 分子(填写“极性” 或“非极性”),BF3和过量NaF作用可生成NaBF4,BF4-中可能含有___ ,立体结构为___ ;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___ ,层间作用力为___ 。

请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式是
(2)基态B原子的电子排布式为
(3)在BF3分子中,F﹣B﹣F的键角是
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】过渡金属元素Cu、Mn、Au、Ni等在电池、储氢材料、催化剂等方面都有广泛应用。请回答下列问题:
(1)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,
表示,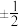 即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为
即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为___________ 。
(2)铜锰氧化物(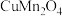 )能在常温下催化氧化甲醛生成甲酸。
)能在常温下催化氧化甲醛生成甲酸。
①从原子轨道重叠方式分类,甲醛分子中C-H键的类型是___________ 。
②气态时,测得甲酸的相对分子质量大于46,其原因可能是___________ 。
(3) 的溶液呈天蓝色。
的溶液呈天蓝色。
①使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则 的杂化轨道类型为
的杂化轨道类型为___________ (填标号)。
A. B.sp C.
B.sp C. D.
D.
② 的空间构型为
的空间构型为___________ 。
(4)二茂镍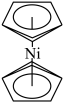 又名“双(环戊二烯)镍”,是具有导电性的有机配合物。其中镍离子的价电子排布式是
又名“双(环戊二烯)镍”,是具有导电性的有机配合物。其中镍离子的价电子排布式是_________ 。x个原子共用y个电子形成的大π键可表示为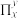 ,则环戊二烯离子(
,则环戊二烯离子(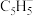 )中的大π键可表示为
)中的大π键可表示为___________ 。
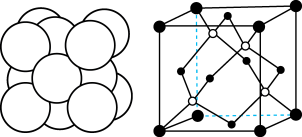
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为 ),在该晶胞中Cu原子处于面心,用
),在该晶胞中Cu原子处于面心,用 表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为___________ ;若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为___________ ( )。
)。
(1)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,
表示,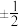 即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为
即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为(2)铜锰氧化物(
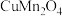 )能在常温下催化氧化甲醛生成甲酸。
)能在常温下催化氧化甲醛生成甲酸。①从原子轨道重叠方式分类,甲醛分子中C-H键的类型是
②气态时,测得甲酸的相对分子质量大于46,其原因可能是
(3)
 的溶液呈天蓝色。
的溶液呈天蓝色。①使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则
 的杂化轨道类型为
的杂化轨道类型为A.
 B.sp C.
B.sp C. D.
D.
②
 的空间构型为
的空间构型为(4)二茂镍
 又名“双(环戊二烯)镍”,是具有导电性的有机配合物。其中镍离子的价电子排布式是
又名“双(环戊二烯)镍”,是具有导电性的有机配合物。其中镍离子的价电子排布式是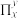 ,则环戊二烯离子(
,则环戊二烯离子(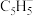 )中的大π键可表示为
)中的大π键可表示为(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为
 ),在该晶胞中Cu原子处于面心,用
),在该晶胞中Cu原子处于面心,用 表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为 )。
)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】I.硅电池、锂离子电池都是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO 的结构密切相关,PO
的结构密切相关,PO 的立体构型为
的立体构型为___________ ,LiFePO4中Fe的价层排布式___________ ,LiFePO4中各元素的电负性从大到小的顺序为___________ 。
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(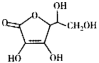 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是___________ ,抗坏血酸中碳原子的杂化方式为___________ ,1 mol抗坏血酸中手性碳原子的数目为___________ 。
Ⅱ.铁被誉为“第一金属”,铁及其化合物广泛应用于生活、生产、国防等。
(3)已知:元素的一个基态的气态原子得到一个电子形成-1价气态阴离子时所放出的能量称为该元素的第一电子亲和能,用E1表示。FeO是离子晶体,其晶格能可通过图1的Bom-Haber循环计算得到。
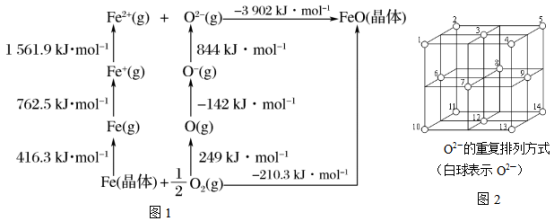
FeO的晶格能为___________ kJ·mol-1,基态O-(g)转化为O2-(g)需吸收能量,从原子结构角度解释___________ 。
(4)KSCN、K4[Fe(CN)6](亚铁氰化钾)是实验室常用试剂。SCN-中π键和σ键的数目之比为___________ ,K4[Fe(CN)6](亚铁氰化钾)的阴离子中存在的作用力类型有___________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(5)Fe3O4晶体中,O2-的重复排列方式如图2所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和如3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,O2-数与正四面体空隙数(包括被填充的)之比为___________ ,有___________ %的正八面体空隙填充阳离子。Fe3O4晶胞的八分之一是图示结构单元(图2),晶体密度为5.18 g·cm-3,则该晶胞参数a=___________ pm。(写出计算表达式)
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO
 的结构密切相关,PO
的结构密切相关,PO 的立体构型为
的立体构型为(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(
 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是Ⅱ.铁被誉为“第一金属”,铁及其化合物广泛应用于生活、生产、国防等。
(3)已知:元素的一个基态的气态原子得到一个电子形成-1价气态阴离子时所放出的能量称为该元素的第一电子亲和能,用E1表示。FeO是离子晶体,其晶格能可通过图1的Bom-Haber循环计算得到。

FeO的晶格能为
(4)KSCN、K4[Fe(CN)6](亚铁氰化钾)是实验室常用试剂。SCN-中π键和σ键的数目之比为
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(5)Fe3O4晶体中,O2-的重复排列方式如图2所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和如3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,O2-数与正四面体空隙数(包括被填充的)之比为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】Ⅰ.硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是___________ ,最高能级电子所在的原子轨道为___________ 形。
(2)①硫单质的一种结构为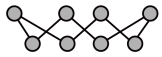 ,S原子杂化方式为
,S原子杂化方式为___________ ; 分子的空间构型是
分子的空间构型是___________ 。
② 、
、 、
、 键角由大到小的顺序是
键角由大到小的顺序是___________ 。
③比较沸点高低: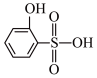
___________ (填“>”或“<”)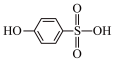 。
。
(3)Fe位于周期表的___________ 区,基态Fe原子的核外电子有___________ 种空间运动状态,Fe与CO形成的化合物Fe(CO)5常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于___________ (填晶体类型)。
(4)ZnS晶胞如图所示:
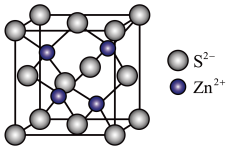
①由图可知,每个 周围与它最接近且距离相等的
周围与它最接近且距离相等的 有
有___________ 个。
②已知该晶胞密度为 ,阿伏加德罗常数为NA,则晶胞边长为
,阿伏加德罗常数为NA,则晶胞边长为___________ pm。
(学法题)根据所学知识分析归纳,计算晶体密度的关键是___________
(5)早在西汉时期的《淮南万毕术》中记载“曾青得铁则化为铜”,这是有关“湿法炼铜”最早文献记录。若向盛有硫酸铜的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。
①写出蓝色沉淀溶解的离子方程式___________ ;
②若向该深蓝色透明溶液中加入溶剂___________ ,将有深蓝色晶体析出,写出该晶体的化学式___________ 。
(1)基态硫原子的价层电子排布图是
(2)①硫单质的一种结构为
 ,S原子杂化方式为
,S原子杂化方式为 分子的空间构型是
分子的空间构型是②
 、
、 、
、 键角由大到小的顺序是
键角由大到小的顺序是③比较沸点高低:

 。
。(3)Fe位于周期表的
(4)ZnS晶胞如图所示:

①由图可知,每个
 周围与它最接近且距离相等的
周围与它最接近且距离相等的 有
有②已知该晶胞密度为
 ,阿伏加德罗常数为NA,则晶胞边长为
,阿伏加德罗常数为NA,则晶胞边长为(学法题)根据所学知识分析归纳,计算晶体密度的关键是
(5)早在西汉时期的《淮南万毕术》中记载“曾青得铁则化为铜”,这是有关“湿法炼铜”最早文献记录。若向盛有硫酸铜的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。
①写出蓝色沉淀溶解的离子方程式
②若向该深蓝色透明溶液中加入溶剂
您最近一年使用:0次



