K、Al、Cu、H、C、O、S、Cl是常见的八种元素。
(1)从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:
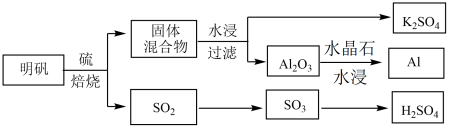
焙烧明矾的化学方程式为_________________________________________________ 。
(2)K位于元素周期表第________ 周期第________ 族。
(3)S的基态原子核外有________ 个未成对电子;Cl的基态原子核外电子排布式为____________ 。
(4)用“>”或“<”填空:
(5)SO2的价层电子对个数是________ ,该分子为结构为________ ;SO3中硫原子采用杂化方式为___________ 。
(6)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是____________________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________ 个铜原子。
(7)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度__________ g·cm-3(列出计算式子,不必计算出结果)。
(1)从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:

焙烧明矾的化学方程式为
(2)K位于元素周期表第
(3)S的基态原子核外有
(4)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| O | Cl- | KCl | H2SO4 |
(6)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是
(7)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度
更新时间:2020-06-07 12:54:42
|
相似题推荐
【推荐1】“摩尔盐”是分析化学中的重要试剂,化学式为(NH4)2Fe(SO4)2·6H2O。“摩尔盐”在一定条件下分解的方程式为:4[(NH4)2Fe(SO4)2·6H2O]  2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
(1)铁元素在元素周期表中的位置为_____ ,其价层电子排布图为________ 。
(2)组成“摩尔盐”的非金属元素中第一电离能最大的元素为________ 。“摩尔盐”的分解产物中属于非极性分子的化合物是________ 。
(3)NH3 的沸点比N2O 的沸点_____ (填“高”或“低”),其主要原因是________________ 。
(4)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中除了离子键以外还存在的化学键为_______ ,与CN- 互为等电子体的单质的分子式为________ 。HCN 分子中σ键和π键的个数之比为________ 。
(5)FeO 晶胞结构如下图所示,FeO 晶体中Fe2+配位数为______ ,若该晶胞边长为acm,则该晶胞密度为________ 。

 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:(1)铁元素在元素周期表中的位置为
(2)组成“摩尔盐”的非金属元素中第一电离能最大的元素为
(3)NH3 的沸点比N2O 的沸点
(4)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中除了离子键以外还存在的化学键为
(5)FeO 晶胞结构如下图所示,FeO 晶体中Fe2+配位数为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________ ,电负性最大的元素是__________ 。
(2)D的氢化物比C的氢化物的沸点_____ (填"高"或"低"),原因____________ 。
(3)E元素在周期表的位置是______________ 。
(4) 画出D的核外电子排布图_________________________________________ ,这样排布遵循了______________ 原理、____________ 原理和____________ 规则。
(5)用电子式表示B的硫化物的形成过程:______________________________ 。
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(2)D的氢化物比C的氢化物的沸点
(3)E元素在周期表的位置是
(4) 画出D的核外电子排布图
(5)用电子式表示B的硫化物的形成过程:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)镓是与铝同主族的第四周期元素,Ga基态原子核外电子排布式为____________ 。
(2)Ga、As、Se的第一电离能由大到小的顺序是____________ ,电负性由大到小的顺序是____________ 。
(3)碳和硅是同主族元素,下列能说明二者非金属性相对强弱的是____________ (填编号).
a..CH4的稳定性比SiH4强b.SiH4的沸点比CH4高
c.碳酸的酸性大于硅酸d.SiO2+Na2CO3=Na2SiO3+CO2↑
(4)AsH3的沸点比NH3低;其原因是____________ 。
(5)已知MgCl2熔点714℃,是离子化合物;AlCl3熔点191℃,是共价化合物。
比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因____________ 。
GaF3的熔点超过1000℃,可能的原因是____________ 。
(6)二水合草酸镓的结构如图1所示,其中镓原子的配位数为____________ ,二水合草酸镓π键的个数为____________ ,草酸根离子中碳原子的杂化轨道类型为____________ 。
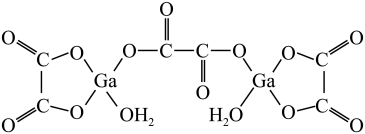
图1
(1)镓是与铝同主族的第四周期元素,Ga基态原子核外电子排布式为
(2)Ga、As、Se的第一电离能由大到小的顺序是
(3)碳和硅是同主族元素,下列能说明二者非金属性相对强弱的是
a..CH4的稳定性比SiH4强b.SiH4的沸点比CH4高
c.碳酸的酸性大于硅酸d.SiO2+Na2CO3=Na2SiO3+CO2↑
(4)AsH3的沸点比NH3低;其原因是
(5)已知MgCl2熔点714℃,是离子化合物;AlCl3熔点191℃,是共价化合物。
比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因
| 镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
| 熔点/℃ | 77.75 | 122.3 | 211.5 |
| 沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是
(6)二水合草酸镓的结构如图1所示,其中镓原子的配位数为

图1
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】铜的配合物在自然界中广泛存在,请回答下列问题:
(1)基态29Cu的核外电子排布式为_______ 。
(2)硫酸铜溶液中存在多种微粒:
①硫酸铜溶液呈蓝色的原因是其中存在配离子_______ (填化学式),配体中提供孤电子对的原子是_______ (填元素符号)。
②用价电子对互斥理论对以下微粒的空间构型进行分析,完成下表:
(3)同学甲设计如下制备铜的配合物的实验:

已知:铜离子的配位数通常为4。
①结合化学平衡原理解释试管c中浑浊液转变为深蓝色溶液的原因_______ 。
②由上述实验可得出以下结论:
结论1:配合物的形成与_______ 、_______ 有关;
结论2:结合上述实验,试管b、c中深蓝色配离子的稳定性强弱顺序为:_______ > _______ (填化学式)。
(1)基态29Cu的核外电子排布式为
(2)硫酸铜溶液中存在多种微粒:
①硫酸铜溶液呈蓝色的原因是其中存在配离子
②用价电子对互斥理论对以下微粒的空间构型进行分析,完成下表:
| 微粒 | 中心原子上的孤电子对数 | 中心原子上的价电子对总数 | 价电子对互斥理论(VSEPR)模型名称 | 分子或离子空间结构名称 |
| H2O | ||||
SO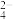 |
(3)同学甲设计如下制备铜的配合物的实验:

已知:铜离子的配位数通常为4。
①结合化学平衡原理解释试管c中浑浊液转变为深蓝色溶液的原因
②由上述实验可得出以下结论:
结论1:配合物的形成与
结论2:结合上述实验,试管b、c中深蓝色配离子的稳定性强弱顺序为:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】X、Y、Z、Q、R、W是原子序数依次增大的前四周期元素。X的原子核内无中子,Y与Z能形成两种无色无味的气体,Q与X同族,R在同周期主族元素中原子半径最小,基态原子W的3d能级有2个空轨道。请回答下列问题:
(1)W在元素周期表中的位置:_____ 。上述6种元素中电负性最大的是(填名称)_____ 。
(2)RZ-3的空间构型为_______ ,化合物YX4Z的沸点比YX3R高,其原因是____________ 。
(3)Y和W能够形成强度极高的化合物G,其晶胞结构如图所示, G的化学式为________ 。如从该晶胞中抽出Y原子,所得晶胞即为单质W的晶胞,其配位数为________ 。
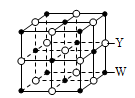
(4)强酸性溶液中,WZ 在加热条件下可以被X2Y2Z4还原为WZ,该反应的离子方程式是______________ 。
(1)W在元素周期表中的位置:
(2)RZ-3的空间构型为
(3)Y和W能够形成强度极高的化合物G,其晶胞结构如图所示, G的化学式为

(4)强酸性溶液中,WZ 在加热条件下可以被X2Y2Z4还原为WZ,该反应的离子方程式是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】方钴矿化合物是典型的热电材料,在环境污染和能源危机日益严重的今天,进行新型热电材料的研究具有很强的现实意义。
(1)基态Co的价电子排布式为___________ ,Co和Fe的逐级电离能数据如表,Fe的 大于Co的原因是
大于Co的原因是___________ 。
(2)Sb是第五周期ⅤA族元素,其同族元素可用于研制农药,例如3,5-二氯苯胺是农用杀菌剂的关键中间体。可由以下方法合成:

①化合物乙中各元素的电负性大小为___________ 。
②化合物甲中C原子杂化轨道类型为___________ 。
③化合物甲中的 键和
键和 键之比为
键之比为___________ 。(苯环中6个C原子共同形成了一个6原子6电子的大 键
键 )
)
(3)已知 的熔点73℃,沸点223.5℃,
的熔点73℃,沸点223.5℃, 的熔点是735℃,沸点是1049℃。两者的熔沸点差异较大的原因是
的熔点是735℃,沸点是1049℃。两者的熔沸点差异较大的原因是___________ 。预测 的空间构型为
的空间构型为___________ 。
(4)Brian Sales等研究了一类新型热电材料,叫作填隙方钴矿锑化物,在钴和锑形成的晶体空隙中填充入稀土原子La(如图所示),该化合物的化学式为___________ 。设阿伏加德罗常数的值为 ,已知该晶胞参数为a nm,则该晶体的密度是
,已知该晶胞参数为a nm,则该晶体的密度是___________  。
。
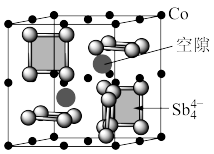
(1)基态Co的价电子排布式为
 大于Co的原因是
大于Co的原因是| 元素 |  |  |  |  |  | …… |
| Fe | 462.5 | 1561.9 | 2957 | 5290 | 7240 | |
| Co | 760.4 | 1648 | 3232 | 4950 | 7670 |
(2)Sb是第五周期ⅤA族元素,其同族元素可用于研制农药,例如3,5-二氯苯胺是农用杀菌剂的关键中间体。可由以下方法合成:

①化合物乙中各元素的电负性大小为
②化合物甲中C原子杂化轨道类型为
③化合物甲中的
 键和
键和 键之比为
键之比为 键
键 )
)(3)已知
 的熔点73℃,沸点223.5℃,
的熔点73℃,沸点223.5℃, 的熔点是735℃,沸点是1049℃。两者的熔沸点差异较大的原因是
的熔点是735℃,沸点是1049℃。两者的熔沸点差异较大的原因是 的空间构型为
的空间构型为(4)Brian Sales等研究了一类新型热电材料,叫作填隙方钴矿锑化物,在钴和锑形成的晶体空隙中填充入稀土原子La(如图所示),该化合物的化学式为
 ,已知该晶胞参数为a nm,则该晶体的密度是
,已知该晶胞参数为a nm,则该晶体的密度是 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】硝基苯可与金属 、盐酸反应生成苯胺和
、盐酸反应生成苯胺和 ,反应如下:
,反应如下:
 +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl2+2H2O
+3FeCl2+2H2O
(1)写出基态氮原子的电子排布图:_________ 。
(2) 的立体构型是
的立体构型是_________ 。
(3) 可被氯气氧化为
可被氯气氧化为 ,已知
,已知 的熔点为306℃、沸点为315℃,则
的熔点为306℃、沸点为315℃,则 属于
属于______ 晶体。
(4)苯分子中苯环上的大 键可表示为
键可表示为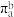 (其中a代表参与形成大
(其中a代表参与形成大 键的原子数,b代表参与形成大
键的原子数,b代表参与形成大 键的电子数),则a=
键的电子数),则a=________ ,b=________ 。
(5)苯胺在水中的溶解度大于硝基苯,其原因是__________ 。
(6) 在污水处理及医药化工中应用广泛。
在污水处理及医药化工中应用广泛。 晶体结构如图所示,已知该晶胞的边长为
晶体结构如图所示,已知该晶胞的边长为 ,
, 为阿伏加 德罗常数的数值,则该晶胞的密度为
为阿伏加 德罗常数的数值,则该晶胞的密度为_________ (用含a、 的代数式表示)
的代数式表示) 。
。

 、盐酸反应生成苯胺和
、盐酸反应生成苯胺和 ,反应如下:
,反应如下: +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl2+2H2O
+3FeCl2+2H2O(1)写出基态氮原子的电子排布图:
(2)
 的立体构型是
的立体构型是(3)
 可被氯气氧化为
可被氯气氧化为 ,已知
,已知 的熔点为306℃、沸点为315℃,则
的熔点为306℃、沸点为315℃,则 属于
属于(4)苯分子中苯环上的大
 键可表示为
键可表示为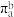 (其中a代表参与形成大
(其中a代表参与形成大 键的原子数,b代表参与形成大
键的原子数,b代表参与形成大 键的电子数),则a=
键的电子数),则a=(5)苯胺在水中的溶解度大于硝基苯,其原因是
(6)
 在污水处理及医药化工中应用广泛。
在污水处理及医药化工中应用广泛。 晶体结构如图所示,已知该晶胞的边长为
晶体结构如图所示,已知该晶胞的边长为 ,
, 为阿伏加 德罗常数的数值,则该晶胞的密度为
为阿伏加 德罗常数的数值,则该晶胞的密度为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】材料是人类进步的基石,深入认识物质的结构有助于进一步开发新的材料。回答下列问题:
(1)已知:第四周期中3d轨道上没有未成对电子的过渡元素离子的水合离子为无色。下列离子形成的水合离子为无色的是___________。
(2)l mol K3[Fe(CN)6]含有___________ mol σ键。
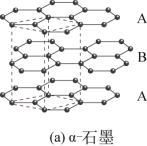
(3)石墨中C的杂化方式为___________ ,α-石墨和β-石墨结构如图(a)、(b)所示,已知:
C(α-石墨,s)=C(β-石墨,s) △H=+0.586kJ·mol-1, △H数值小,易转化。请从石墨晶体结构的角度分析△H数值小的原因是___________ 。

(4)纯水电离产生H3O+、OH-,研究发现在某些水溶液中还存在 、
、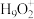 等微粒。画出
等微粒。画出 可能的一种结构式
可能的一种结构式___________ 。
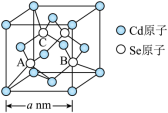
(5)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。已知Cd和Se的原子半径分别为rCdnm和rSenm,则该晶胞中原子的空间利用率为___________ 。(仅列出计算表达式)
(1)已知:第四周期中3d轨道上没有未成对电子的过渡元素离子的水合离子为无色。下列离子形成的水合离子为无色的是___________。
| A.Sc3+ | B.Cr3+ | C.Fe3+ | D.Zn2+ |
(3)石墨中C的杂化方式为
C(α-石墨,s)=C(β-石墨,s) △H=+0.586kJ·mol-1, △H数值小,易转化。请从石墨晶体结构的角度分析△H数值小的原因是


(4)纯水电离产生H3O+、OH-,研究发现在某些水溶液中还存在
 、
、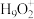 等微粒。画出
等微粒。画出 可能的一种结构式
可能的一种结构式(5)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。已知Cd和Se的原子半径分别为rCdnm和rSenm,则该晶胞中原子的空间利用率为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】氯吡脲(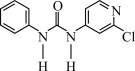 )属苯脲类细胞分裂素,可用作植物生长调节剂,广泛用于农业上促进果实肥大,提高产量,保鲜等。可用2,4-二氯吡啶与苯基脲反应合成氯吡脲:
)属苯脲类细胞分裂素,可用作植物生长调节剂,广泛用于农业上促进果实肥大,提高产量,保鲜等。可用2,4-二氯吡啶与苯基脲反应合成氯吡脲: +
+ →
→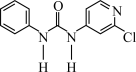 +HCl
+HCl
(1)苯基脲分子中除H外,第一电离能最大的元素为_______ (填元素符号),2,4-二氯吡啶与苯基脲反应的过程中,每生成1 mol氯吡脲,断裂_______ mol σ键。
(2)氯吡脲分子中,碳原子与氯原子形成的化学键为_______ (填化学键类型)σ键,氮原子的杂化轨道类型有_______ 。
(3)氯吡脲能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①H2O分子中的H-O-H键角为105°,则NH3分子中的H-N-H键角_______ (填“>”、“<”或“=”)105°,氨气溶于水时,大部分NH3与H2O用氢键(用“···”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为_______ (填标号)。
A.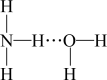 B.
B.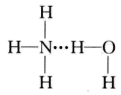
C.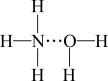 D.
D.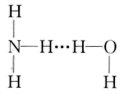
②将NH3与CO2以 =2溶于水,充分反应后所得的产物中,阴、阳离子的空间结构分别为
=2溶于水,充分反应后所得的产物中,阴、阳离子的空间结构分别为_______ 、_______ 。
 )属苯脲类细胞分裂素,可用作植物生长调节剂,广泛用于农业上促进果实肥大,提高产量,保鲜等。可用2,4-二氯吡啶与苯基脲反应合成氯吡脲:
)属苯脲类细胞分裂素,可用作植物生长调节剂,广泛用于农业上促进果实肥大,提高产量,保鲜等。可用2,4-二氯吡啶与苯基脲反应合成氯吡脲: +
+ →
→ +HCl
+HCl(1)苯基脲分子中除H外,第一电离能最大的元素为
(2)氯吡脲分子中,碳原子与氯原子形成的化学键为
(3)氯吡脲能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①H2O分子中的H-O-H键角为105°,则NH3分子中的H-N-H键角
A.
 B.
B.
C.
 D.
D.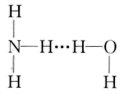
②将NH3与CO2以
 =2溶于水,充分反应后所得的产物中,阴、阳离子的空间结构分别为
=2溶于水,充分反应后所得的产物中,阴、阳离子的空间结构分别为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】世界卫生组织(WHO)确认人体中的14种必需微量元素中有铜、铬、硅、碘、氟等。
(1)铜位于元素周期表____ 区,基态铬原子的价电子排布式为____ 。
(2)碘酸及高碘酸的结构简式如图所示,酸性较强的是____ ,高碘酸分子中所含元素的电负性由强到弱的顺序是____ 。
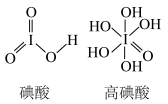
(3)工业上制取单质氟可通过电解KHF2和HF的混合溶液获得,KHF2中含有的化学键类型有____ ;与H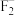 互为等电子体的分子为
互为等电子体的分子为____ (任填一种)。
(4)I 中碘原子的杂化轨道类型为
中碘原子的杂化轨道类型为____ ,I 的空间结构为
的空间结构为____ 。
(5)用金属镁还原二氧化硅可得到一种硅镁化合物,其晶胞结构如图所示。
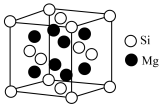
已知Si4-位于晶胞的顶点和面心,Mg2+位于八个小立方体的中心,其晶体参数a=0.635 nm。
①SiO2与SiF4相比,熔点更低的是____ (填化学式)。
②硅镁化合物的化学式为____ ;列式表示该硅镁化合物的密度____ g·cm-3(不必计算出结果,NA为阿伏伽德罗常数的数值)。
(1)铜位于元素周期表
(2)碘酸及高碘酸的结构简式如图所示,酸性较强的是

(3)工业上制取单质氟可通过电解KHF2和HF的混合溶液获得,KHF2中含有的化学键类型有
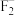 互为等电子体的分子为
互为等电子体的分子为(4)I
 中碘原子的杂化轨道类型为
中碘原子的杂化轨道类型为 的空间结构为
的空间结构为(5)用金属镁还原二氧化硅可得到一种硅镁化合物,其晶胞结构如图所示。

已知Si4-位于晶胞的顶点和面心,Mg2+位于八个小立方体的中心,其晶体参数a=0.635 nm。
①SiO2与SiF4相比,熔点更低的是
②硅镁化合物的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】铜及其合金是人类最早使用的金属材料,铜的化合物在现代生活和生产中有着广泛的应用。
(1)请写出铜的基态原子核外电子排布式:___________ 。
(2)铜的熔点比钙的高,其原因是____________ 。
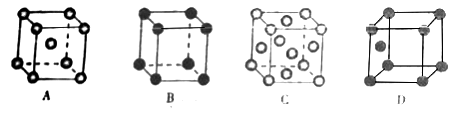
(3)金属铜的堆积方式为下图中的______ (填字母序号)。
(4)科学家通过 X 射线推测,胆矾的结构如下图所示。
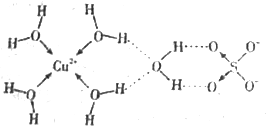
胆矾的阳离子中心原子的配位数为______ ,阴离子的空间构型为_______ 。胆矾中所含元素的电负性从大到小的顺序为_________ (用元素符号作答)。
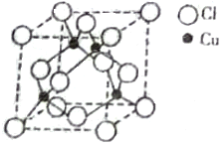
(5)铜与Cl原子构成晶体的晶胞结构如右图所示,该晶体的化学式为______ ,已知该晶体的密度为 4.14g/cm3,则该晶胞的边长为_______ pm(写计算式)。将该物质气化后实验测定其蒸汽的相对分子质量为 198,则其气体的分子式为_________ 。
(1)请写出铜的基态原子核外电子排布式:
(2)铜的熔点比钙的高,其原因是
(3)金属铜的堆积方式为下图中的

(4)科学家通过 X 射线推测,胆矾的结构如下图所示。

胆矾的阳离子中心原子的配位数为
(5)铜与Cl原子构成晶体的晶胞结构如右图所示,该晶体的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】我国从西周时期就开始用含砷化合物作颜料和药物,现在人们也将其应用在电子技术中。
(1)基态As原子的电子排布式为[Ar]___ ,其核外有___ 种不同空间运动状态的电子。微量砷可用原子光谱进行测定,电子从基态跃迁到激发态所产生的光谱称为___ 光谱。
(2)As与N同主族,N原子之间可以形成π键,而As原子之间较难形成π键。从原子结构角度分析,其原因为___ 。
(3)含砷物质经还原可得到AsH3,受热分解后可在试管内壁形成亮黑色的“砷镜”,这是马氏试砷法的基本原理。AsH3与同族N、P元素形成的简单氢化物相比,三者的稳定性由大到小的顺序为___ 。
(4)液态AsCl3可导电,是由于其发生了自解离:2AsCl3 AsCl
AsCl +AsCl
+AsCl 。AsCl3的中心原子杂化方式为
。AsCl3的中心原子杂化方式为___ ;与AsCl 互为等电子体的一种分子为
互为等电子体的一种分子为___ (填化学式)。
(5)AsCl3可与中心离子形成配合物,当氯原子被烷基取代后,配位能力增强,其原因为___ 。
(6)As与Co形成的某种化合物的晶胞如图(a)所示,其中部分晶胞中As的位置如图(b)所示。

①该化合物的化学式为___ 。
②若化合物的摩尔质量为Mg·mol-1,密度为ρg·cm-3。Co和As原子半径分别为r1pm和r2pm,阿伏加德罗常数的值为NA,则晶胞中原子的体积占晶胞体积的百分率为___ (列出表达式即可)。
(1)基态As原子的电子排布式为[Ar]
(2)As与N同主族,N原子之间可以形成π键,而As原子之间较难形成π键。从原子结构角度分析,其原因为
(3)含砷物质经还原可得到AsH3,受热分解后可在试管内壁形成亮黑色的“砷镜”,这是马氏试砷法的基本原理。AsH3与同族N、P元素形成的简单氢化物相比,三者的稳定性由大到小的顺序为
(4)液态AsCl3可导电,是由于其发生了自解离:2AsCl3
 AsCl
AsCl +AsCl
+AsCl 。AsCl3的中心原子杂化方式为
。AsCl3的中心原子杂化方式为 互为等电子体的一种分子为
互为等电子体的一种分子为(5)AsCl3可与中心离子形成配合物,当氯原子被烷基取代后,配位能力增强,其原因为
(6)As与Co形成的某种化合物的晶胞如图(a)所示,其中部分晶胞中As的位置如图(b)所示。

①该化合物的化学式为
②若化合物的摩尔质量为Mg·mol-1,密度为ρg·cm-3。Co和As原子半径分别为r1pm和r2pm,阿伏加德罗常数的值为NA,则晶胞中原子的体积占晶胞体积的百分率为
您最近一年使用:0次



