用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
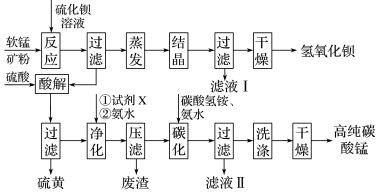
已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表。
回答下列问题
(1)软锰矿预先粉碎的目的是____________ ,MnO2与BaS溶液反应转化为MnO的化学方程式为________ 。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是________ 。
(3)滤液I可循环使用,应当将其导入到________ 操作中(填操作单元的名称)。
(4)净化时需先加入的试剂X为________ (填化学式)。再使用氨水调溶液的pH,则pH的理论最小值为_______ (当溶液中某离子浓度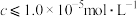 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为______________________ 。

已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 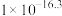 | 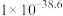 | 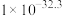 |  |
回答下列问题
(1)软锰矿预先粉碎的目的是
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是
(3)滤液I可循环使用,应当将其导入到
(4)净化时需先加入的试剂X为
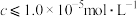 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(5)碳化过程中发生反应的离子方程式为
2020·山东·高考真题 查看更多[26]
(已下线)专题18 工艺流程题(已下线)第八章 水溶液中的离子反应与平衡 第55练 无机化工流程题的解题策略(已下线)专题03 离子反应方程式和离子共存 (练)-2023年高考化学二轮复习讲练测(新高考专用)河北省石家庄二中实验学校2022-2023学年高三上学期9月开学考试化学试题内蒙古包头市第四中学2020-2021学年高三上学期期中考试理科综合化学试题(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)考向27 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点微专题(已下线)专题讲座(六)化工流程的解题策略(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题16 工艺流程综合题-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)专题讲座(二)陌生化学方程式书写(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)四川省蓬安中学校2020届高三上学期入学考试化学试题(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题讲座(八) 无机化工流程题的解题策略(精讲)-2022年一轮复习讲练测江西省景德镇市浮梁县第一中学2020-2021学年高二下学期5月月考化学试题(争优部1、2班)(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)重点8 工艺流程综合题-2021年高考化学【热点·重点·难点】专练(山东专用)重庆市重点中学2021届高三下学期开学考试(新高考)化学试题(已下线)专题14 无机化工流程不丢分-2021年高考化学必做热点专题西藏拉萨中学2021届高三上学期第三次月考理综化学试题(已下线)专题讲座(八) 无机化工流程题的解题策略(精讲)——2021年高考化学一轮复习讲练测山东省临沂市莒南第二中学2021届高三10月月考化学试题江西省高安中学2020-2021学年高二上学期第一次段考化学(A)试题(已下线)专题讲座(二)整合有效信息书写陌生化学方程式(精讲)——2021年高考化学一轮复习讲练测(已下线)专题15 工艺流程题-2020年高考真题和模拟题化学分项汇编2020年山东省高考化学试卷(新高考)
更新时间:2020-07-11 10:42:54
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某实验小组想探究实验室用MnO2与盐酸反应制取氯气的反应条件,实验装置及药品如下。
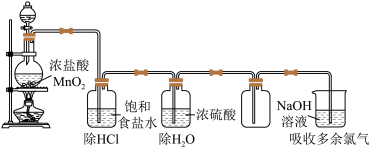
(1)写出实验室制氯气的离子方程式_______ 。
(2)结合平衡移动原理,解释饱和食盐水的作用是_______ 。
(3)已知:不同温度下MnO2与盐酸反应的平衡常数
MnO2与盐酸的反应是_______ 反应(填“放热”或“吸热”)。
(4)为探究条件对该反应的影响,小组同学设计并完成以下实验:
①根据上述实验可知MnO2与盐酸产生氯气的反应条件为_______ 。
②针对实验1和实验3的现象,小组同学从电极反应角度分析物质氧化性和还原性的变化规律。
写出实验中制氯气反应的电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:_______ 。
提出假设:
ⅰ.增大c(H+),可以_______ 。
ⅱ.增大c(Cl-),可以增大Cl-的还原性。
③补充实验,实验II、III分别证实了②中的分析。
(固液混合物A为一定浓度的盐酸和MnO2混合物;加热装置已略去)
较浓a溶液是_______ ,固体b是_______ 。

(1)写出实验室制氯气的离子方程式
(2)结合平衡移动原理,解释饱和食盐水的作用是
(3)已知:不同温度下MnO2与盐酸反应的平衡常数
| 温度t/℃ | 50 | 80 | 110 |
| 平衡常数K | 3.104×10-4 | 2.347×10-3 | 1.293×10-2 |
(4)为探究条件对该反应的影响,小组同学设计并完成以下实验:
| 序号 | 试剂 | 实验操作 | 现象 |
| 实验1 | 4 mol/L盐酸、MnO2 | 加热 | 无明显现象 |
| 实验2 | 7 mol/L浓盐酸、MnO2 | 不加热 | 无明显现象 |
| 实验3 | 7 mol/L浓盐酸、MnO2 | 加热 | 产生黄绿色气体 |
②针对实验1和实验3的现象,小组同学从电极反应角度分析物质氧化性和还原性的变化规律。
写出实验中制氯气反应的电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:
提出假设:
ⅰ.增大c(H+),可以
ⅱ.增大c(Cl-),可以增大Cl-的还原性。
③补充实验,实验II、III分别证实了②中的分析。
| 实验序号 | 实验操作 | 试剂 | 产物 |
| I |  | 没有添加新的试剂 | 无氯气生成 |
| II | 较浓a溶液 | 有氯气生成 | |
| III | 固体b | 有氯气生成 |
较浓a溶液是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
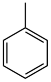 +KMnO4→
+KMnO4→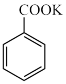 +MnO2
+MnO2
 +HCl→
+HCl→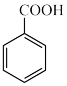 +KCl
+KCl
实验步骤:
①在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5mL甲苯、100mL水和4.8g(约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
②停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0g。
③纯度测定
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为___________(填标号)。
(2)在反应装置中应选用冷凝管___________ (填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是___________ 。
(3)加入适量饱和亚硫酸氢钠溶液的目的是___________ ;该步骤亦可用草酸( )在酸性条件下处理,请用反应的离子方程式表达其原理
)在酸性条件下处理,请用反应的离子方程式表达其原理___________ 。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是___________ 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是___________ 。
(6)若要得到纯度更高的苯甲酸,可通过___________ 方法提纯。
 +KMnO4→
+KMnO4→ +MnO2
+MnO2 +HCl→
+HCl→ +KCl
+KCl | 名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/( ) ) | 溶解性 |
| 甲苯 | 92 | -95 | 110.6 | 0.867 | 不溶于水,易溶于乙醇 |
| 苯甲酸 | 122 | 122.4(100℃左右开始升华) | 248 | —— | 微溶于冷水,易溶于乙醇、热水 |
①在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5mL甲苯、100mL水和4.8g(约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
②停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0g。
③纯度测定
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为___________(填标号)。
| A.100mL | B.250mL | C.500mL | D.1000mL |
(3)加入适量饱和亚硫酸氢钠溶液的目的是
 )在酸性条件下处理,请用反应的离子方程式表达其原理
)在酸性条件下处理,请用反应的离子方程式表达其原理(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是
(6)若要得到纯度更高的苯甲酸,可通过
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】废弃化学品循环再利用对节约资源和保护环境有重要意义。钴盐在新能源、催化、印染等领域应用广泛。利用电解工业产生的钴、镍废渣(含Fe、Cu等)制备CoCl2·6H2O,流程如下图所示:

已知:通常认为溶液中离子浓度小于10-5 mol·L-1为沉淀完全;室温下相关物质的Ksp见下表。
回答下列问题:
(1)滤渣Ⅰ的主要成分为Fe(OH)3,H2O2的作用是___________ 。
(2)操作①是___________ ;滤液III对应的溶质是___________ (填化学式);浓盐酸溶解沉淀时,加入NaCl(s)的目的是___________ 。
(3)Co(OH)2易被氧化成Co(OH)3.Co(OH)3可氧化浓盐酸,其化学方程式为___________ 。
(4)浓缩结晶后的母液V可返回___________ 工序循环利用。
(5)利用硫化物分离钴镍离子,向浓度同为0.1 mol·L-1的Ni2+和Co2+混合溶液中逐滴加入(NH4)2S溶液(忽略溶液体积变化),首先生成硫化物沉淀的离子为___________ 。

已知:通常认为溶液中离子浓度小于10-5 mol·L-1为沉淀完全;室温下相关物质的Ksp见下表。
| 物质 | Co(OH)2 | NiS | CoS |
| Ksp | 1×10-14.2 | 1×10-18.5 | 1×10-20.4 |
(1)滤渣Ⅰ的主要成分为Fe(OH)3,H2O2的作用是
(2)操作①是
(3)Co(OH)2易被氧化成Co(OH)3.Co(OH)3可氧化浓盐酸,其化学方程式为
(4)浓缩结晶后的母液V可返回
(5)利用硫化物分离钴镍离子,向浓度同为0.1 mol·L-1的Ni2+和Co2+混合溶液中逐滴加入(NH4)2S溶液(忽略溶液体积变化),首先生成硫化物沉淀的离子为
您最近半年使用:0次
【推荐1】氯化铈用于石油催化剂、汽车尾气催化剂等行业。为节约和充分利用资源,以废料(主要含CeO2,还含少量的SiO2、Fe2O3、Al2O3)为原料,通过如下工艺流程进行制备。
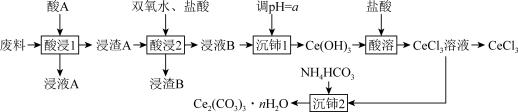
已知:CeO2具有强氧化性,通常情况下不和无机酸反应。回答下列问题:
(1)将废料粉碎有利于加快“酸浸1”的速率,其理由是_______ 。
(2)“浸液A”中存在的金属阳离子为_______ ,“浸渣B”的主要用途为_______ (写一种)。
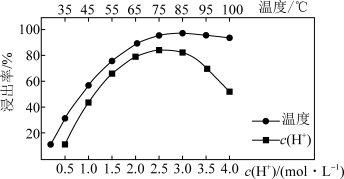
(3)“酸浸2”中Ce的浸出率与c(H+)、温度的关系如图所示,应选择的适宜条件为_______(填字母标号)。
(4)“酸溶”加入盐酸后,通常还需加入H2O2,其主要目的为_______ 。
(5)“沉铈2”过程中生成Ce2(CO3)3·nH2O的离子方程式为_______ 。若Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5 mol/L,此时测得溶液的pH=5,则c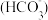 =
=_______ mol/L(保留3位小数)。(已知常温下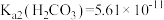 ,
,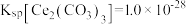 )
)

已知:CeO2具有强氧化性,通常情况下不和无机酸反应。回答下列问题:
(1)将废料粉碎有利于加快“酸浸1”的速率,其理由是
(2)“浸液A”中存在的金属阳离子为
(3)“酸浸2”中Ce的浸出率与c(H+)、温度的关系如图所示,应选择的适宜条件为_______(填字母标号)。

| A.65℃ 2.0 mol/L | B.75℃ 2.0 mol/L | C.85℃ 2.5 mol/L | D.100℃ 2.5 mol/L |
(5)“沉铈2”过程中生成Ce2(CO3)3·nH2O的离子方程式为
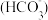 =
=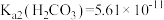 ,
,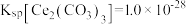 )
)
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】沉淀溶解平衡在生活、生产和化学学习中有着重要应用。请回答下列问题:
(1)工业上湿法炼锌过程中,以ZnSO4为主要成分的浸出液中,含有Fe3+、Fe2+、Cu2+、Cl-等杂质,这些杂质对锌的电解工序有妨碍,必须提早除去.现有下列试剂可供选择:酸性KMnO4溶液、NaOH溶液、ZnO、H2O2溶液、Fe、AgNO3溶液、Ag2SO4。
①为了除去Fe2+,应加入合适的氧化剂,将其氧化为Fe3+,则应选择的氧化剂是___ ;利用沉淀转化原理,可加入___ ,除去Cl-。
②为使某些金属离子转化为沉淀而除去,需加入适当的物质调节溶液的pH。则加入的物质是___ 。
(2)工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)⇌CuS(s)+Mn2+(aq),该反应达到平衡时,c(Mn2+)___ (填“>”“<”或“=”)c(Cu2+)
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO 生成砖红色沉淀,指示到达滴定终点。25℃时,当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol•L-1)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。25℃时,当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol•L-1)时,溶液中c(Ag+)为___ mol•L-1,此时溶液中c(CrO )等于
)等于___ mol•L-1(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(1)工业上湿法炼锌过程中,以ZnSO4为主要成分的浸出液中,含有Fe3+、Fe2+、Cu2+、Cl-等杂质,这些杂质对锌的电解工序有妨碍,必须提早除去.现有下列试剂可供选择:酸性KMnO4溶液、NaOH溶液、ZnO、H2O2溶液、Fe、AgNO3溶液、Ag2SO4。
①为了除去Fe2+,应加入合适的氧化剂,将其氧化为Fe3+,则应选择的氧化剂是
②为使某些金属离子转化为沉淀而除去,需加入适当的物质调节溶液的pH。则加入的物质是
(2)工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)⇌CuS(s)+Mn2+(aq),该反应达到平衡时,c(Mn2+)
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO
 生成砖红色沉淀,指示到达滴定终点。25℃时,当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol•L-1)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。25℃时,当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol•L-1)时,溶液中c(Ag+)为 )等于
)等于
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解,实验室以MnO2为原料制备MnCO3。
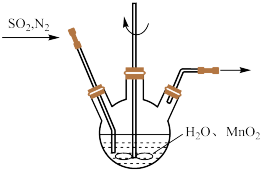
(1)制备MnSO4溶液:
①主要反应装置如图,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2=MnSO4+H2O。下列措施中,目的是加快化学反应速率的是___ (填标号)。
A.MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓)=2NaHSO4+SO2↑+H2O。选择如图所示部分装置与图装置相连制备MnSO4溶液,应选择的装置有___ (填标号)。
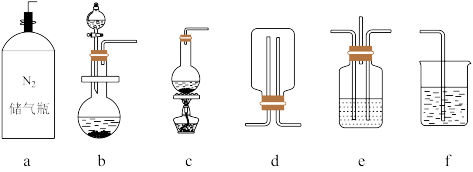
③若用空气代替N2进行实验,缺点是___ 。(酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;②……;③在70~80℃下烘干得到纯净干燥 的MnCO3固体。
步骤①中生成沉淀的离子方程式为:___ 。为得到纯净干燥 的步骤MnCO3固体,②需要用到的试剂有___ 。
(3)问题讨论:
已知Mn(OH)2开始沉淀时pH=7.7,若选用饱和Na2CO3溶液(pH约为12)和MnSO4溶液作为反应原料制备MnCO3沉淀,最合理的加料方式的是___ 。
(4)实验设计
①利用沉淀转化的方法证明Ksp(MnCO3)<Ksp(NiCO3)___ (已知NiCO3为难溶于水的浅绿色固体)。
②证明H2SO4的第二步电离不完全___ 。

(1)制备MnSO4溶液:
①主要反应装置如图,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2=MnSO4+H2O。下列措施中,目的是加快化学反应速率的是
A.MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓)=2NaHSO4+SO2↑+H2O。选择如图所示部分装置与图装置相连制备MnSO4溶液,应选择的装置有

③若用空气代替N2进行实验,缺点是
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;②……;③在70~80℃下烘干得到
步骤①中生成沉淀的离子方程式为:
(3)问题讨论:
已知Mn(OH)2开始沉淀时pH=7.7,若选用饱和Na2CO3溶液(pH约为12)和MnSO4溶液作为反应原料制备MnCO3沉淀,最合理的加料方式的是
(4)实验设计
①利用沉淀转化的方法证明Ksp(MnCO3)<Ksp(NiCO3)
②证明H2SO4的第二步电离不完全
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如图所示步骤操作:
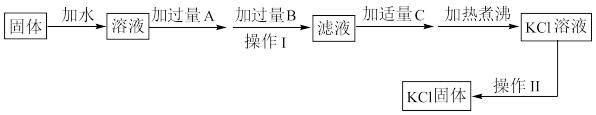
(1)①加入过量A的目的是_______ ,有关离子反应方程式为_______ 、_______ ;
②加入过量B的目的是_______ ;
③加热煮沸目的是_______ 。
(2)操作Ⅰ名称是_______ ,所需主要玻璃仪器有(写3种)_______ 、_______ 、_______ 。

(1)①加入过量A的目的是
②加入过量B的目的是
③加热煮沸目的是
(2)操作Ⅰ名称是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】工业上从海水中提取镁的流程如图所示,据此回答下列问题:
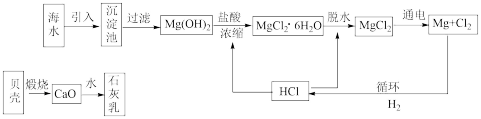
(1)在沉淀池中加入石灰乳的作用是__ 。
(2)生产过程中,过滤得到的Mg(OH)2沉淀中混有少量Ca(OH)2,实验室中除去Mg(OH)2沉淀中混有的少量Ca(OH)2的方法:先将沉淀加入到盛有__ 溶液的烧杯中,充分搅拌后经___ (填操作方法,下同)、__ 、__ ,即可得到纯净的Mg(OH)2。
(3)下列关于题述流程中海水提镁的说法不正确的是__ (填字母)。
A.此法的优点之一是原料来源丰富
B.副产品可用于氯碱工业
C.电解时会产生氯气
D.该流程中涉及的化学反应有分解反应、化合反应和置换反应
(4)电解无水氯化镁(熔融态)所得的镁蒸气在特定环境中冷却后可得到固体金属镁,则下列物质可用作镁蒸气的冷却剂的是___ (填序号)。
A.H2 B.N2 C.空气 D.O2 E.水蒸气
(5)在SO2中点燃的镁条像在CO2中那样继续燃烧,但反应较镁和CO2反应更为剧烈,反应结束后,在盛有SO2的广口瓶中可能存在的物质是___ (写化学式),反应的化学方程式为__ 、__ 。

(1)在沉淀池中加入石灰乳的作用是
(2)生产过程中,过滤得到的Mg(OH)2沉淀中混有少量Ca(OH)2,实验室中除去Mg(OH)2沉淀中混有的少量Ca(OH)2的方法:先将沉淀加入到盛有
(3)下列关于题述流程中海水提镁的说法不正确的是
A.此法的优点之一是原料来源丰富
B.副产品可用于氯碱工业
C.电解时会产生氯气
D.该流程中涉及的化学反应有分解反应、化合反应和置换反应
(4)电解无水氯化镁(熔融态)所得的镁蒸气在特定环境中冷却后可得到固体金属镁,则下列物质可用作镁蒸气的冷却剂的是
A.H2 B.N2 C.空气 D.O2 E.水蒸气
(5)在SO2中点燃的镁条像在CO2中那样继续燃烧,但反应较镁和CO2反应更为剧烈,反应结束后,在盛有SO2的广口瓶中可能存在的物质是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】Ⅰ、铝土矿(主要成分为Al2O3,含有少量杂质)是提取铝的原料。提取铝的工艺流程如下:
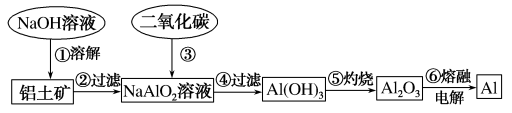
(1)请用离子方程式表示以上工艺流程中第①步反应:_______ 。
(2)写出以上工艺流程中第③步反应的化学方程式:_______ 。
(3)若第①步加入的是盐酸,则发生反应的离子方程式为_______ 。
Ⅱ、下图为几种物质的转化关系,其中A为金属,B为淡黄色固体粉末,每一物质均含有A元素。
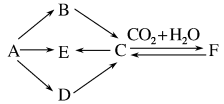
(4)写出下列物质的化学式:B_______ , C_______ , E_______ , F_______ 。
(5)写出下列各步反应的化学方程式:
C→E_______ ;
F→C_______ 。

(1)请用离子方程式表示以上工艺流程中第①步反应:
(2)写出以上工艺流程中第③步反应的化学方程式:
(3)若第①步加入的是盐酸,则发生反应的离子方程式为
Ⅱ、下图为几种物质的转化关系,其中A为金属,B为淡黄色固体粉末,每一物质均含有A元素。

(4)写出下列物质的化学式:B
(5)写出下列各步反应的化学方程式:
C→E
F→C
您最近半年使用:0次



