南京大学某科研团队成功预测并首次大面积合成纳米多孔Cu-Al合金催化剂材料,实现高效率和大产率的电催化还原二氧化碳(CO2)生产乙烯(C2H4)。回答下列问题:
(1)Al元素在周期表中位于________ 区,基态Cu原子的价电子排布式为________ 。
(2)CO2和C2H4中C原子杂化方式分别为________ ,物质的量相同的CO2和C2H4所含σ键数之比为________ 。
(3)Cu(OH)2溶于浓氨水形成无色的配离子[Cu(NH3)4]2+,该配离子中配体的立体构型为________ 。
(4)工业冶炼铝需要冰晶石,AlF3或NaF均可用于制备冰晶石,AlF3和NaF两种晶体熔点更高的是________ (填写化学式),从结构的角度解释可能的原因________ 。
(5)Cu与O构成的某种化合物,其晶胞结构如图所示:
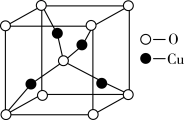
已知该晶胞参数为apm,阿伏加 德罗常数的数值为NA,则该晶体的密度ρ=________ g•cm-3(列出计算式即可)。
(1)Al元素在周期表中位于
(2)CO2和C2H4中C原子杂化方式分别为
(3)Cu(OH)2溶于浓氨水形成无色的配离子[Cu(NH3)4]2+,该配离子中配体的立体构型为
(4)工业冶炼铝需要冰晶石,AlF3或NaF均可用于制备冰晶石,AlF3和NaF两种晶体熔点更高的是
(5)Cu与O构成的某种化合物,其晶胞结构如图所示:

已知该晶胞参数为apm,阿伏加 德罗常数的数值为NA,则该晶体的密度ρ=
更新时间:2020-08-17 20:37:43
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】I.硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。
(1)从图1中选择符合图2要求的X代表的物质:X___________ 。

(2)硫原子的最外层电子排布式为___________ ,其原子核外有___________ 种不同能量的电子。在周期表中,与硫相邻的短周期元素的原子半径由大到小的顺序是___________ 。
(3)硫化氢溶液在空气中易变浑浊,说明S的非金属性比O___________ (填“强”或“弱”),从原子结构的角度解释其原因:___________ 。
(4)下图是燃煤发电厂处理废气的装置示意图,下列说法不正确的是___________。

II.某化学兴趣小组用以下装置探究SO2的某些化学性质。

(5)装置乙的作用是___________ 。若X为品红溶液,观察到溶液褪色,说明SO2具有___________ (填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有___________ 。
a.氧化性 b.还原性 c.漂白性 d.酸性
(6)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式_______ 。
Ca2++ ClO-+ SO2+ H2O= CaSO4↓+ Cl-+ + H+
+ H+
(1)从图1中选择符合图2要求的X代表的物质:X

(2)硫原子的最外层电子排布式为
(3)硫化氢溶液在空气中易变浑浊,说明S的非金属性比O
(4)下图是燃煤发电厂处理废气的装置示意图,下列说法不正确的是___________。

| A.使用此装置可减少导致酸雨的气体的形成 |
| B.装置内发生了化合反应和分解反应 |
| C.若排放的气体能使澄清石灰水变浑浊,说明排放的气体中一定含有SO2 |
| D.整个过程的总反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2 |
II.某化学兴趣小组用以下装置探究SO2的某些化学性质。

(5)装置乙的作用是
a.氧化性 b.还原性 c.漂白性 d.酸性
(6)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式
Ca2++ ClO-+ SO2+ H2O= CaSO4↓+ Cl-+
 + H+
+ H+
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】目前,中国本土建造的航母山东舰已经投入使用。航母的甲板用钢具有高强度、大板面、拒磁、高韧性、抗低温(零下38℃)、高断裂韧性、耐高温不变形、抗腐蚀、防弹的特性。回答下列问题:
(1)铁合金中铬含量在10.5%以上时,其耐腐蚀性能显著增加。基态铬原子的价电子排布式为___________ 。
(2)硅油是一种不同聚合度链状结构的聚有机硅氧烷。它具有耐热性、电绝缘性、耐候性、疏水性、生理惰性和较小的表面张力,因此会用于保护航母甲板,其结构如图所示。

硅油中碳原子的杂化方式为___________ 杂化,O-Si键的键能比 键的键能
键的键能___________ (填“大”或“小”),其原因是___________ 。
(3)单质铁中铁原子采用体心立方堆积,原子空间利用率为___________ 。铁常见的两种氧化物为 、
、 ,
, 的熔点比
的熔点比 的
的___________ (填“高”或“低”),其原因是___________ 。
(4)铁粉在高温氮化氛围下能够形成强磁性铁氮化合物,其晶胞结构如图所示,则该铁氮化合物的化学式为___________ ,设晶胞密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶胞中氮原子中心到顶点铁原子中心之间的距离为
,则该晶胞中氮原子中心到顶点铁原子中心之间的距离为___________  (用代数式表示)。
(用代数式表示)。

(1)铁合金中铬含量在10.5%以上时,其耐腐蚀性能显著增加。基态铬原子的价电子排布式为
(2)硅油是一种不同聚合度链状结构的聚有机硅氧烷。它具有耐热性、电绝缘性、耐候性、疏水性、生理惰性和较小的表面张力,因此会用于保护航母甲板,其结构如图所示。

硅油中碳原子的杂化方式为
 键的键能
键的键能(3)单质铁中铁原子采用体心立方堆积,原子空间利用率为
 、
、 ,
, 的熔点比
的熔点比 的
的(4)铁粉在高温氮化氛围下能够形成强磁性铁氮化合物,其晶胞结构如图所示,则该铁氮化合物的化学式为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶胞中氮原子中心到顶点铁原子中心之间的距离为
,则该晶胞中氮原子中心到顶点铁原子中心之间的距离为 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子价电子排布式为___________ 。 金属镍的原子堆积方式如图所示,则金属镍的晶胞俯视图为___________ ( 填字母)。

a. b.
b.  c.
c. d.
d.
(2)四羰基镍、氧化镍的物理性质如下:
由此判断:[ Ni(CO)4]是配合物,其配位体是___________ 。 [ Ni(CO)4]分子是___________ (填“极性”或“非极性”)分子。[Ni(CO)4]比NiO熔点低的原因是___________ 。
(3)有一种镧镍合金是重要的储氢材料,其晶体属六方晶系,晶胞结构如图1所示。其储氢原理是氢分子先变为氢原子,氢原子进入合金的孔隙中。图2所示晶体中两个镧原子和2个镍原子组成的四面体孔隙中只能进入1个氢原子,晶胞中的所有类似四面体中都有氢原子进入,即达到储氢稳定状态。当需要氢气时,给储氢合金加热,氢原子变为氢气逸出。

晶体中Ni 、La的原子个数比=___________ 。每升该储氢材料达到储氢稳定状态,储氢原子___________ mol。
(1)基态镍原子价电子排布式为

a.
 b.
b.  c.
c. d.
d.
(2)四羰基镍、氧化镍的物理性质如下:
| 名称(化学式) | 状态 | 熔点 | 溶解性 | 说明 |
| 四羰基镍[Ni(CO)4] | 无色挥发性 剧毒液体 | - 25°C | 不溶于水,易溶于苯、四氯化碳等有机溶剂 | 正四面体分子、分子中碳原子与镍成键 |
| 氧化镍 (NiO) | 绿色粉末状 固体 | 1980°C | 不溶于水 | 阴离子、阳离子构成 |
(3)有一种镧镍合金是重要的储氢材料,其晶体属六方晶系,晶胞结构如图1所示。其储氢原理是氢分子先变为氢原子,氢原子进入合金的孔隙中。图2所示晶体中两个镧原子和2个镍原子组成的四面体孔隙中只能进入1个氢原子,晶胞中的所有类似四面体中都有氢原子进入,即达到储氢稳定状态。当需要氢气时,给储氢合金加热,氢原子变为氢气逸出。

晶体中Ni 、La的原子个数比=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】(1)下列Li原子电子排布图表示的状态中,电离最外层一个电子所需能量最小的是_______ (填标号)。
A. B.
B.
C. D.
D.
(2)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为______ ;推测抗坏血酸在水中的溶解性:_______ (填“难溶于水”或“易溶于水”)。

(3)下表列有三种物质(晶体)的熔点:
简要解释熔点产生差异的原因:_______ 。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其晶胞,晶胞边长为anm。则硼原子与磷原子最近的距离为_______ 。用Mg·mol-1表示磷化硼的摩尔质量,NA表示阿伏加 德罗常数的值,则磷化硼晶体的密度为_______ g·cm-3。

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为( ,
, ,0),则原子2和3的坐标分别为
,0),则原子2和3的坐标分别为_______ 、______ 。
A.
 B.
B.
C.
 D.
D.
(2)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为

(3)下表列有三种物质(晶体)的熔点:
| 物质 | SiO2 | SiCl4 | SiF4 |
| 熔点℃ | 1710 | -70.4 | -90.2 |
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其晶胞,晶胞边长为anm。则硼原子与磷原子最近的距离为

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(
 ,
, ,0),则原子2和3的坐标分别为
,0),则原子2和3的坐标分别为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】[物质结构与性质]
I . 固体二氧化碳外形似冰,受热汽化无液体产生,俗称“干冰”,根据干冰晶胞结构回答:
(1)干冰中一个分子周围有__________个紧邻分子。
(2)堆积方式与干冰晶胞类型相同的金属有_________(从“Cu、Mg、K、Po”中选出正确的),其空间利用率为_______。
(3)CO2中心原子的杂化方式为_______,有一种与CO2互为等电子体的离子,能用于鉴别Fe3+ ,写出其电子式______________________。
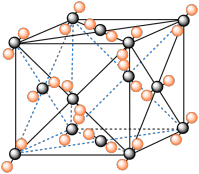
II. 钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。

(4)写出Cu3+的电子排布式: 。
(5)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为: 。
(6)根据(5)所推出的化合物的组成,(该化合物中各元素的化合价为Y +3、Ba +2),计算该物质中+2价和+3价的Cu离子个数比为:_______________。
I . 固体二氧化碳外形似冰,受热汽化无液体产生,俗称“干冰”,根据干冰晶胞结构回答:

(1)干冰中一个分子周围有__________个紧邻分子。
(2)堆积方式与干冰晶胞类型相同的金属有_________(从“Cu、Mg、K、Po”中选出正确的),其空间利用率为_______。
(3)CO2中心原子的杂化方式为_______,有一种与CO2互为等电子体的离子,能用于鉴别Fe3+ ,写出其电子式______________________。
II. 钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。

(4)写出Cu3+的电子排布式: 。
(5)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为: 。
(6)根据(5)所推出的化合物的组成,(该化合物中各元素的化合价为Y +3、Ba +2),计算该物质中+2价和+3价的Cu离子个数比为:_______________。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】众多化学储氢材料中,硼化合物含有大量的氢原子,易水解释放出大量的氢气和对环境无害的副产物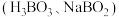 ,近年来各类报道表明,目前用于制氢的硼化合物主要非常有应用潜力的车载储氢材料之一,其具有储氢含量高(19.6%)、安全无毒、低分子量
,近年来各类报道表明,目前用于制氢的硼化合物主要非常有应用潜力的车载储氢材料之一,其具有储氢含量高(19.6%)、安全无毒、低分子量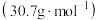 以及在水溶液中长期稳定等特点。回答下列问题:
以及在水溶液中长期稳定等特点。回答下列问题:
(1) 中所含元素电负性由大到小的顺序为
中所含元素电负性由大到小的顺序为_____ , 中阴离子的空间构型为
中阴离子的空间构型为_____ 。
(2)某研究团队采用氯化铵与 反应制得氨基配合物
反应制得氨基配合物 ,
, 下其与
下其与 在无水四氢呋喃(
在无水四氢呋喃( )中反应一段时间,得到纯度大于
)中反应一段时间,得到纯度大于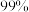 的氨硼烷。
的氨硼烷。 中
中 配位数为
配位数为_____ , 四氢呋喃中所含
四氢呋喃中所含 键数目为
键数目为_____ (用含 的代数式表示)。四氢呋喃中氧原子的杂化方式为
的代数式表示)。四氢呋喃中氧原子的杂化方式为_____ 。
(3)氨硼烷水解释放氢气,在 等催化剂条件下进行,其反应方程式为
等催化剂条件下进行,其反应方程式为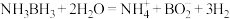 。其中
。其中 中所含孤电子对数目为
中所含孤电子对数目为_____ (用含 的代数式表示),
的代数式表示), 中
中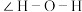 键角
键角_____  (填“大于”“小于”或“等于”),
(填“大于”“小于”或“等于”),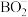 是
是 的简写形式,
的简写形式, 中含有一个六元环状结构,写出
中含有一个六元环状结构,写出 的结构式:
的结构式:_____ 。
(4)偏硼酸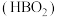 可由硼酸受热脱水获得,偏硼酸的一种变体具有片层结构(由三聚单元
可由硼酸受热脱水获得,偏硼酸的一种变体具有片层结构(由三聚单元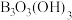 组成),其片层结构如图所示,在该片层结构中将三聚单元
组成),其片层结构如图所示,在该片层结构中将三聚单元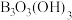 连接成层的作用力为
连接成层的作用力为_____ 。

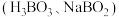 ,近年来各类报道表明,目前用于制氢的硼化合物主要非常有应用潜力的车载储氢材料之一,其具有储氢含量高(19.6%)、安全无毒、低分子量
,近年来各类报道表明,目前用于制氢的硼化合物主要非常有应用潜力的车载储氢材料之一,其具有储氢含量高(19.6%)、安全无毒、低分子量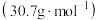 以及在水溶液中长期稳定等特点。回答下列问题:
以及在水溶液中长期稳定等特点。回答下列问题:(1)
 中所含元素电负性由大到小的顺序为
中所含元素电负性由大到小的顺序为 中阴离子的空间构型为
中阴离子的空间构型为(2)某研究团队采用氯化铵与
 反应制得氨基配合物
反应制得氨基配合物 ,
, 下其与
下其与 在无水四氢呋喃(
在无水四氢呋喃( )中反应一段时间,得到纯度大于
)中反应一段时间,得到纯度大于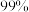 的氨硼烷。
的氨硼烷。 中
中 配位数为
配位数为 四氢呋喃中所含
四氢呋喃中所含 键数目为
键数目为 的代数式表示)。四氢呋喃中氧原子的杂化方式为
的代数式表示)。四氢呋喃中氧原子的杂化方式为(3)氨硼烷水解释放氢气,在
 等催化剂条件下进行,其反应方程式为
等催化剂条件下进行,其反应方程式为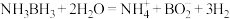 。其中
。其中 中所含孤电子对数目为
中所含孤电子对数目为 的代数式表示),
的代数式表示), 中
中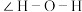 键角
键角 (填“大于”“小于”或“等于”),
(填“大于”“小于”或“等于”),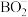 是
是 的简写形式,
的简写形式, 中含有一个六元环状结构,写出
中含有一个六元环状结构,写出 的结构式:
的结构式:(4)偏硼酸
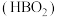 可由硼酸受热脱水获得,偏硼酸的一种变体具有片层结构(由三聚单元
可由硼酸受热脱水获得,偏硼酸的一种变体具有片层结构(由三聚单元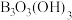 组成),其片层结构如图所示,在该片层结构中将三聚单元
组成),其片层结构如图所示,在该片层结构中将三聚单元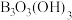 连接成层的作用力为
连接成层的作用力为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】下表是长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是_______ (填编号)。
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为_______ (用对应的元素符号表示)。

(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是_______ 。
a.分子中含有氢键 b.属于非极性分子
c.含有4个σ键和1个π键 d.该氢化物分子中,②原子采用sp2杂化
(4)某元素的外围电子排布式为nsnnpn+1,该元素可与①形成三角锥形的分子X, X在①与③形成的分子Y中的溶解度很大,其主要原因是__________ 。
(5)将过量的X通入含有元素⑩的硫酸盐溶液中,现象是_______ ,反应的离子方程式_______ 。
(6)⑩单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。

若已知⑩的原子半径为d,NA代表阿伏加德罗常数,⑩的相对原子质量为M,请回答:晶胞中⑩原子的配位数为_______ ,该晶体的密度为_______ (用字母表示)。

请回答下列问题:
(1)表中属于d区的元素是
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为

(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是
a.分子中含有氢键 b.属于非极性分子
c.含有4个σ键和1个π键 d.该氢化物分子中,②原子采用sp2杂化
(4)某元素的外围电子排布式为nsnnpn+1,该元素可与①形成三角锥形的分子X, X在①与③形成的分子Y中的溶解度很大,其主要原因是
(5)将过量的X通入含有元素⑩的硫酸盐溶液中,现象是
(6)⑩单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。

若已知⑩的原子半径为d,NA代表阿伏加德罗常数,⑩的相对原子质量为M,请回答:晶胞中⑩原子的配位数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】硫及硫化物广泛存在于自然界中,回答下列问题:
(1)基态S原子中,核外电子占据的最高能层的符号是___________ ,有__________ 种不同形状的电子云。
(2)(NH4)2SO4中O、N、S三种元素的第一电离能的大小关系为_______________________ 。
(3)中学化学常用KSCN检验Fe3+,列举一种与SCN-互为等电子体的分子:___________ ,SCN-中C原子的杂化方式为_________________ 。
(4)乙硫醇(CH3CH2SH)的相对分子质量比CH3CH2OH大,但乙醇的沸点高于乙硫醇的原因是_________________________________________________ 。
(5)PbS是一种重要的半导体材料,具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X-射线衍射实验测得PbS的晶胞参数为a=0.594 n m。
①已知坐标参数:A(0,0,0),B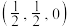 ,则C的坐标参数为
,则C的坐标参数为__________________ 。
②PbS晶体中Pb2+的配位数为_________ ,r(S2-)为______ nm。(已知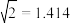 )
)
③PbS晶体的密度为_________ g·cm-3。(列出计算式即可)
(1)基态S原子中,核外电子占据的最高能层的符号是
(2)(NH4)2SO4中O、N、S三种元素的第一电离能的大小关系为
(3)中学化学常用KSCN检验Fe3+,列举一种与SCN-互为等电子体的分子:
(4)乙硫醇(CH3CH2SH)的相对分子质量比CH3CH2OH大,但乙醇的沸点高于乙硫醇的原因是
(5)PbS是一种重要的半导体材料,具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X-射线衍射实验测得PbS的晶胞参数为a=0.594 n m。

①已知坐标参数:A(0,0,0),B
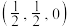 ,则C的坐标参数为
,则C的坐标参数为②PbS晶体中Pb2+的配位数为
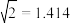 )
)③PbS晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】自然界中存在大量的金属元素,对工农业生产有重要的价值。
(1)NaF的熔点是995℃,而SiF4的熔点为-90.2℃,试分析原因_______ 。
(2)Li2O是离子晶体,如图可知Li原子的第一电离能为_______ kJ/mol,O=O键的键能为_______ kJ/mol。
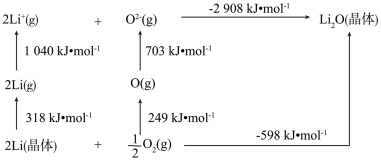
(3)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成的。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是_______ 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为_______ ;该晶胞中粒子个数比Hg:Ge:Sb=_______ 。
③设X的最简式的摩尔质量为Mr,则X晶体的密度为_______ g/cm3(列出算式)。
(1)NaF的熔点是995℃,而SiF4的熔点为-90.2℃,试分析原因
(2)Li2O是离子晶体,如图可知Li原子的第一电离能为

(3)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成的。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为
③设X的最简式的摩尔质量为Mr,则X晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】晶体具有周期性的微观结构,表现出许多独特的性质,用于制造各种材料。

(1)干冰常用作制冷剂、人工降雨材料等。
①1个 分子周围等距且最近的
分子周围等距且最近的 分子有
分子有________ 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是________ 。
③如图是冰的结构。下列事实能解释干冰的密度比冰大的是________ (填字母序号)。

a.二氧化碳分子的质量大于水分子
b.干冰晶胞中二氧化碳分子堆积得更密集
c.水分子极性强,分子间作用力大
d.冰中氢键存在方向性,晶体有较大空隙,空间利用率低
(2)单晶硅等作为制造太阳能电池的材料已得到广泛应用。
①单晶硅中最小的环上有________ 个Si原子。
②1mol单晶硅中含有________ mol Si-Si键。
(3) 是一种碳的单质。
是一种碳的单质。
①1个 晶胞中含有
晶胞中含有________ 个分子。
②世界上第一辆单分子“纳米小车”的四个轮子是 ,小车运行情况如图所示,从a处化学键的特点说明其运动原因:
,小车运行情况如图所示,从a处化学键的特点说明其运动原因:________ 。

(4)NiO晶体与NaCl晶体结构相似。
①NiO的熔点远高于NaCl,结合右表说明理由:________ 。
②设阿伏加德罗常数的值为 ,距离最近的两个
,距离最近的两个 间距为a pm(
间距为a pm(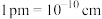 ),NiO的摩尔质量为M
),NiO的摩尔质量为M  ,则晶体的密度为
,则晶体的密度为________  (列出计算式)。
(列出计算式)。
③晶体普遍存在各种缺陷。某种NiO晶体中存在如右图所示的缺陷:当一个 空缺,会有两个
空缺,会有两个 被两个
被两个 所取代,但晶体仍呈电中性。经测定某氧化镍样品中
所取代,但晶体仍呈电中性。经测定某氧化镍样品中 与
与 的离子数之比为6:91。若该晶体的化学式为
的离子数之比为6:91。若该晶体的化学式为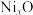 ,则x=
,则x=________ 。


(1)干冰常用作制冷剂、人工降雨材料等。
①1个
 分子周围等距且最近的
分子周围等距且最近的 分子有
分子有②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是
③如图是冰的结构。下列事实能解释干冰的密度比冰大的是

a.二氧化碳分子的质量大于水分子
b.干冰晶胞中二氧化碳分子堆积得更密集
c.水分子极性强,分子间作用力大
d.冰中氢键存在方向性,晶体有较大空隙,空间利用率低
(2)单晶硅等作为制造太阳能电池的材料已得到广泛应用。
①单晶硅中最小的环上有
②1mol单晶硅中含有
(3)
 是一种碳的单质。
是一种碳的单质。①1个
 晶胞中含有
晶胞中含有②世界上第一辆单分子“纳米小车”的四个轮子是
 ,小车运行情况如图所示,从a处化学键的特点说明其运动原因:
,小车运行情况如图所示,从a处化学键的特点说明其运动原因:
(4)NiO晶体与NaCl晶体结构相似。
| 晶体 | 离子间距/nm | 熔点/℃ |
| NaCl | 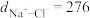 | 801 |
| NiO | 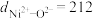 | 1960 |
②设阿伏加德罗常数的值为
 ,距离最近的两个
,距离最近的两个 间距为a pm(
间距为a pm(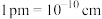 ),NiO的摩尔质量为M
),NiO的摩尔质量为M  ,则晶体的密度为
,则晶体的密度为 (列出计算式)。
(列出计算式)。③晶体普遍存在各种缺陷。某种NiO晶体中存在如右图所示的缺陷:当一个
 空缺,会有两个
空缺,会有两个 被两个
被两个 所取代,但晶体仍呈电中性。经测定某氧化镍样品中
所取代,但晶体仍呈电中性。经测定某氧化镍样品中 与
与 的离子数之比为6:91。若该晶体的化学式为
的离子数之比为6:91。若该晶体的化学式为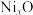 ,则x=
,则x=
您最近一年使用:0次
【推荐2】现有A、B、C、D四种短周期元素,它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:
(1)表中所述A的单质晶体中微粒间的相互作用有___________________________ 。
(2)B元素的氧化物所对应的晶体属于____ 晶体(填“分子”、“原子”、“离子”、“金属”),工业上制备B元素单质的化学方程式:_______________________ 。
(3)钠与C元素形成的Na3C晶体中,C元素以C3-存在,C3-的电子排布式为_____________ 。C元素的气态氢化物溶于水后溶液呈碱性的原因(用方程式表示)_____________ 。
(4)与D同主族的短周期元素,其单质及其化合物与D的单质及其化合物均具有的性质为_____________
(填序号).
A.常温下单质跟水剧烈反应并放出氧气 B.气态氢化物具有很强的热稳定性
C.气态氢化物极易溶于水并呈强酸性 D.在HXO中X的化合价均为+l价
| 元素 | 相关结构和性质 |
| A | 其单质的一种晶体不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可用作原子核反应堆的慢化剂、火箭发动机喷灌和电极材料等。 |
| B | 其单质既能与强酸溶液反应,又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小。 |
| C | 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多。 |
| D | 原子核外最外层电子排布式为nsnnp2n+1 |
(1)表中所述A的单质晶体中微粒间的相互作用有
(2)B元素的氧化物所对应的晶体属于
(3)钠与C元素形成的Na3C晶体中,C元素以C3-存在,C3-的电子排布式为
(4)与D同主族的短周期元素,其单质及其化合物与D的单质及其化合物均具有的性质为
(填序号).
A.常温下单质跟水剧烈反应并放出氧气 B.气态氢化物具有很强的热稳定性
C.气态氢化物极易溶于水并呈强酸性 D.在HXO中X的化合价均为+l价
您最近一年使用:0次
【推荐3】已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
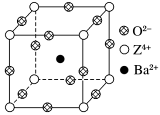
(1) Y在周期表中位于______________ ;Z4+的核外电子排布式为___________________ 。
(2)X的该种氢化物分子构型为________ ,X在该氢化物中以_______ 方式杂化。X和Y形成的化合物的熔点应该_______ (填“高于”或“低于”)X的氢化物的熔点。
(3)①制备M的化学方程式是_____________ 。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________ 。
③在M晶体中,Z4+的氧配位数为________ 。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____ m。

(1) Y在周期表中位于
(2)X的该种氢化物分子构型为
(3)①制备M的化学方程式是
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的
③在M晶体中,Z4+的氧配位数为
④已知O2-半径为1.40×10-10 m,则Z4+半径为
您最近一年使用:0次



