铝、铁、铜是重要的金属,广泛应用于电气、机械制造和国防等领域。回答下列问题:
(1) 基态核外电子排布式为
基态核外电子排布式为__________ ;
(2)向 溶液中加入过量氨水,可生成
溶液中加入过量氨水,可生成 。下列说法正确的是
。下列说法正确的是__________ ;
a.氨气极易溶于水,是因为 分子和
分子和 分子之间形成了3种不同的氢键
分子之间形成了3种不同的氢键
b. 分子和
分子和 分子的分子空间构型不同,氨气分子的键角小于水分子的键角
分子的分子空间构型不同,氨气分子的键角小于水分子的键角
c. 所含有的化学键有离子键、极性共价键和配位键
所含有的化学键有离子键、极性共价键和配位键
d. 的组成元素中,电负性最大的是氮元素
的组成元素中,电负性最大的是氮元素
(3)基态 原子有
原子有____ 个未成对电子, 的价电子排布图
的价电子排布图____ 。可用硫氰化钾检验 ,形成配合物的颜色为
,形成配合物的颜色为_____ ;
(4) 单质为面心立方晶体,其晶胞参数
单质为面心立方晶体,其晶胞参数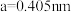 ,晶胞中铝原子的配位数为
,晶胞中铝原子的配位数为_____ 。列式表示Al单质的密度____  (不必计算出结果);
(不必计算出结果);
(1)
 基态核外电子排布式为
基态核外电子排布式为(2)向
 溶液中加入过量氨水,可生成
溶液中加入过量氨水,可生成 。下列说法正确的是
。下列说法正确的是a.氨气极易溶于水,是因为
 分子和
分子和 分子之间形成了3种不同的氢键
分子之间形成了3种不同的氢键b.
 分子和
分子和 分子的分子空间构型不同,氨气分子的键角小于水分子的键角
分子的分子空间构型不同,氨气分子的键角小于水分子的键角c.
 所含有的化学键有离子键、极性共价键和配位键
所含有的化学键有离子键、极性共价键和配位键d.
 的组成元素中,电负性最大的是氮元素
的组成元素中,电负性最大的是氮元素(3)基态
 原子有
原子有 的价电子排布图
的价电子排布图 ,形成配合物的颜色为
,形成配合物的颜色为(4)
 单质为面心立方晶体,其晶胞参数
单质为面心立方晶体,其晶胞参数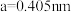 ,晶胞中铝原子的配位数为
,晶胞中铝原子的配位数为 (不必计算出结果);
(不必计算出结果);
更新时间:2020-08-26 18:07:16
|
相似题推荐
【推荐1】a、b、c、d、e、f是原子序数依次增大的非0族元素,位于元素周期表的前四周期。a的一种核素无中子,b的s能级电子数与p能级的电子数之比为4:3,c与e同主族,未成对电子数为2,d在同周期元素中的原子半径最大,f在同周期元素中的未成对电子数最多。请回答下列问题:
(1)上述元素中,位于元素周期表p区的元素有___________ (填元素符号),其中基态c原子中电子占据的最高能级的原子轨道形状是___________ 。
(2)基态e原子的核外电子排布式为___________ ,其核外有___________ 种不同空间运动状态的电子。
(3)b、c、d、e的简单离子半径由大到小的顺序为_____ (用离子符号表示),b、c、e元素中,第一电离能最大的元素为____ ,原因为__________ 。
(4)基态f原子的未成对电子数与成对电子数之比为____ ,下列属于f原子激发态电子排布式的有
___ (填标号)
A. B.
B. C.
C. D.
D.
(1)上述元素中,位于元素周期表p区的元素有
(2)基态e原子的核外电子排布式为
(3)b、c、d、e的简单离子半径由大到小的顺序为
(4)基态f原子的未成对电子数与成对电子数之比为
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】现有六种元素,其中 A、B、C、D 为短周期主族元素,E、F 为第四周期元素,它们的原子序数依次增大。
请根据以上相关信息,回答问题:
(1)A 的卤化物在工业中有重要作用,A 的四种卤化物的沸点如下表所示:
①四种卤化物沸点依次升高的原因是_________________ 。
② ACl3、LiAH4 中A 原子的杂化轨道类型依次为______ 、_______ ;与 A3N3H6 互为等电子体的分子的结构简式为___________ 。
③用AF3分子结构解释反应 AF3(g)+NH4F(s)=NH4AF4(s)能够发生的原因:_________________ 。
(2)某同学根据上述信息,推断
①B基态原子的核外最子排布为 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了________ 。
② 已知元素 B 的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是________ 。
A.分子中含有分子间氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键 D.该氢化物分子中 B 原子采用 sp2 杂化
(3)D 基态原子中能量最高的电子,其电子云在空间有______ 个方向,原子轨道呈______ 形。
(4)写出 E 原子的电子排布式______________ 。
(5)请写出 F 元素外围电子排布式_________ 。向 FSO4溶液中滴加入C元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式__________ 。
| A 元素原子的核外 p 电子数比 s 电子数少 3 |
| B 元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
| C 元素基态原子 p 轨道有 3 个未成对电子 |
| D 原子核外所有 p 轨道全满或半满 |
| E 在该周期中未成对电子数最多 |
| F 能形成红色(或砖红色)和黑色的两种氧化物 |
请根据以上相关信息,回答问题:
(1)A 的卤化物在工业中有重要作用,A 的四种卤化物的沸点如下表所示:
| 卤化物 | AF3 | ACl3 | ABr3 | AI3 |
| 沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是
② ACl3、LiAH4 中A 原子的杂化轨道类型依次为
③用AF3分子结构解释反应 AF3(g)+NH4F(s)=NH4AF4(s)能够发生的原因:
(2)某同学根据上述信息,推断
①B基态原子的核外最子排布为
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了② 已知元素 B 的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是
A.分子中含有分子间氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键 D.该氢化物分子中 B 原子采用 sp2 杂化
(3)D 基态原子中能量最高的电子,其电子云在空间有
(4)写出 E 原子的电子排布式
(5)请写出 F 元素外围电子排布式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】消毒剂在新冠疫情期间具有重要作用。
I.高铁酸钾(K2FeO4)是一种比KMnO4、O3和Cl2的氧化能力强的强氧化剂和消毒剂。
(1)基态Fe2+的价电子排布图为_____ 。
下列基态原子或离子的电子排布式或排布图中,违反洪特规则的是_____ ;违反泡利原理的是_____ 。
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P:
④Fe:1s22s22p63s23p63d64s2
⑤Mg2+:1s22s22p6
⑥C:
(2)高铁酸钾在水质处理中发挥着重要作用。查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:______ 。
II.喷洒家用“84”消毒液是预防病毒的有效方法,某实验小组探究某品牌“84”消毒液的性质,取某品牌“84”消毒液5mL进行如表实验。
(3)写出实验室制备“84”消毒液反应的化学方程式:______ 。
(4)查阅资料:酚酞的变色范围为8.2~10.0,且酚酞在强碱性溶液中红色会褪去。为探究操作a中溶液褪色的原因,又补充了如下实验(请将横线内容补充完整)。
获得结论:此实验小组使用的上述消毒液具有______ 性。
(5)该小组由操作b及现象获得结论:随着溶液酸性的增强,此消毒液的稳定性下降。
①操作b中溶液变成黄绿色的原因是______ (用离子方程式表示)。
②有人认为由操作 及现象获得上述结论并不严谨。需要进一步确认此结论的实验方案是
及现象获得上述结论并不严谨。需要进一步确认此结论的实验方案是______ 。
I.高铁酸钾(K2FeO4)是一种比KMnO4、O3和Cl2的氧化能力强的强氧化剂和消毒剂。
(1)基态Fe2+的价电子排布图为
下列基态原子或离子的电子排布式或排布图中,违反洪特规则的是
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P:

④Fe:1s22s22p63s23p63d64s2
⑤Mg2+:1s22s22p6
⑥C:

(2)高铁酸钾在水质处理中发挥着重要作用。查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:
II.喷洒家用“84”消毒液是预防病毒的有效方法,某实验小组探究某品牌“84”消毒液的性质,取某品牌“84”消毒液5mL进行如表实验。
| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(4)查阅资料:酚酞的变色范围为8.2~10.0,且酚酞在强碱性溶液中红色会褪去。为探究操作a中溶液褪色的原因,又补充了如下实验(请将横线内容补充完整)。
| 操作 | 现象 |
| 取 | 溶液变红,30min后褪色 |
(5)该小组由操作b及现象获得结论:随着溶液酸性的增强,此消毒液的稳定性下降。
①操作b中溶液变成黄绿色的原因是
②有人认为由操作
 及现象获得上述结论并不严谨。需要进一步确认此结论的实验方案是
及现象获得上述结论并不严谨。需要进一步确认此结论的实验方案是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】卤化物在生产、生活和科研中应用广泛。回答下列问题:
(1)OF2分子的空间构型为_______ :OF2的熔、沸点_______ (填“高于”或“低于”)Cl2O,原因是_______ 。
(2)AIF3的熔点约为1040℃,AlCl3的熔点为194℃,其晶体类型分别是_______ 、_______ 。
(3)CH3COOH中碳原子的杂化方式为_______ ,CH3COOH中所含元素的电负性由小到大为_______ 。
(4)二氧化氯(ClO2)是一种常用的饮用水消毒剂。已知ClO2分子中的键角约为120°。ClO2易溶于水的原因是_______ 。
(1)OF2分子的空间构型为
(2)AIF3的熔点约为1040℃,AlCl3的熔点为194℃,其晶体类型分别是
(3)CH3COOH中碳原子的杂化方式为
(4)二氧化氯(ClO2)是一种常用的饮用水消毒剂。已知ClO2分子中的键角约为120°。ClO2易溶于水的原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】氨基吡啶与铜等金属离子所形成的配合物具备良好的磁学性质,某氨基吡啶衍生物铜配合物X的结构简式如图所示。
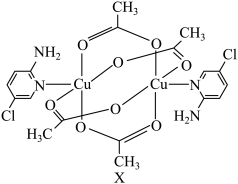
(1)基态氯原子的价层电子排布图为______ ;下列不同状态的氮原子中,能量最高的是______ (填字母)。
A. B.
B. C.
C.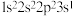 D.
D.
(2)C、N、O元素原子的电负性由大到小的顺序为______ 。
(3)X中 的配位数是
的配位数是______ ;铜元素有不同价态氧化物,高温下稳定性
______ CuO(填“大于”或“小于”),从离子的电子层结构角度分析,主要原因是______ 。
(4)X中N原子的杂化方式为______ 。
(5)下列关于X的说法中不正确的是______(填字母)。

(1)基态氯原子的价层电子排布图为
A.
 B.
B.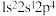 C.
C.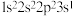 D.
D.
(2)C、N、O元素原子的电负性由大到小的顺序为
(3)X中
 的配位数是
的配位数是
(4)X中N原子的杂化方式为
(5)下列关于X的说法中不正确的是______(填字母)。
A.存在大π键 |
| B.存在氢键、配位键等化学键 |
| C.碳、氧原子间形成的σ键和π键个数比为2∶1 |
| D.铜属于d区元素 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】短周期主族元素A、B、C、D、E原子序数依次增大,B、C、D同周期,A原子核外电子只有一种自旋取向:C的基态原子的最外层有3个未成对电子,次外层有2个电子:B、D两种原子p能级上都有2个未成对电子,E原子的价电子中,在不同形状的原子轨道中运动的电子数相等,请回答下列问题(用元素符号或化学式回答问题):
(1)B、C、D三种元素第一电离能由大到小_______ 电负性由小到大的顺序_______
(2)元素As与C同族。推测As的氢化物 的空间构型
的空间构型_______ ; 沸点比
沸点比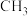 的
的_______ (填“高”或“低”),其判断理由是_______ ;元素的氢化物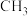 的键角
的键角_______  的键角(填>,<或=),原因是
的键角(填>,<或=),原因是_______
(3)A、B、D元素可以形成多种有机酸,如甲酸(HCOOH)、乙酸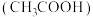 、丙酸
、丙酸 等,乙酸中碳原子的轨道杂化方式为
等,乙酸中碳原子的轨道杂化方式为_______ :甲酸的酸性大于乙酸,乙酸的酸性大于丙酸,试解释原因_______
(4)S元素与D同族, 的一种三聚体环状结构如图所示,该结构中
的一种三聚体环状结构如图所示,该结构中 键长有两类,一类键长约140pm,另一类键长约为169pm,较长的键为
键长有两类,一类键长约140pm,另一类键长约为169pm,较长的键为_______ (填a或b):E位于元素周期表的_______

(1)B、C、D三种元素第一电离能由大到小
(2)元素As与C同族。推测As的氢化物
 的空间构型
的空间构型 沸点比
沸点比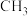 的
的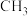 的键角
的键角 的键角(填>,<或=),原因是
的键角(填>,<或=),原因是(3)A、B、D元素可以形成多种有机酸,如甲酸(HCOOH)、乙酸
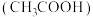 、丙酸
、丙酸 等,乙酸中碳原子的轨道杂化方式为
等,乙酸中碳原子的轨道杂化方式为(4)S元素与D同族,
 的一种三聚体环状结构如图所示,该结构中
的一种三聚体环状结构如图所示,该结构中 键长有两类,一类键长约140pm,另一类键长约为169pm,较长的键为
键长有两类,一类键长约140pm,另一类键长约为169pm,较长的键为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】【化学-选修3:物质结构与性质】
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是___ ,基态铜原子的核外电子排布式为___ 。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_____ (填晶体类型)。
(3)CO和CO的一种生活中常见等电子体分子,两者相比较沸点较高的为___ (填化学式)。CN-中碳原子杂化轨道类型为_______ ,C、N、O三元素的第一电离能最大的为_______ (用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图1所示。每个铜原子周围距离最近的铜原子数目___ 。
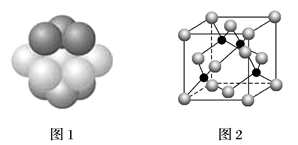
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子)。
①该晶体的化学式为___ 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于____ (填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,已知该晶体中铜原子和M原子之间的最短距离为体对角线的1/4,则该晶体中铜原子和M原子之间的最短距离为____ pm(只写计算式)。
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
(3)CO和CO的一种生活中常见等电子体分子,两者相比较沸点较高的为
(4)铜晶体中铜原子的堆积方式如图1所示。每个铜原子周围距离最近的铜原子数目

(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子)。
①该晶体的化学式为
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,已知该晶体中铜原子和M原子之间的最短距离为体对角线的1/4,则该晶体中铜原子和M原子之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是___ 。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔、沸点不同的原因可以用金属键强弱解释
d.金属拥有自由电子可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子价电子的轨道表示式为___ 。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173℃,100℃以上升华,二茂铁属于__ 晶体。已知分子中的大π键可用符号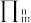 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。已知二茂铁的每个茂环带有一个单位负电荷(如图所示),则每个环中的大π键应表示为
)。已知二茂铁的每个茂环带有一个单位负电荷(如图所示),则每个环中的大π键应表示为___ 。

(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行___ 实验,其中阴离子的空间构型是___ 。该化合物加热时首先失去的组分是H2O,原因是___ 。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该质形成的晶体的立方晶胞结构如图所示。

①与Mg紧邻的Ni有___ 个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数a为(0,0,0);b为( ,
, ,0);d为(1,1,1)。则c原子的坐标参数为
,0);d为(1,1,1)。则c原子的坐标参数为___ 。
(1)下列关于金属及金属键的说法不正确的是
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔、沸点不同的原因可以用金属键强弱解释
d.金属拥有自由电子可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子价电子的轨道表示式为
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173℃,100℃以上升华,二茂铁属于
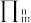 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。已知二茂铁的每个茂环带有一个单位负电荷(如图所示),则每个环中的大π键应表示为
)。已知二茂铁的每个茂环带有一个单位负电荷(如图所示),则每个环中的大π键应表示为
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该质形成的晶体的立方晶胞结构如图所示。

①与Mg紧邻的Ni有
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数a为(0,0,0);b为(
 ,
, ,0);d为(1,1,1)。则c原子的坐标参数为
,0);d为(1,1,1)。则c原子的坐标参数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铁元素在地壳中含量丰富,应用广泛:回答以下问题:
(1)基态Fe的价电子排布式为_____ ,其中未成对电子数目为_____ 。
(2)水溶液中Fe3+发生水解,水解过程中出现双核阳离子[Fe2(H2O)8(OH)2]4+。

①该双核阳离子中,Fe原子的配位数为_____ ,配体H2O的空间构型为_____ ,其键角_____ 109°28ˊ(填“大于”、“小于”或“等于”)。
②用KSCN可检验溶液中Fe3+的存在,lmol中SCN-中含有的π键数目为_____ NA。
(3)已知FeF3的熔点(1000℃)显著高于FeCl3的熔点(306℃),原因是_____ 。
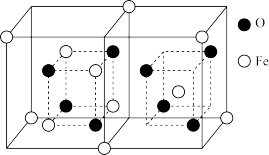
(4)铁的氧化物有多种,科研工作者常使用FexOy来表示各种铁氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为_____ 。
(1)基态Fe的价电子排布式为
(2)水溶液中Fe3+发生水解,水解过程中出现双核阳离子[Fe2(H2O)8(OH)2]4+。

①该双核阳离子中,Fe原子的配位数为
②用KSCN可检验溶液中Fe3+的存在,lmol中SCN-中含有的π键数目为
(3)已知FeF3的熔点(1000℃)显著高于FeCl3的熔点(306℃),原因是
(4)铁的氧化物有多种,科研工作者常使用FexOy来表示各种铁氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】材料的发展水平始终是时代进步和人类文明的标志。当前含铁的磁性材料在国防、电子信息等领域中具有广泛应用。请回答下列问题:
(1)基态铁原子的价电子排布图为_______ ,基态铁原子核外电子的空间运动状态有_______ 种。
(2)一种新研发出的铁磁性材料M的分子结构如下图所示。

①M分子中C、N、O三种元素的电负性由大到小的顺序为_______ 。
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为_______ (填序号)。
A.sp2 B.sp3 C.dsp2 D.d2sp3
③分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ), 则M分子中由碳、氧组成的五元环中的大π键应表示为
), 则M分子中由碳、氧组成的五元环中的大π键应表示为_______ 。
(3)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如下图所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为_______ 。
②若晶胞中距离最近的铁原子和氮原子的距离为apm,阿伏加德罗常数的值为NA,则该晶胞的密度为_______ g·cm-3 (列出计算式即可)。
(1)基态铁原子的价电子排布图为
(2)一种新研发出的铁磁性材料M的分子结构如下图所示。

①M分子中C、N、O三种元素的电负性由大到小的顺序为
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为
A.sp2 B.sp3 C.dsp2 D.d2sp3
③分子中的大π键可用符号π
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ), 则M分子中由碳、氧组成的五元环中的大π键应表示为
), 则M分子中由碳、氧组成的五元环中的大π键应表示为(3)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如下图所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为
②若晶胞中距离最近的铁原子和氮原子的距离为apm,阿伏加德罗常数的值为NA,则该晶胞的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】碳、氮、铜形成的单质及它们形成的化合物有重要研究和应用价值,回答下列问题:
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
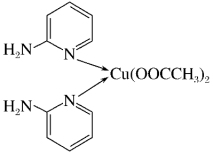
①基态Cu原子的价电子排布式为___________ ,在元素周期表中铜位于___________ 区(填“s”“p”“d”或“ds”)。
②C、N、O三种元素的第一电离能由大到小的顺序为___________ 。
③邻氨基吡啶的铜配合物中,Cu2+的配位数是________ ,N原子的杂化类型为_________ 。
(2)C60是富勒烯族分子中稳定性最高的一种,N60是未来的火箭燃料,二者结构相似。
①有关C60和N60的说法中正确的是___________ 。
A.C60和N60均属于分子晶体 B.N60的稳定性强于N2
C.C60中碳原子是sp3杂化 D.C60易溶于CS2、苯
②近年来,科学家合成了一种具有“二重结构”的球形分子,它是把足球形分子C60容纳在足球形分子Si60中,则该分子中含有的化学键类型为___________ (填“极性键”“非极性键”)。
(3)原子坐标参数和晶胞参数是晶胞的两个基本参数。

①图a中原子坐标参数分别为:A(0,0,0),B( ,
, ,0),C(
,0),C( ,0,
,0, ),则D的原子坐标参数为
),则D的原子坐标参数为___________ 。
②图b为铜的晶胞,铜原子半径为Rnm,NA是阿伏加德罗常数的值,则铜晶体的密度为______ g·cm-3(用含R、NA的式子表示)。
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。

①基态Cu原子的价电子排布式为
②C、N、O三种元素的第一电离能由大到小的顺序为
③邻氨基吡啶的铜配合物中,Cu2+的配位数是
(2)C60是富勒烯族分子中稳定性最高的一种,N60是未来的火箭燃料,二者结构相似。
①有关C60和N60的说法中正确的是
A.C60和N60均属于分子晶体 B.N60的稳定性强于N2
C.C60中碳原子是sp3杂化 D.C60易溶于CS2、苯
②近年来,科学家合成了一种具有“二重结构”的球形分子,它是把足球形分子C60容纳在足球形分子Si60中,则该分子中含有的化学键类型为
(3)原子坐标参数和晶胞参数是晶胞的两个基本参数。

①图a中原子坐标参数分别为:A(0,0,0),B(
 ,
, ,0),C(
,0),C( ,0,
,0, ),则D的原子坐标参数为
),则D的原子坐标参数为②图b为铜的晶胞,铜原子半径为Rnm,NA是阿伏加德罗常数的值,则铜晶体的密度为
您最近一年使用:0次
【推荐3】教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
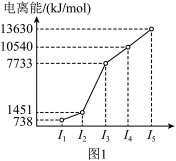
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有____ 种不同运动状态的电子。
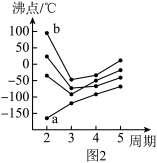
(2)图2中,每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是____ (填化学式),图中b的沸点大于a,原因是____ 。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____ 晶体。

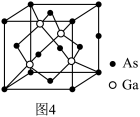
(4)GaAs晶体结构如图4所示,晶体中每个Ga原子与____ 个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为____ 。
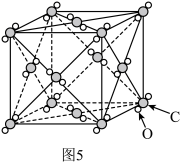
(5)干冰是分子晶体,晶体结构如图5所示,一个干冰晶胞中有____ 个CO2分子。
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有

(2)图2中,每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于

(4)GaAs晶体结构如图4所示,晶体中每个Ga原子与

(5)干冰是分子晶体,晶体结构如图5所示,一个干冰晶胞中有

您最近一年使用:0次



