已知2A2(g)+B2(g)⇌2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为______ 。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将______ (填“增大“、“减小”或“不变”)
(3)恒压的密闭容器中发生可逆反应2A2(g)+B2(g)⇌2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是______
A.v(A2):v(C3)=3:2
B.反应混合气体的密度不再变化
C.反应混合气体的平均摩尔质量不再变化
D.A2、B2两种反应物的转化率不再变化
E. A2、B2、C3三种物质的浓度相等
F.密闭容器内的压强不再变化
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____ ;
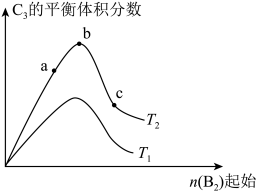
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容器,起始时加入2 molA2和1 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2_______ Q4(填“>”、“<”或“=”)。
(1)达到平衡时, A2的转化率为
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将
(3)恒压的密闭容器中发生可逆反应2A2(g)+B2(g)⇌2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是
A.v(A2):v(C3)=3:2
B.反应混合气体的密度不再变化
C.反应混合气体的平均摩尔质量不再变化
D.A2、B2两种反应物的转化率不再变化
E. A2、B2、C3三种物质的浓度相等
F.密闭容器内的压强不再变化
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是

a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容器,起始时加入2 molA2和1 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2
更新时间:2020-10-10 11:08:51
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化。
(1) 已知:2NO(g)+O2(g)===2NO2(g) ΔH1
NO(g)+O3(g)===NO2(g)+O2(g) ΔH2
2NO2(g) N2O4(g) ΔH3
N2O4(g) ΔH3
2N2O5(g)===4NO2(g)+O2(g) ΔH4
则反应N2O4(g)+O3(g)===N2O5(g)+O2(g)的ΔH=__________ 。
(2)从N2O5在一定条件下发生分解:2N2O5(g)===4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
设反应开始时体系压强为p0,第2.00 min时体系压强为p,则p∶p0=________ ;1.00~3.00 min内,O2的平均反应速率为________ 。
(3)N2O4与NO2之间存在反应N2O4(g) 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
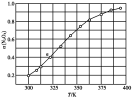
①图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp=________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②由图推测N2O4(g) 2NO2(g)是吸热反应还是放热反应,说明理由
2NO2(g)是吸热反应还是放热反应,说明理由_______________ ,若要提高N2O4转化率,除改变反应温度外,其他措施有____________ (要求写出两条)。
(1) 已知:2NO(g)+O2(g)===2NO2(g) ΔH1
NO(g)+O3(g)===NO2(g)+O2(g) ΔH2
2NO2(g)
 N2O4(g) ΔH3
N2O4(g) ΔH32N2O5(g)===4NO2(g)+O2(g) ΔH4
则反应N2O4(g)+O3(g)===N2O5(g)+O2(g)的ΔH=
(2)从N2O5在一定条件下发生分解:2N2O5(g)===4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/ (mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
(3)N2O4与NO2之间存在反应N2O4(g)
 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
①图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp=
②由图推测N2O4(g)
 2NO2(g)是吸热反应还是放热反应,说明理由
2NO2(g)是吸热反应还是放热反应,说明理由
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】I.一密闭体系中发生反应N2(g)+3H2(g) 2NH3(g) ΔH<0,如图是某一时间段内反应速率与时间的关系曲线图。请回答下列问题:
2NH3(g) ΔH<0,如图是某一时间段内反应速率与时间的关系曲线图。请回答下列问题:

(1)处于平衡状态的时间段有:________ 、________ 、________ 、________ 。
(2)t1、t3、t4时刻体系中分别发生变化的条件是____ 、____ 、_____ 。
(3)下列各时间段中,氨的百分含量最高的是________ 。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表所示:
(4)该反应的化学平衡常数表达式为K=__________ 。
(5)该反应为__________ (填“吸热”或“放热”)反应。
(6)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为________ ℃。
 2NH3(g) ΔH<0,如图是某一时间段内反应速率与时间的关系曲线图。请回答下列问题:
2NH3(g) ΔH<0,如图是某一时间段内反应速率与时间的关系曲线图。请回答下列问题:
(1)处于平衡状态的时间段有:
(2)t1、t3、t4时刻体系中分别发生变化的条件是
(3)下列各时间段中,氨的百分含量最高的是
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表所示:| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(4)该反应的化学平衡常数表达式为K=
(5)该反应为
(6)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】在容器体积可变的密闭容器中,反应N2(g) 3H2(g)
3H2(g)  2NH3(g)在一定条件下达到平衡。
2NH3(g)在一定条件下达到平衡。
完成下列填空:
(1)若该反应经过2秒钟后达到平衡,NH3的浓度增加了0.4mol/L,在此期间,正反应速率 (H2)的值为
(H2)的值为( )
A 0.6mol/(L·s) B 0.45 mol/(L·s) C 0.3 mol/(L·s) D 0.2 mol/(L·s)
(2)在其他条件不变的情况下,增大容器体积以减小反应体系的压强,
____ (选填“增大”、“减小”,下同),
____ ,平衡向____ 方向移动(选填“正反应”、“逆反应”)。

(3)在其他条件不变的情况下,升高温度平衡向逆反应方向移动,则正反应为____ 反应(选填“吸热”、“放热”)。
(4)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是___ (填写编号)。
a.增大H2的浓度 b.缩小容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量____ (选填“增大”、“减小”、“不变”)。在一定条件下,反应2A+B C达到平衡。
C达到平衡。
(5)若升高温度,平衡向正反应方向移动,则逆反应是_________ 热反应;
(6)若增加或减少B时,平衡不移动,则B是_________ 态;
(7)若A、B、C均为气态,将6mol A、3mol B充入容积为0.5L的密闭容器中,进行反应。经5s后,测得容器内有1mol B,则用A表示的反应速率为_________________________ , 5s末时C的物质的量浓度为__________________ 。
 3H2(g)
3H2(g)  2NH3(g)在一定条件下达到平衡。
2NH3(g)在一定条件下达到平衡。完成下列填空:
(1)若该反应经过2秒钟后达到平衡,NH3的浓度增加了0.4mol/L,在此期间,正反应速率
 (H2)的值为
(H2)的值为A 0.6mol/(L·s) B 0.45 mol/(L·s) C 0.3 mol/(L·s) D 0.2 mol/(L·s)
(2)在其他条件不变的情况下,增大容器体积以减小反应体系的压强,


(3)在其他条件不变的情况下,升高温度平衡向逆反应方向移动,则正反应为
(4)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是
a.增大H2的浓度 b.缩小容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量
 C达到平衡。
C达到平衡。(5)若升高温度,平衡向正反应方向移动,则逆反应是
(6)若增加或减少B时,平衡不移动,则B是
(7)若A、B、C均为气态,将6mol A、3mol B充入容积为0.5L的密闭容器中,进行反应。经5s后,测得容器内有1mol B,则用A表示的反应速率为
您最近一年使用:0次
【推荐1】按照要求回答下列问题:
I.(1)已知:S2Cl2(l)+Cl2(g)=2SCl2(l) ΔH=-50.2 kJ·mol-1。断裂1mol Cl—Cl键、1mol S—S键分别需要吸收243kJ、268kJ的能量,则断裂1mol S—Cl键需要吸收的能量为______ kJ。
(2)某容积不变的密闭容器中发生如下反应:2SO2(g)+O2(g)⇌2SO3(g) △H=-197 kJ·mol-1。
下列能说明反应达到平衡状态的是_________ 。
a.体系压强保持不变
b.混合气体的密度保持不变
c.SO3和O2的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol SO2
(3)如图所示,左侧石墨上通入 ,右侧石墨上通入
,右侧石墨上通入 ,电解质溶液为
,电解质溶液为 溶液。完成下列问题:
溶液。完成下列问题:

①负极反应式为_______________________ 。
②放电时 向
向_____ (填“正”或“负”)极移动。
③当外电路通过电子的物质的量为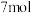 时,正极通入的
时,正极通入的 在标准状况下的体积为
在标准状况下的体积为_______ (假设能量全部转化为电能)。
II.工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。图中路线a、b、c是工业制备硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电固氮过程中生成硝酸的途径。

(1)N2在常温下性质很稳定,任意写出一种与此性质有关的用途:_____ 。
(2)实验室制取NH3的化学方程式为_____ 。
(3)下列环境问题与氮的氧化物排放无关的是_____ 。
a.酸雨 b.光化学烟雾 c.臭氧层空洞 d.白色污染
(4)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程_____
(5)有一瓶稀硫酸和稀硝酸的混合溶液,其中c(H2SO4)=2.0 mol•L-1,c(HNO3)=1.0 mol•L-1取100mL该混合溶液与12.8g铜粉反应,标准状况下生成NO的体积为___________ L。
I.(1)已知:S2Cl2(l)+Cl2(g)=2SCl2(l) ΔH=-50.2 kJ·mol-1。断裂1mol Cl—Cl键、1mol S—S键分别需要吸收243kJ、268kJ的能量,则断裂1mol S—Cl键需要吸收的能量为
(2)某容积不变的密闭容器中发生如下反应:2SO2(g)+O2(g)⇌2SO3(g) △H=-197 kJ·mol-1。
下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体的密度保持不变
c.SO3和O2的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol SO2
(3)如图所示,左侧石墨上通入
 ,右侧石墨上通入
,右侧石墨上通入 ,电解质溶液为
,电解质溶液为 溶液。完成下列问题:
溶液。完成下列问题:
①负极反应式为
②放电时
 向
向③当外电路通过电子的物质的量为
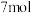 时,正极通入的
时,正极通入的 在标准状况下的体积为
在标准状况下的体积为II.工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。图中路线a、b、c是工业制备硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电固氮过程中生成硝酸的途径。

(1)N2在常温下性质很稳定,任意写出一种与此性质有关的用途:
(2)实验室制取NH3的化学方程式为
(3)下列环境问题与氮的氧化物排放无关的是
a.酸雨 b.光化学烟雾 c.臭氧层空洞 d.白色污染
(4)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程
(5)有一瓶稀硫酸和稀硝酸的混合溶液,其中c(H2SO4)=2.0 mol•L-1,c(HNO3)=1.0 mol•L-1取100mL该混合溶液与12.8g铜粉反应,标准状况下生成NO的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】煤是重要能源。燃煤会释放 、
、 等有毒气体。消除有毒气体的研究和实践从未停止。用
等有毒气体。消除有毒气体的研究和实践从未停止。用 可消除
可消除 。
。
反应①: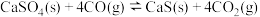 (放热反应)
(放热反应)
反应②: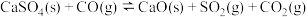 (吸热反应)
(吸热反应)
(1)其他条件不变,增加 的用量(质量),反应①的速率_______
的用量(质量),反应①的速率_______
(2)若在容积为1L的密闭装置中仅发生反应①,20分钟后,固体的质量减少了3.2g,则 的反应速率为_______,不能说明反应①一定达到平衡状态的是。
的反应速率为_______,不能说明反应①一定达到平衡状态的是。
(3)为了提高反应②的 的吸收率,可行的措施是
的吸收率,可行的措施是_______ 、_______ (2条)。
(4)补全图中反应②的能量变化示意图_____ (即注明生成物能量的大致位置)

(5)若反应①、②同时发生,一段时间后均到达了平衡,升高温度,均再次达到平衡,发现 的吸收率减小,分析可能的原因是
的吸收率减小,分析可能的原因是_______ 。
 、
、 等有毒气体。消除有毒气体的研究和实践从未停止。用
等有毒气体。消除有毒气体的研究和实践从未停止。用 可消除
可消除 。
。反应①:
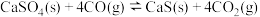 (放热反应)
(放热反应)反应②:
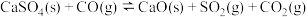 (吸热反应)
(吸热反应)(1)其他条件不变,增加
 的用量(质量),反应①的速率_______
的用量(质量),反应①的速率_______| A.增大 | B.减小 | C.不变 | D.无法判断 |
 的反应速率为_______,不能说明反应①一定达到平衡状态的是。
的反应速率为_______,不能说明反应①一定达到平衡状态的是。| A.压强不变 | B.气体的密度不变 |
C.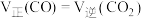 | D. 、 、 浓度相等 浓度相等 |
 的吸收率,可行的措施是
的吸收率,可行的措施是(4)补全图中反应②的能量变化示意图

(5)若反应①、②同时发生,一段时间后均到达了平衡,升高温度,均再次达到平衡,发现
 的吸收率减小,分析可能的原因是
的吸收率减小,分析可能的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的______ 。(填序号)
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
(2)下列可以证明H2(g)+I2(g) 2HI(g)已达平衡状态的是
2HI(g)已达平衡状态的是______ 。(填序号)
①单位时间内生成n mol H2的同时,生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分含量w(HI)=w(I2) ④反应速率v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和体积一定时,容器内气体颜色不再变化
⑨条件一定,混合气体的平均相对分子质量不再变化
(3)已知下列反应的平衡常数:①H2(g)+S(s) H2S(g),K1;
H2S(g),K1;
②S(s)+O2(g) SO2(g),K2;则反应H2(g)+SO2(g)
SO2(g),K2;则反应H2(g)+SO2(g)  O2(g)+H2S(g)的平衡常数是
O2(g)+H2S(g)的平衡常数是______ 。(用K1,K2 的代数式表示)
(4)已知:①2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol
②2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为______ 。
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
(2)下列可以证明H2(g)+I2(g)
 2HI(g)已达平衡状态的是
2HI(g)已达平衡状态的是①单位时间内生成n mol H2的同时,生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分含量w(HI)=w(I2) ④反应速率v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和体积一定时,容器内气体颜色不再变化
⑨条件一定,混合气体的平均相对分子质量不再变化
(3)已知下列反应的平衡常数:①H2(g)+S(s)
 H2S(g),K1;
H2S(g),K1;②S(s)+O2(g)
 SO2(g),K2;则反应H2(g)+SO2(g)
SO2(g),K2;则反应H2(g)+SO2(g)  O2(g)+H2S(g)的平衡常数是
O2(g)+H2S(g)的平衡常数是(4)已知:①2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol
②2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】已知A(g)+B(g)⇌C(g)+D(g)反应的平衡常数和温度的关系如表:
回答下列问题:
(1)该反应的平衡常数表达式K=_______ ,∆H_______ 0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1.,则6s时c(A)=_______ mol•L-1,C的物质的量为_______ mol;若反应经一段时间后,达到平衡时A的转化率为_______ ,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为_______ ;
(3)1200℃时反应C(g)+D(g)⇌A(g)+B(g)的平衡常数的值为_______ 。
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K=
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1.,则6s时c(A)=
(3)1200℃时反应C(g)+D(g)⇌A(g)+B(g)的平衡常数的值为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】994 K,当H2缓慢通过过量的块状固体CoO时,部分CoO被还原为固体Co。在流出的平衡气体中H2的物质的量分数为2.50%; 在同一温度,若用CO还原固体CoO时平衡气体中CO的物质的量分数为1.92%。 如果994 K时物质的量比为1:2的一氧化碳和水蒸气的混合物在一定条件下反应,问:
(1)一氧化碳的平衡转化率大约是多少___________ ?
(2)欲获得较纯的H2,请简要说明在生产工艺上应采取的措施___________ 。
(3)994 K,当H2缓慢通过过量的纳米CoO固体粉末时,部分CoO被还原为固体Co。在相同的反应时间内,与块状固体CoO相比,采用纳米固体CoO时流出的平衡气体中H2的物质的量分数将怎样变化___________ ?为什么___________ ?
(1)一氧化碳的平衡转化率大约是多少
(2)欲获得较纯的H2,请简要说明在生产工艺上应采取的措施
(3)994 K,当H2缓慢通过过量的纳米CoO固体粉末时,部分CoO被还原为固体Co。在相同的反应时间内,与块状固体CoO相比,采用纳米固体CoO时流出的平衡气体中H2的物质的量分数将怎样变化
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】化学反应的过程,既有物质的转化过程,也有化学能与热能或其他能量的转化过程。
已知反应3A(g)+B(g) 2C(g)+D(g)的能量变化如图所示。
2C(g)+D(g)的能量变化如图所示。

(1)该反应_______ (填“吸收”或“释放”)_______ (用含 、
、 的式子表示)kJ能量。
的式子表示)kJ能量。
(2)断开3 mol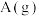 和1 mol
和1 mol  中的化学键吸收的能量
中的化学键吸收的能量_______ (填“>”、“<”或“=”)形成2 mol  和1 mol
和1 mol  中的化学键释放的能量。
中的化学键释放的能量。
(3)恒温下,在2 L恒容密闭容器中加入3 mol A、2 mol B,2 min末测得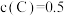 mol·L
mol·L 。
。
①2 min末,B的物质的量浓度为_______ 。
②下列说法正确的是_______ (填标号)。
A.向容器中通入少量的He(不参与反应),正反应速率减慢
B.总压强保持不变时,反应达到平衡状态
C.从容器中抽走部分D,正反应速率加快,逆反应速率减慢
(4)以反应 为原理设计成燃料电池,其利用率高,装置如图所示。
为原理设计成燃料电池,其利用率高,装置如图所示。
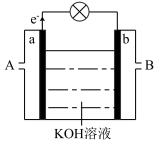
①A处加入的是_______ ,a处的电极反应式是_______ 。
②当消耗标准状况下3.36 L O2时,导线上转移的电子的物质的量是_______ mol。
已知反应3A(g)+B(g)
 2C(g)+D(g)的能量变化如图所示。
2C(g)+D(g)的能量变化如图所示。
(1)该反应
 、
、 的式子表示)kJ能量。
的式子表示)kJ能量。(2)断开3 mol
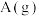 和1 mol
和1 mol  中的化学键吸收的能量
中的化学键吸收的能量 和1 mol
和1 mol  中的化学键释放的能量。
中的化学键释放的能量。(3)恒温下,在2 L恒容密闭容器中加入3 mol A、2 mol B,2 min末测得
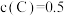 mol·L
mol·L 。
。①2 min末,B的物质的量浓度为
②下列说法正确的是
A.向容器中通入少量的He(不参与反应),正反应速率减慢
B.总压强保持不变时,反应达到平衡状态
C.从容器中抽走部分D,正反应速率加快,逆反应速率减慢
(4)以反应
 为原理设计成燃料电池,其利用率高,装置如图所示。
为原理设计成燃料电池,其利用率高,装置如图所示。
①A处加入的是
②当消耗标准状况下3.36 L O2时,导线上转移的电子的物质的量是
您最近一年使用:0次



