设NA为阿伏加德罗常数值。关于常温下pH=3的CH3COOH溶液,下列说法正确的是
| A.每升溶液中的H+数目为0.003NA |
| B.溶液中,c(OH-)=c(CH3COO-)+c(H+) |
| C.加水稀释能使电离度和溶液pH均增大 |
| D.加入CH3COONa固体,溶液酸性增强 |
2020·广西北海·一模 查看更多[2]
更新时间:2020-11-28 15:00:21
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列说法正确的是
A.反应 △H,若正反应的活化能为 △H,若正反应的活化能为 ,逆反应的活化能为 ,逆反应的活化能为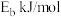 ,则△H= ,则△H= |
B.已知 的键能分别是 的键能分别是 则 则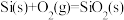 的△H= 的△H= |
C.将0.2 mol/L的 溶液与0.1 mol/L的 溶液与0.1 mol/L的 溶液等体积混合后,溶液中有关粒子的浓度满足下列关系: 溶液等体积混合后,溶液中有关粒子的浓度满足下列关系: |
D.将浓度为0.1 mol/L HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变, 始终保持增大 始终保持增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列关系的比较中,正确的是

A.离子半径: |
B.热稳定性: |
C.结合 的能力: 的能力: |
D.相同pH的HCl和 加水稀释相同倍数,pH: 加水稀释相同倍数,pH: |
您最近一年使用:0次
单选题
|
适中
(0.65)
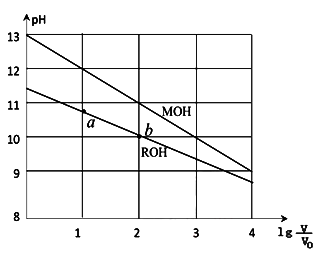
【推荐3】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随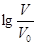 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
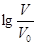 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当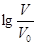 =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则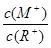 增大 增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】常温下,Na2A溶液中H2A、HA-、A2-的物质的量分数与pH的关系如下图。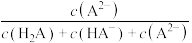
下列表述不正确 的是

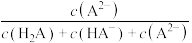
下列表述
| A.0.1 mol·L-1 H2A溶液中,c(H2A) + c(HA-) + c(A2-) = 0.1 mol·L-1 |
| B.在 0.1 mol·L-1 NaHA溶液中, c(HA-) > c(A2-) > c(H2A) |
| C.将等物质的量的NaHA、Na2A溶于水中,所得溶液的pH为4.2 |
| D.M点对应的pH为2.7 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知草酸 (H2C2O4)为二元弱酸, 、
、 、
、 三种微粒的物质的量分数(φ)与溶液pH的关系如题图所示。室温下,通过下列实验探究草酸的性质。下列说法正确的是
三种微粒的物质的量分数(φ)与溶液pH的关系如题图所示。室温下,通过下列实验探究草酸的性质。下列说法正确的是

 、
、 、
、 三种微粒的物质的量分数(φ)与溶液pH的关系如题图所示。室温下,通过下列实验探究草酸的性质。下列说法正确的是
三种微粒的物质的量分数(φ)与溶液pH的关系如题图所示。室温下,通过下列实验探究草酸的性质。下列说法正确的是
A.向 草酸溶液中加入等浓度的KOH溶液10mL所得溶液中: 草酸溶液中加入等浓度的KOH溶液10mL所得溶液中: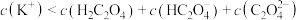 |
B.草酸的 |
C.向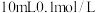 草酸溶液中逐滴加入等浓度的KOH溶液至 草酸溶液中逐滴加入等浓度的KOH溶液至 ,所得溶液中: ,所得溶液中: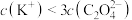 |
D.向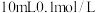 草酸溶液中加入过量氢氧化钙溶液,产生白色沉淀,反应离子方程式为: 草酸溶液中加入过量氢氧化钙溶液,产生白色沉淀,反应离子方程式为: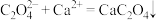 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】在100mL0.1mol/LCH3COOH溶液中,欲使CH3COOH的电离程度和溶液的pH都增大,可采用的方法是
| A.加少量的1mol/LNaOH溶液 | B.加少量1mol/L盐酸 |
| C.加少量CH3COONa固体 | D.微热 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列图示与对应的叙述相符的是


| A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 |
| B.图乙表示0.1LpH=2的HCl溶液加水稀释至VL, pH随lgV的变化 |
| C.图丙表示不同温度下水溶液中H+和OH-浓度变化的曲线,图中温度T2>T1 |
D.图丁表示同一温度下,再不同容积的容器中进行反应2BaO2(s) 2BaO(S)+O2(g),O2的平衡浓度与容器容积的关系 2BaO(S)+O2(g),O2的平衡浓度与容器容积的关系 |
您最近一年使用:0次

 ,该溶液中一定可以大量存在:
,该溶液中一定可以大量存在:
 、等体积的
、等体积的 和氨水分别加水稀释m倍、n倍,若稀释后
和氨水分别加水稀释m倍、n倍,若稀释后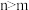
 的
的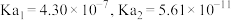 ,HClO的
,HClO的 ,则反应
,则反应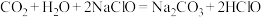 能够成立
能够成立 ,可用勒夏特列原理解释
,可用勒夏特列原理解释 CH3COO-+H+,Ka=1.75×10-5。以下说法正确的是
CH3COO-+H+,Ka=1.75×10-5。以下说法正确的是 值增大
值增大

