七水合硫酸亚铁( )是一种重要的食品或饲料添加剂、颜料及电子工业的原材料。某同学设计了利用工业烧渣并采用如图流程来制备七水合硫酸亚铁:
)是一种重要的食品或饲料添加剂、颜料及电子工业的原材料。某同学设计了利用工业烧渣并采用如图流程来制备七水合硫酸亚铁:

回答下列问题
(1)工业烧渣与稀硫酸反应的离子反应有: ,②
,②___________ 。
(2)加入的试剂 是:
是:___________ 。
A. B.
B. C.
C. D.
D.
(3)若需检验还原后的 溶液中是否存在有
溶液中是否存在有 ,可选择的方法是取2-3mL试液,在其中滴加
,可选择的方法是取2-3mL试液,在其中滴加___________ 溶液(填化学式),当___________ 时(填实验现象),说明溶液中存在 。
。
(4)利用工业烧渣还可以制得一种重要的净水剂 ,其基本原理是先由烧渣制得氢氧化铁,再将氢氧化铁与
,其基本原理是先由烧渣制得氢氧化铁,再将氢氧化铁与 、烧碱在40℃反应,即可制备
、烧碱在40℃反应,即可制备 ,其中
,其中 被还原成
被还原成 ,此方法称为“湿法”;请写出湿法制备
,此方法称为“湿法”;请写出湿法制备 的化学方程式:
的化学方程式:___________ 。
(5)制备 还有一方法称为“干法”,其反应原理为:
还有一方法称为“干法”,其反应原理为: ;若用
;若用 替代
替代 进行上述反应,当标准状况下产生
进行上述反应,当标准状况下产生 时,则需消耗
时,则需消耗
___________ 
 )是一种重要的食品或饲料添加剂、颜料及电子工业的原材料。某同学设计了利用工业烧渣并采用如图流程来制备七水合硫酸亚铁:
)是一种重要的食品或饲料添加剂、颜料及电子工业的原材料。某同学设计了利用工业烧渣并采用如图流程来制备七水合硫酸亚铁:
回答下列问题
(1)工业烧渣与稀硫酸反应的离子反应有:
 ,②
,②(2)加入的试剂
 是:
是:A.
 B.
B. C.
C. D.
D.
(3)若需检验还原后的
 溶液中是否存在有
溶液中是否存在有 ,可选择的方法是取2-3mL试液,在其中滴加
,可选择的方法是取2-3mL试液,在其中滴加 。
。(4)利用工业烧渣还可以制得一种重要的净水剂
 ,其基本原理是先由烧渣制得氢氧化铁,再将氢氧化铁与
,其基本原理是先由烧渣制得氢氧化铁,再将氢氧化铁与 、烧碱在40℃反应,即可制备
、烧碱在40℃反应,即可制备 ,其中
,其中 被还原成
被还原成 ,此方法称为“湿法”;请写出湿法制备
,此方法称为“湿法”;请写出湿法制备 的化学方程式:
的化学方程式:(5)制备
 还有一方法称为“干法”,其反应原理为:
还有一方法称为“干法”,其反应原理为: ;若用
;若用 替代
替代 进行上述反应,当标准状况下产生
进行上述反应,当标准状况下产生 时,则需消耗
时,则需消耗

更新时间:2021-01-10 17:20:12
|
相似题推荐
【推荐1】Ⅰ.完成下列问题
(1)我国宋代《梦溪笔谈》中记叙了胆矾和铜的炼制过程:“信州铅山县有苦泉,煮之则得胆矾。熬胆矾铁釜,人之亦化为铜。”该炼制过程中没有涉及到的变化是_______
(2)为实现下列物质之间的转化,需要加入还原剂才能实现的是_______
(3)硫单质在反应3S+6KOH 2K2S+K2SO3+3H2O中的变化是_______
2K2S+K2SO3+3H2O中的变化是_______
(4)3Cl2+6KOH(浓) KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为_______
KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为_______
(5)神舟十三号载人飞船的燃料可为肼(N2H4),发射时发生的反应为:2N2H4+N2O4=3N2+4H2O,下列说法正确的是
(6)某溶液中可能含有H+、Fe2+、Na+、CO 、SO
、SO 、NO
、NO ,若H+和NO
,若H+和NO 的浓度分别为0.1mol·L-1、0.12mol·L-1,则溶液中一定大量存在_______
的浓度分别为0.1mol·L-1、0.12mol·L-1,则溶液中一定大量存在_______
Ⅱ.实验室用100mL浓盐酸跟足量的KClO3固体共热制取Cl2,反应的化学方程式为:KClO3+6HCl(浓) KCl+3Cl2↑+3H2O。
KCl+3Cl2↑+3H2O。
(7)用单线桥标出电子转移的方向和数目___________ 。
(8)此反应中,氧化剂为:___________ (填化学式),被氧化的元素为___________ 。
(9)此反应中,氧化产物与还原产物的质量之比为:___________ 。
(10)当有3.36L(STP)Cl2生成时,反应中转移的电子数为___________ 个。
(1)我国宋代《梦溪笔谈》中记叙了胆矾和铜的炼制过程:“信州铅山县有苦泉,煮之则得胆矾。熬胆矾铁釜,人之亦化为铜。”该炼制过程中没有涉及到的变化是_______
| A.复分解反应 | B.离子反应 | C.置换反应 | D.蒸发结晶 |
| A.KClO3→KCl | B.CuO→Cu | C.Cu→Cu(NO3)2 | D.HCO →CO2 →CO2 |
 2K2S+K2SO3+3H2O中的变化是_______
2K2S+K2SO3+3H2O中的变化是_______| A.被氧化 | B.被还原 |
| C.既被氧化又被还原 | D.既未被氧化又未被还原 |
 KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为_______
KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为_______| A.1:5 | B.4:1 | C.5:1 | D.1:4 |
| A.肼在反应中作氧化剂 |
| B.反应中每生成1个H2O转移4个电子 |
| C.N2O4在反应中被氧化 |
| D.氧化产物与还原产物的物质的量之比是2:1 |
 、SO
、SO 、NO
、NO ,若H+和NO
,若H+和NO 的浓度分别为0.1mol·L-1、0.12mol·L-1,则溶液中一定大量存在_______
的浓度分别为0.1mol·L-1、0.12mol·L-1,则溶液中一定大量存在_______| A.Fe2+ | B.Na+ | C.CO | D.SO |
Ⅱ.实验室用100mL浓盐酸跟足量的KClO3固体共热制取Cl2,反应的化学方程式为:KClO3+6HCl(浓)
 KCl+3Cl2↑+3H2O。
KCl+3Cl2↑+3H2O。(7)用单线桥标出电子转移的方向和数目
(8)此反应中,氧化剂为:
(9)此反应中,氧化产物与还原产物的质量之比为:
(10)当有3.36L(STP)Cl2生成时,反应中转移的电子数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】新冠肺炎期间,化学消毒剂大显身手。高铁酸钾( ,
,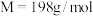 )是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌消毒,工业制备高铁酸钾的方法主要有湿法和干法两种。实验室模拟湿法制备高铁酸钾的流程如下:
)是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌消毒,工业制备高铁酸钾的方法主要有湿法和干法两种。实验室模拟湿法制备高铁酸钾的流程如下:

回答下列问题:
(1)配制上述NaOH溶液,下列操作可能导致溶液浓度偏大的有___________
A.将NaOH放在滤纸上称量 B.摇匀后发现液面低于刻度线,再加水至刻度线
C.定容时俯视刻度线 D.容量瓶洗净之后未干燥
E.NaOH在烧杯中溶解后;未经冷却就立即转移
(2)NaOH溶液应置于冰水浴中,否则温度升高将发生如下副反应: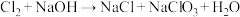 (未配平)
(未配平)
①若有0.6mol 发生该副反应,转移的电子的数目为
发生该副反应,转移的电子的数目为___________ ;
②若反应后溶液中NaCl和 的物质的量之比为10:1,则生成NaCl和NaClO的物质的量之比为
的物质的量之比为10:1,则生成NaCl和NaClO的物质的量之比为___________
(3)氧化过程中溶液保持碱性,写出反应的离子方程式:___________ ;
(4)产品经干燥后得到纯品99g,则 的产率为
的产率为___________ (用百分数表示)。
(5)工业干法制备高铁酸钾的第一步反应为: ,该反应中氧化剂和还原剂的物质的量之比为
,该反应中氧化剂和还原剂的物质的量之比为___________ 。第二步反应为: ,试解释该反应能发生的原因
,试解释该反应能发生的原因___________
 ,
,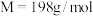 )是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌消毒,工业制备高铁酸钾的方法主要有湿法和干法两种。实验室模拟湿法制备高铁酸钾的流程如下:
)是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌消毒,工业制备高铁酸钾的方法主要有湿法和干法两种。实验室模拟湿法制备高铁酸钾的流程如下:
回答下列问题:
(1)配制上述NaOH溶液,下列操作可能导致溶液浓度偏大的有
A.将NaOH放在滤纸上称量 B.摇匀后发现液面低于刻度线,再加水至刻度线
C.定容时俯视刻度线 D.容量瓶洗净之后未干燥
E.NaOH在烧杯中溶解后;未经冷却就立即转移
(2)NaOH溶液应置于冰水浴中,否则温度升高将发生如下副反应:
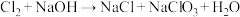 (未配平)
(未配平)①若有0.6mol
 发生该副反应,转移的电子的数目为
发生该副反应,转移的电子的数目为②若反应后溶液中NaCl和
 的物质的量之比为10:1,则生成NaCl和NaClO的物质的量之比为
的物质的量之比为10:1,则生成NaCl和NaClO的物质的量之比为(3)氧化过程中溶液保持碱性,写出反应的离子方程式:
(4)产品经干燥后得到纯品99g,则
 的产率为
的产率为(5)工业干法制备高铁酸钾的第一步反应为:
 ,该反应中氧化剂和还原剂的物质的量之比为
,该反应中氧化剂和还原剂的物质的量之比为 ,试解释该反应能发生的原因
,试解释该反应能发生的原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】硫酸亚铁晶体 俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的
俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的 。硫酸亚铁的用途广泛,可以制备如下图所示物质。
。硫酸亚铁的用途广泛,可以制备如下图所示物质。
回答下列问题:
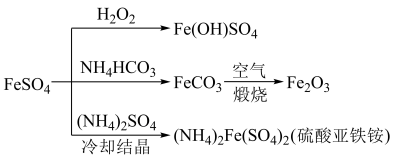
(1)实验室保存硫酸亚铁溶液时,往往加入一定量的铁粉,其目的是___________ ,通过做实验发现,用 氧化硫酸亚铁获得
氧化硫酸亚铁获得 比在空气中被氧化速率快很多,但是
比在空气中被氧化速率快很多,但是 的用量比理论值高很多,其原因是
的用量比理论值高很多,其原因是___________ 。
(2)获取氧化铁过程中,向硫酸亚铁溶液逐滴加入 溶液,控制
溶液,控制 小于6,经过滤、洗涤、干燥获取纯净的
小于6,经过滤、洗涤、干燥获取纯净的 ,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使
,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使 充分反应,则该反应中氧化剂与还原剂的物质的量之比为
充分反应,则该反应中氧化剂与还原剂的物质的量之比为___________ 。请写出 一种用途是
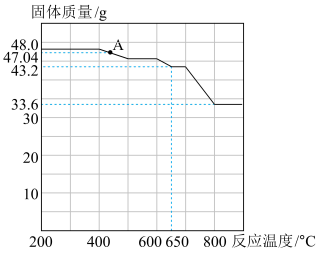
一种用途是___________ 。查阅资料知,在不同温度下 被
被 还原的产物不同。固体质量与反应温度的关系如图所示。则
还原的产物不同。固体质量与反应温度的关系如图所示。则 点时对应固体化学式为
点时对应固体化学式为___________ 。
(3)实验室还可以利用如图所示装置制备并较长时间观察 白色沉淀。
白色沉淀。
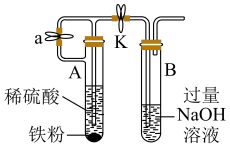
①为了完成实验目的,则装置 中长玻璃管伸到的位置是
中长玻璃管伸到的位置是___________ (填“实线”或“虚线”);
②向装置 先加入铁粉,再加入稀硫酸,在装置
先加入铁粉,再加入稀硫酸,在装置 端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是
端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是___________ 。
 俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的
俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的 。硫酸亚铁的用途广泛,可以制备如下图所示物质。
。硫酸亚铁的用途广泛,可以制备如下图所示物质。回答下列问题:

(1)实验室保存硫酸亚铁溶液时,往往加入一定量的铁粉,其目的是
 氧化硫酸亚铁获得
氧化硫酸亚铁获得 比在空气中被氧化速率快很多,但是
比在空气中被氧化速率快很多,但是 的用量比理论值高很多,其原因是
的用量比理论值高很多,其原因是(2)获取氧化铁过程中,向硫酸亚铁溶液逐滴加入
 溶液,控制
溶液,控制 小于6,经过滤、洗涤、干燥获取纯净的
小于6,经过滤、洗涤、干燥获取纯净的 ,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使
,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使 充分反应,则该反应中氧化剂与还原剂的物质的量之比为
充分反应,则该反应中氧化剂与还原剂的物质的量之比为 一种用途是
一种用途是 被
被 还原的产物不同。固体质量与反应温度的关系如图所示。则
还原的产物不同。固体质量与反应温度的关系如图所示。则 点时对应固体化学式为
点时对应固体化学式为
(3)实验室还可以利用如图所示装置制备并较长时间观察
 白色沉淀。
白色沉淀。
①为了完成实验目的,则装置
 中长玻璃管伸到的位置是
中长玻璃管伸到的位置是②向装置
 先加入铁粉,再加入稀硫酸,在装置
先加入铁粉,再加入稀硫酸,在装置 端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是
端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】某研究小组为“变废为宝”,将一批废弃的线路板简单处理后,得到含Cu、Al及少量Fe的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线。_______ 、_______ 。
(2)步骤①中能否用稀盐酸代替稀硫酸?_______ (填“能”或“否”)。
(3)为了将Fe2+氧化成Fe3+且不引入杂质,氧化剂A最好是_______ (填化学式)。
(4)若步骤②中有红棕色气体生成,该离子反应方程式为_______ ;步骤②中可通过控制H2SO4和HNO3的量,让 尽可能转化为气体逸出,则溶液B的溶质是
尽可能转化为气体逸出,则溶液B的溶质是_______ (填化学式);则从溶液B获得硫酸铜晶体的方法是_______ 。

(2)步骤①中能否用稀盐酸代替稀硫酸?
(3)为了将Fe2+氧化成Fe3+且不引入杂质,氧化剂A最好是
(4)若步骤②中有红棕色气体生成,该离子反应方程式为
 尽可能转化为气体逸出,则溶液B的溶质是
尽可能转化为气体逸出,则溶液B的溶质是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】某研究小组以工厂废渣(Fe3O4、Al2O3、SiO2)为原料制取Fe2O3工艺流程如图。回答下列问题:
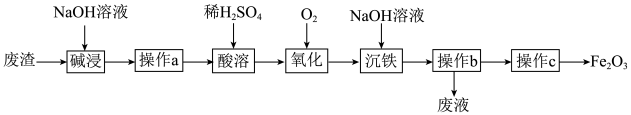
(1)“碱浸”时可能发生的反应有____ 个。“酸溶”时发生反应的化学方程式为______ 。
(2)“操作a”的名称为____ ,用到的玻璃仪器有玻璃棒、______ 。
(3)写出“氧化”时的离子方程式_______ 。检验氧化是否完全可加入的试剂是_______ 。
(4)操作c包括洗涤等一系列操作,洗涤时证明沉淀洗涤干净的操作_______ 。
(5)“沉铁”步骤可观察到现象是_______ 。

(1)“碱浸”时可能发生的反应有
(2)“操作a”的名称为
(3)写出“氧化”时的离子方程式
(4)操作c包括洗涤等一系列操作,洗涤时证明沉淀洗涤干净的操作
(5)“沉铁”步骤可观察到现象是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
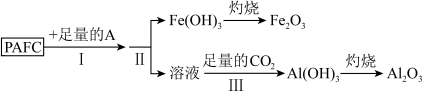
【推荐3】高效净水剂聚合氯化铝铁(PAFC)的组成可表示为 ,该物质广泛应用于日常生活用水和工业废水的处理。回答下列问题:
,该物质广泛应用于日常生活用水和工业废水的处理。回答下列问题:
(1)为检测PAFC中铝和铁元素的含量,采用如图所示流程进行。 中的A是
中的A是___________ 。
②步骤 中发生反应生成
中发生反应生成 中溶液离子方程式为
中溶液离子方程式为___________ 。
(2)某工厂欲以工业废料(铁、铁和铝的氧化物)为原料制取PAFC,设计如下流程:___________ , 的电子式为
的电子式为___________ 。
②所得酸性溶液中,一定大量存在的离子有___________ ;可能存在的离子有___________ ,证明该离子确实存在,可采用的操作(必须指明所采用的试剂及观察到的观象)是___________ 。
③步骤 中发生反应的离子方程式为
中发生反应的离子方程式为___________ 。
 ,该物质广泛应用于日常生活用水和工业废水的处理。回答下列问题:
,该物质广泛应用于日常生活用水和工业废水的处理。回答下列问题:(1)为检测PAFC中铝和铁元素的含量,采用如图所示流程进行。
 中的A是
中的A是②步骤
 中发生反应生成
中发生反应生成 中溶液离子方程式为
中溶液离子方程式为(2)某工厂欲以工业废料(铁、铁和铝的氧化物)为原料制取PAFC,设计如下流程:

 的电子式为
的电子式为②所得酸性溶液中,一定大量存在的离子有
③步骤
 中发生反应的离子方程式为
中发生反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】硫酸亚铁晶体(FeSO4∙7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
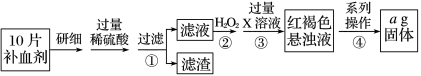
请回答下列问题:
(1)向操作①的滤液中滴加___________ ,可以检验该补血剂是否变质。
(2)操作②中反应的离子方程式为___________ 。
(3)操作③中X溶液使用过量的目的是___________ 。
(4)操作④中一系列处理的操作步骤:过滤、___________ 、干燥、灼烧、_______ 、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为___________ g。(用含a的代数式表示)

请回答下列问题:
(1)向操作①的滤液中滴加
(2)操作②中反应的离子方程式为
(3)操作③中X溶液使用过量的目的是
(4)操作④中一系列处理的操作步骤:过滤、
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为
您最近一年使用:0次
【推荐2】东汉时期,古人就将含四种元素的某矿石 放置于密闭容器内加热得到硫酸,为探究矿石
放置于密闭容器内加热得到硫酸,为探究矿石 的组成及感受过程,某同学进行了如下实验:
的组成及感受过程,某同学进行了如下实验:__________ 。
(2)写出矿石 受热分解的方程式
受热分解的方程式___________ 。
(3)当溶液 中加入某试剂后生产白色沉淀,该试剂可能的是___________。
中加入某试剂后生产白色沉淀,该试剂可能的是___________。
(4)为确定红棕色固体中的金属元素及价态。请设计实验证明___________ 。
 放置于密闭容器内加热得到硫酸,为探究矿石
放置于密闭容器内加热得到硫酸,为探究矿石 的组成及感受过程,某同学进行了如下实验:
的组成及感受过程,某同学进行了如下实验:
(2)写出矿石
 受热分解的方程式
受热分解的方程式(3)当溶液
 中加入某试剂后生产白色沉淀,该试剂可能的是___________。
中加入某试剂后生产白色沉淀,该试剂可能的是___________。A. | B. | C. | D. |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】Fe2O3和Cu2O都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末的成分,该粉末可能是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4(Cu2O+2H+=Cu+Cu2++H2O),在空气中加热生成CuO。
提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物。
设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是___ 。
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红,则证明原固体粉末是____ ,写出发生反应的离子方程式(题目上已出现的可以不写)___ 、___ 。
查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4(Cu2O+2H+=Cu+Cu2++H2O),在空气中加热生成CuO。
提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物。
设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红,则证明原固体粉末是
您最近一年使用:0次



