在一定条件下,Na2CO3溶液存在水解平衡:CO +H2O
+H2O HCO
HCO +OH-。下列说法正确的是( )
+OH-。下列说法正确的是( )
 +H2O
+H2O HCO
HCO +OH-。下列说法正确的是( )
+OH-。下列说法正确的是( )| A.稀释溶液,各物质浓度均减小,平衡不移动 |
| B.通入CO2,平衡向正反应方向移动 |
C.升高温度,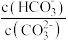 减小 减小 |
| D.加入NaOH固体,溶液pH增大 |
更新时间:2020-12-15 13:10:31
|
相似题推荐
多选题
|
较易
(0.85)
名校
解题方法
【推荐1】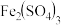 溶于一定量水中,溶液呈浅棕黄色(a)。加入少量浓盐酸黄色加深(b)。已知:
溶于一定量水中,溶液呈浅棕黄色(a)。加入少量浓盐酸黄色加深(b)。已知: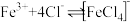 (黄色);浓度较小时
(黄色);浓度较小时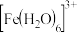 (用
(用 表示)几乎无色。取溶液进行如下实验,对现象的分析不正确的是
表示)几乎无色。取溶液进行如下实验,对现象的分析不正确的是
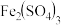 溶于一定量水中,溶液呈浅棕黄色(a)。加入少量浓盐酸黄色加深(b)。已知:
溶于一定量水中,溶液呈浅棕黄色(a)。加入少量浓盐酸黄色加深(b)。已知: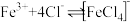 (黄色);浓度较小时
(黄色);浓度较小时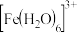 (用
(用 表示)几乎无色。取溶液进行如下实验,对现象的分析不正确的是
表示)几乎无色。取溶液进行如下实验,对现象的分析不正确的是A.测得溶液a的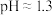 ,证明 ,证明 发生了水解 发生了水解 |
B.将溶液a加热,颜色加深,说明升温能促进 水解 水解 |
C.加入浓盐酸, 与 与 对 对 浓度大小的影响是一致的 浓度大小的影响是一致的 |
D.向b中加入 后,黄色褪去,说明 后,黄色褪去,说明 能抑制 能抑制 水解 水解 |
您最近半年使用:0次
多选题
|
较易
(0.85)
【推荐2】实验测得 0.5ml・L-1CH3COONa 溶液和 H2O 的 pH 随温度变化的曲线如图所示。下用说法正确的是


| A.随温度升高,CH3COONa 溶液的 c(OH-)增大 |
| B.随温度升高,H2O 的 pH 逐渐减小,是因为水中 c(H+)>c(OH-) |
| C.随温度升高,CH3COONa 溶液的 pH 变化是 Kw改变不大和水解平衡移动共同作用的结果 |
| D.随温度升高, CH3COONa 溶液的 pH 降低是因为 CH3COO-水解平衡向逆反应方向移动的结果 |
您最近半年使用:0次
多选题
|
较易
(0.85)
【推荐1】在Al3++3H2O Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是
Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是
 Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是
Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是| A.加热 | B.通入HCl |
| C.加入适量Na2CO3(s) | D.加入NaCl溶液 |
您最近半年使用:0次
多选题
|
较易
(0.85)
【推荐2】某溶液中FeCl3的水解反应已达平衡.FeCl3+3H2O  Fe(OH)3+3HCl若要使FeCl3的水解程度增大,应采取的方法是
Fe(OH)3+3HCl若要使FeCl3的水解程度增大,应采取的方法是
 Fe(OH)3+3HCl若要使FeCl3的水解程度增大,应采取的方法是
Fe(OH)3+3HCl若要使FeCl3的水解程度增大,应采取的方法是| A.加入NaHCO3 | B.加入AgNO3 | C.加FeCl3固体 | D.加热 |
您最近半年使用:0次
多选题
|
较易
(0.85)
名校
解题方法
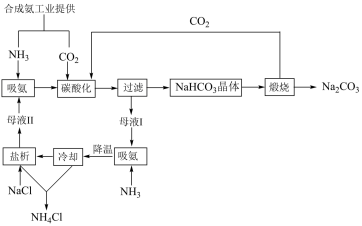
【推荐1】草酸亚铁晶体是生产感光材料的原料[Ksp(FeC2O4·2H2O)=3×10-7mol2·L-2],制备流程如下:

下列说法错误的是

下列说法错误的是
| A.可用K4Fe(CN)6溶液检验(NH4)2Fe(SO4)2是否变质 |
| B.步骤①酸化的目的是抑制Fe2+的水解 |
| C.步骤②反应为Fe2++H2C2O4+2H2O=FeC2O4·2H2O↓+2H+ |
| D.步骤③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥 |
您最近半年使用:0次
多选题
|
较易
(0.85)
解题方法
【推荐2】对于0.1 mol·L-1NH4Cl溶液,正确的是
| A.升高温度,溶液pH升高 | B.通入少量HCl气体,c(NH )和c(Cl-)均增大 )和c(Cl-)均增大 |
C.c(NH )+ c(OH-)=c(Cl-)+ c(H+) )+ c(OH-)=c(Cl-)+ c(H+) | D.c(Cl-)> c(H+)> c(NH )> c(OH-) )> c(OH-) |
您最近半年使用:0次

 2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大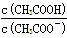 的值减小
的值减小