CuCl常用于有机合成催化剂,并用于颜料、防腐等工业。工业上以黄铜矿(主要成分是CuFeS2,另外还含有少量SiO2) 为主要原料制备CuCl的主要流程如下:

已知:CuCl难溶于水和乙醇,在空气中易被氧化,在水溶液中存在平衡:
CuCl(白色)+2C1- [CuCl3]2- (无色溶液)。
[CuCl3]2- (无色溶液)。
回答下列问题:
(1)流程中的“滤渣”的主要成分是________ (填化学式)。
(2)"溶液A"中含有硫酸铜、硫酸铁,则在一定条件下黄铜矿与稀硫酸、氧气反应的化学方程式为_____ 。
(3)当①中观察到___ 时(填实验现象),即表明反应已经完全,反应的离子方程式为_______ 。
(4)②中的“一系列操作”是____ 、过滤、用无水乙醇洗涤、真空干燥。真空干燥的目的是____ 。
(5)已知:常温下,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]= 8.0×10-38;溶液中离子浓度≤1.0×10 -5mol·L-1时,可认为该离子已沉淀完全。若溶液A中c(Cu2+)=0.5 mol·L-1,加入氧化铜(忽略溶液体积变化),使溶液中Fe3+恰好沉淀完全,此时是否有Cu(OH)2沉淀生成?______ (结合计算回答)。
(6)工业上还可以利用铜电极作阳极电解饱和食盐水制备CuCl,阳极的电极反应式为_____ 。

已知:CuCl难溶于水和乙醇,在空气中易被氧化,在水溶液中存在平衡:
CuCl(白色)+2C1-
 [CuCl3]2- (无色溶液)。
[CuCl3]2- (无色溶液)。回答下列问题:
(1)流程中的“滤渣”的主要成分是
(2)"溶液A"中含有硫酸铜、硫酸铁,则在一定条件下黄铜矿与稀硫酸、氧气反应的化学方程式为
(3)当①中观察到
(4)②中的“一系列操作”是
(5)已知:常温下,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]= 8.0×10-38;溶液中离子浓度≤1.0×10 -5mol·L-1时,可认为该离子已沉淀完全。若溶液A中c(Cu2+)=0.5 mol·L-1,加入氧化铜(忽略溶液体积变化),使溶液中Fe3+恰好沉淀完全,此时是否有Cu(OH)2沉淀生成?
(6)工业上还可以利用铜电极作阳极电解饱和食盐水制备CuCl,阳极的电极反应式为
更新时间:2020-12-31 17:21:18
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】Ca10(PO4)6(OH)2(羟基磷酸钙,简写HAP)是一种新型的环境功能矿物材料,可用于除去水体中的F-、Cd2+、Pb2+及Cu2+等。
(1)制备HAP的步骤如下:分别配制250mL浓度均为0.5 mol·L-1的Ca(NO3)2溶液和(NH4)2HPO4溶液(pH约为8),按n(Ca)/n(P)=1.67分别量取相应体积的溶液,加热至50℃,不断搅拌下,按特定的方式加料,强力搅拌1h,再经后续处理得到产品。
①特定的加料方式是__________ (填序号)。
a.将Ca(NO3)2溶液逐滴滴入(NH4)2HPO4溶液中, 再用氨水调节pH至10.5
b.将(NH4)2HPO4溶液逐滴滴入Ca(NO3)2溶液中,再用氨水调节pH至10.5
c.将(NH4)2HPO4溶液和氨水混合并调节pH至10.5,再滴入Ca(NO3)2溶液
②反应生成Ca10(PO4)6(OH)2的离子方程式为__________ 。
(2)HAP脱除F-的操作是:在聚四氟乙烯烧杯中加入50mL 10mg·L-1NaF溶液和0.15gCa10(PO4)6(OH)2,在恒温下振荡,每隔1h测定一次溶液中F-浓度,直至达到吸附平衡。
①实验中“烧杯”材质用“聚四氟乙烯”塑料而不用玻璃,其原因是__________ 。
②除氟反应形式之一是: Ca10(PO4)6(OH)2+20F- 10CaF2+6PO
10CaF2+6PO +2OH-,该反应的平衡常数K=
+2OH-,该反应的平衡常数K=__________ [用Ksp(CaF2)和Ksp(HAP)表示]。
(3)HAP脱除Pb(Ⅱ)包括物理吸附和溶解-沉淀吸附。物理吸附时,HAP的特定位可吸附溶液中某些阳离子;溶解-沉淀吸附的机理为:
Ca10(PO4)6(OH)2(s)+2H+(aq) 10Ca2+(aq)+6PO
10Ca2+(aq)+6PO (aq)+2H2O(l)(溶解)
(aq)+2H2O(l)(溶解)
10Pb2+(aq)+6PO (aq)+2H2O(l)
(aq)+2H2O(l) Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)
Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)
已知Pb(Ⅱ)的分布分数如图-1所示;一定条件下HAP对Pb(1)平衡吸附量与pH的关系如图-2所示。


①能使甲基橙显红色的Pb(Ⅱ)溶液中滴入少量NaOH至溶液呈中性,该过程中主要反应的离子方程式为__________ 。
②当pH<3.0时,pH越小HAP对Pb(Ⅱ)平衡吸附量稍减小,其原因是__________ 。
③当pH> 7.0时,生成的沉淀为__________ (填化学式);此时pH越大HAP对Pb(Ⅱ)平衡吸附量越小,其原因是__________ 。
(1)制备HAP的步骤如下:分别配制250mL浓度均为0.5 mol·L-1的Ca(NO3)2溶液和(NH4)2HPO4溶液(pH约为8),按n(Ca)/n(P)=1.67分别量取相应体积的溶液,加热至50℃,不断搅拌下,按特定的方式加料,强力搅拌1h,再经后续处理得到产品。
①特定的加料方式是
a.将Ca(NO3)2溶液逐滴滴入(NH4)2HPO4溶液中, 再用氨水调节pH至10.5
b.将(NH4)2HPO4溶液逐滴滴入Ca(NO3)2溶液中,再用氨水调节pH至10.5
c.将(NH4)2HPO4溶液和氨水混合并调节pH至10.5,再滴入Ca(NO3)2溶液
②反应生成Ca10(PO4)6(OH)2的离子方程式为
(2)HAP脱除F-的操作是:在聚四氟乙烯烧杯中加入50mL 10mg·L-1NaF溶液和0.15gCa10(PO4)6(OH)2,在恒温下振荡,每隔1h测定一次溶液中F-浓度,直至达到吸附平衡。
①实验中“烧杯”材质用“聚四氟乙烯”塑料而不用玻璃,其原因是
②除氟反应形式之一是: Ca10(PO4)6(OH)2+20F-
 10CaF2+6PO
10CaF2+6PO +2OH-,该反应的平衡常数K=
+2OH-,该反应的平衡常数K=(3)HAP脱除Pb(Ⅱ)包括物理吸附和溶解-沉淀吸附。物理吸附时,HAP的特定位可吸附溶液中某些阳离子;溶解-沉淀吸附的机理为:
Ca10(PO4)6(OH)2(s)+2H+(aq)
 10Ca2+(aq)+6PO
10Ca2+(aq)+6PO (aq)+2H2O(l)(溶解)
(aq)+2H2O(l)(溶解)10Pb2+(aq)+6PO
 (aq)+2H2O(l)
(aq)+2H2O(l) Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)
Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)已知Pb(Ⅱ)的分布分数如图-1所示;一定条件下HAP对Pb(1)平衡吸附量与pH的关系如图-2所示。


①能使甲基橙显红色的Pb(Ⅱ)溶液中滴入少量NaOH至溶液呈中性,该过程中主要反应的离子方程式为
②当pH<3.0时,pH越小HAP对Pb(Ⅱ)平衡吸附量稍减小,其原因是
③当pH> 7.0时,生成的沉淀为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
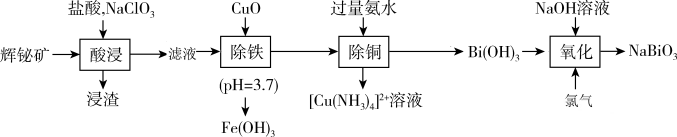
【推荐2】铋酸钠( ,相对分子质量为280)常用作分析试剂、氧化剂,还用于制药工业。它是一种浅黄色至褐色的无定形粉末。工业上以辉铋矿(主要成分是
,相对分子质量为280)常用作分析试剂、氧化剂,还用于制药工业。它是一种浅黄色至褐色的无定形粉末。工业上以辉铋矿(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备铋酸钠的流程如下:
等杂质)为原料制备铋酸钠的流程如下:
已知:滤液中含有 、
、 、
、 和
和 、
、 等离子。
等离子。
回答下列问题:
(1)浸渣的主要成分是_______ (填化学式);提高“酸浸”速率的措施有_______ (写出其中一条即可)。
(2)“酸浸”时, 参与的反应中氧化剂与还原剂的物质的量之比为
参与的反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)加入CuO粉末调节滤液 可除去其中的
可除去其中的 ,其原因是
,其原因是_______ 。
(4)“除铜”过程中, 先与氨水反应生成
先与氨水反应生成 沉淀,再溶于氨水生成
沉淀,再溶于氨水生成 。常温下,加入氨水使
。常温下,加入氨水使 沉淀完全,则所调节溶液的
沉淀完全,则所调节溶液的
_______ 。(计算结果保留1位小数)。(已知: 沉淀完全时的浓度为
沉淀完全时的浓度为 mol·L
mol·L ,
,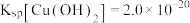 ,
, )
)
(5)已知 不溶于冷水,取少量
不溶于冷水,取少量 于试管中,加入浓盐酸,产生黄绿色气体,该反应的离子方程式为
于试管中,加入浓盐酸,产生黄绿色气体,该反应的离子方程式为_______ 。从 热溶液中得到
热溶液中得到 晶体的操作依次为
晶体的操作依次为_______ 、洗涤、干燥。
(6)取上述所制备的 产品10.00 g,加入足量稀硫酸和
产品10.00 g,加入足量稀硫酸和 稀溶液使其完全反应,再用1.20 mol·L
稀溶液使其完全反应,再用1.20 mol·L
 标准溶液滴定生成的
标准溶液滴定生成的 ,当溶液紫红色褪去,且半分钟内不再恢复原色,即达到滴定终点,重复此操作2~3次,平均消耗
,当溶液紫红色褪去,且半分钟内不再恢复原色,即达到滴定终点,重复此操作2~3次,平均消耗 标准溶液的体积为28.00 mL,该产品的纯度为
标准溶液的体积为28.00 mL,该产品的纯度为_______ %(计算结果保留3位有效数字)。(已知: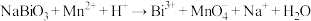 ,
,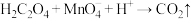
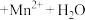 ,两离子反应方程式均未配平)
,两离子反应方程式均未配平)
 ,相对分子质量为280)常用作分析试剂、氧化剂,还用于制药工业。它是一种浅黄色至褐色的无定形粉末。工业上以辉铋矿(主要成分是
,相对分子质量为280)常用作分析试剂、氧化剂,还用于制药工业。它是一种浅黄色至褐色的无定形粉末。工业上以辉铋矿(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备铋酸钠的流程如下:
等杂质)为原料制备铋酸钠的流程如下:
已知:滤液中含有
 、
、 、
、 和
和 、
、 等离子。
等离子。回答下列问题:
(1)浸渣的主要成分是
(2)“酸浸”时,
 参与的反应中氧化剂与还原剂的物质的量之比为
参与的反应中氧化剂与还原剂的物质的量之比为(3)加入CuO粉末调节滤液
 可除去其中的
可除去其中的 ,其原因是
,其原因是(4)“除铜”过程中,
 先与氨水反应生成
先与氨水反应生成 沉淀,再溶于氨水生成
沉淀,再溶于氨水生成 。常温下,加入氨水使
。常温下,加入氨水使 沉淀完全,则所调节溶液的
沉淀完全,则所调节溶液的
 沉淀完全时的浓度为
沉淀完全时的浓度为 mol·L
mol·L ,
,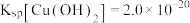 ,
, )
)(5)已知
 不溶于冷水,取少量
不溶于冷水,取少量 于试管中,加入浓盐酸,产生黄绿色气体,该反应的离子方程式为
于试管中,加入浓盐酸,产生黄绿色气体,该反应的离子方程式为 热溶液中得到
热溶液中得到 晶体的操作依次为
晶体的操作依次为(6)取上述所制备的
 产品10.00 g,加入足量稀硫酸和
产品10.00 g,加入足量稀硫酸和 稀溶液使其完全反应,再用1.20 mol·L
稀溶液使其完全反应,再用1.20 mol·L
 标准溶液滴定生成的
标准溶液滴定生成的 ,当溶液紫红色褪去,且半分钟内不再恢复原色,即达到滴定终点,重复此操作2~3次,平均消耗
,当溶液紫红色褪去,且半分钟内不再恢复原色,即达到滴定终点,重复此操作2~3次,平均消耗 标准溶液的体积为28.00 mL,该产品的纯度为
标准溶液的体积为28.00 mL,该产品的纯度为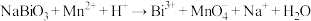 ,
,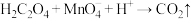
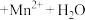 ,两离子反应方程式均未配平)
,两离子反应方程式均未配平)
您最近一年使用:0次
【推荐3】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,以某硫化锌精矿(主要成分是ZnS,还含有少量FeS等其他成分)为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)在该流程中可循环使用的物质是Zn和H2SO4,基态S原子占据最高能级的原子轨道的形状为_____ ,SO 的空间结构为
的空间结构为______ 。
(2)“焙烧”过程在氧气气氛的沸腾炉中进行,“焙砂”中铁元素主要以Fe3O4形式存在,写出“焙烧”过程中FeS主要发生反应的化学方程式:______ ;“含尘烟气”中的SO2可用氨水吸收,经循环利用后制取硫酸,用氨水吸收SO2至溶液的pH=5时,所得溶液中的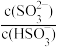 =
=_____ 。[已知:Ka1(H2SO3)=1.4×10-2;Ka2(H2SO3)=6.0×10-8]
(3)浸出液“净化”过程中加入的主要物质为锌粉,所得“滤渣”的成分为_____ (填化学式),分离“滤液”与“滤渣”的操作名称为_____ 。
(4)改进的锌冶炼工艺,采用了“氧压酸(稀硫酸)浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。
①下列设想的加快浸取反应速率的措施中不合理的是_____ (填标号)。
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS):ZnS(s)+Cu2+(aq) CuS(s)+Zn2+(aq),该反应的平衡常数K=
CuS(s)+Zn2+(aq),该反应的平衡常数K=____ 。[已知:Ksp(ZnS)=1.6×10-24,Ksp(CuS)=6.4×10-36]

回答下列问题:
(1)在该流程中可循环使用的物质是Zn和H2SO4,基态S原子占据最高能级的原子轨道的形状为
 的空间结构为
的空间结构为(2)“焙烧”过程在氧气气氛的沸腾炉中进行,“焙砂”中铁元素主要以Fe3O4形式存在,写出“焙烧”过程中FeS主要发生反应的化学方程式:
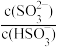 =
=(3)浸出液“净化”过程中加入的主要物质为锌粉,所得“滤渣”的成分为
(4)改进的锌冶炼工艺,采用了“氧压酸(稀硫酸)浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。
①下列设想的加快浸取反应速率的措施中不合理的是
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS):ZnS(s)+Cu2+(aq)
 CuS(s)+Zn2+(aq),该反应的平衡常数K=
CuS(s)+Zn2+(aq),该反应的平衡常数K=
您最近一年使用:0次
【推荐1】氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素 的碱性溶液制氢气的装置示意图
的碱性溶液制氢气的装置示意图 电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极
电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极 。
。
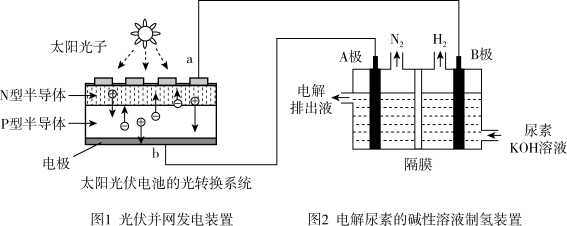
(1)图1中N型半导体为______  填“正极”或“负极”
填“正极”或“负极”
(2)该系统工作时,A极的电极反应式为______
(3)若A极产生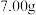
 ,则此时B极产生
,则此时B极产生______ L  标况下
标况下 。
。
 的碱性溶液制氢气的装置示意图
的碱性溶液制氢气的装置示意图 电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极
电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极 。
。
(1)图1中N型半导体为
 填“正极”或“负极”
填“正极”或“负极”
(2)该系统工作时,A极的电极反应式为
(3)若A极产生
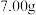
 ,则此时B极产生
,则此时B极产生 标况下
标况下 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】KMnO4和MnO2都是实验室常见药品,某小组同学对这两种物质做了如下探究。
I.从粗品(含有较多的MnO、MnCO3和Fe2O3)中获得MnO2,其工艺流程如图。
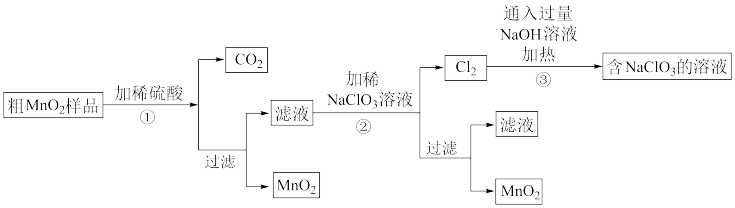
请回答下列问题:
(1)第①步操作中,加快酸溶速率的措施______ 。
(2)第②步操作中,NaClO3将Mn2+转化为MnO2,利用电解法也可实现这步转化,生成MnO2的电极反应式为______ 。
(3)第③步操作中,Cl2生成NaClO3的反应化学方程式为______ 。
(4)为得到纯净的MnO2,需将过滤后的MnO2合并后进行洗涤。设计检验MnO2是否洗涤干净的实验方案:______ 。
(5)NaClO3和MnO2在一定条件下都可以氧化浓盐酸制取Cl2,制取相同物质的量的Cl2消耗NaClO3与MnO2的物质的量之比为______ 。
II.探究酸性KMnO4和Na2C2O4的反应
(6)该小组同学做了如下实验:将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录现象如表:
①请将MnO 氧化C2O
氧化C2O 的离子方程式补充完整:
的离子方程式补充完整:_______ 。
______MnO +_______C2O
+_______C2O +_______=______Mn2++______CO2↑+_______
+_______=______Mn2++______CO2↑+_______
②请分析KMnO4溶液褪色时间变化的最可能原因_______ 。
I.从粗品(含有较多的MnO、MnCO3和Fe2O3)中获得MnO2,其工艺流程如图。

请回答下列问题:
(1)第①步操作中,加快酸溶速率的措施
(2)第②步操作中,NaClO3将Mn2+转化为MnO2,利用电解法也可实现这步转化,生成MnO2的电极反应式为
(3)第③步操作中,Cl2生成NaClO3的反应化学方程式为
(4)为得到纯净的MnO2,需将过滤后的MnO2合并后进行洗涤。设计检验MnO2是否洗涤干净的实验方案:
(5)NaClO3和MnO2在一定条件下都可以氧化浓盐酸制取Cl2,制取相同物质的量的Cl2消耗NaClO3与MnO2的物质的量之比为
II.探究酸性KMnO4和Na2C2O4的反应
(6)该小组同学做了如下实验:将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录现象如表:
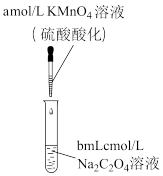 | 滴加KMnO4溶液的量 | KMnO4溶液紫色褪去所需的时间 |
| 滴入第1滴 | 60s | |
| 滴入第2滴 | 15s | |
| 滴入第3滴 | 3s | |
| 滴入第4滴 | 1s |
 氧化C2O
氧化C2O 的离子方程式补充完整:
的离子方程式补充完整:______MnO
 +_______C2O
+_______C2O +_______=______Mn2++______CO2↑+_______
+_______=______Mn2++______CO2↑+_______②请分析KMnO4溶液褪色时间变化的最可能原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】我国提出2060年前实现碳中和,降低大气中CO2含量是当今世界重要科研课题之一,以CO2为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。问答下列问题:
(1)CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH1=-156.9kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1
①已知2H2(g)+O2(g)=2H2O(g) ΔH3=-395.6kJ·mol-1,则CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=___________
②加氢合成甲烷时,通常控制温度为500℃左右,其原因为该温度下有较高的化学反应速率和___________
③500℃时,向1L恒容密闭容器中充入4molCO2和12molH2,初始压强为p,20min时主、副反应都达到平衡状态,测得c(H2O)=5mol·L-1,体系压强为 ,则0~20min内v(CH4)=
,则0~20min内v(CH4)=___________ mol·L-lmin-1,平衡时CH4选择性=___________ (CH4选择性=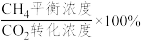 )。
)。
(2)我国科研人员将CO2和H2在Na-Fe3O4/HZSM-5催化下转变为汽油(C5~C11的烃),反应过程如下图所示。
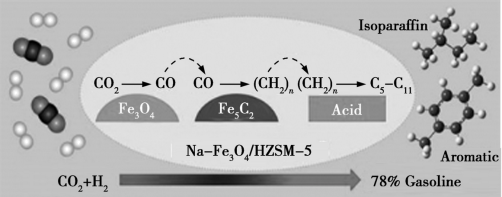
①若CO2在该条件下转化为戊烷(C5H12),则该反应的化学方程式为___________
②催化剂中的Fe3O4可用电解法制备。电解时以Fe做电极,电解质溶液为稀硫酸,其阳极反应式为___________
(3)甲醇催化制取乙烯的过程中发生如下反应:
反应1:3CH3OH⇌C3H6(g)+H2O(g);
反应2:2CH3OH(g)⇌C2H4(g)+2H2O(g)
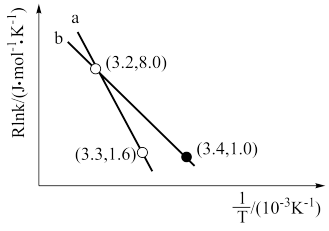
反应I的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式Rlnk= (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能(10K)Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能(10K)Ea=___________ kJ·mol-1。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是___________
(1)CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH1=-156.9kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1
①已知2H2(g)+O2(g)=2H2O(g) ΔH3=-395.6kJ·mol-1,则CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=
②加氢合成甲烷时,通常控制温度为500℃左右,其原因为该温度下有较高的化学反应速率和
③500℃时,向1L恒容密闭容器中充入4molCO2和12molH2,初始压强为p,20min时主、副反应都达到平衡状态,测得c(H2O)=5mol·L-1,体系压强为
 ,则0~20min内v(CH4)=
,则0~20min内v(CH4)=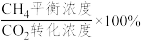 )。
)。(2)我国科研人员将CO2和H2在Na-Fe3O4/HZSM-5催化下转变为汽油(C5~C11的烃),反应过程如下图所示。

①若CO2在该条件下转化为戊烷(C5H12),则该反应的化学方程式为
②催化剂中的Fe3O4可用电解法制备。电解时以Fe做电极,电解质溶液为稀硫酸,其阳极反应式为
(3)甲醇催化制取乙烯的过程中发生如下反应:
反应1:3CH3OH⇌C3H6(g)+H2O(g);
反应2:2CH3OH(g)⇌C2H4(g)+2H2O(g)
反应I的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式Rlnk=
 (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能(10K)Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能(10K)Ea=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】以重晶石(BaSO4为主,含有钙等杂质)为原料,可按如下工艺生产碳酸钡:
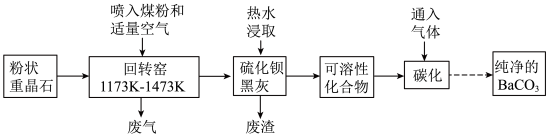
温度为1173K~1473K时回转窑中发生的主要反应:C+O2 CO2,C+CO2
CO2,C+CO2 2CO;BaSO4+4C
2CO;BaSO4+4C BaS+4CO↑,BaSO4+2C
BaS+4CO↑,BaSO4+2C BaS+2CO2↑。
BaS+2CO2↑。
(1)煤粉的主要作用是______________ 。
(2)若回转窑中通过量空气,则BaCO3产率________ (填“降低”、“升高”、“不变”)。
(3)用 90~95℃的热水浸取BaS转化为可溶性化合物时无气体生成,此过程反应的化学方程式__________________ 。
(4)在回转窑产生的废气,其中________ 可以在碳化过程得到重新利用;硫化钡黑灰热水浸取,保温后热过滤除去的残渣也可在其他工业生产中再利用,如废渣中的 CaSO4可作 ____________ (写一种即可)。
(5)为了得到纯净的BaCO3,省略的操作是_____________________ 。
(6)已知反应BaSO4(s)+CO32-(aq)⇌BaCO3(s)+SO42-(aq),某同学利用该反应在实验室模拟BaSO4转化为BaCO3的过程:若每次加入1 L 2 mol/L的Na2CO3溶液,至少需要____ 次,可以将0.3 mol BaSO4完全转化为BaCO3。[Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=5×10-9]

温度为1173K~1473K时回转窑中发生的主要反应:C+O2
 CO2,C+CO2
CO2,C+CO2 2CO;BaSO4+4C
2CO;BaSO4+4C BaS+4CO↑,BaSO4+2C
BaS+4CO↑,BaSO4+2C BaS+2CO2↑。
BaS+2CO2↑。(1)煤粉的主要作用是
(2)若回转窑中通过量空气,则BaCO3产率
(3)用 90~95℃的热水浸取BaS转化为可溶性化合物时无气体生成,此过程反应的化学方程式
(4)在回转窑产生的废气,其中
(5)为了得到纯净的BaCO3,省略的操作是
(6)已知反应BaSO4(s)+CO32-(aq)⇌BaCO3(s)+SO42-(aq),某同学利用该反应在实验室模拟BaSO4转化为BaCO3的过程:若每次加入1 L 2 mol/L的Na2CO3溶液,至少需要
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】纳米铁可用于制作高密度磁性材料。以铁屑(含少量 杂质)为原料制备纳米铁粉流程如下:
杂质)为原料制备纳米铁粉流程如下: 是一种二元酸
是一种二元酸
(1)“酸溶”过程中可以加快反应速率和提高浸出率的方法有_______ 。(写出两种)。
(2)写出“酸溶”时氧化还原反应的离子方程式:_______ 、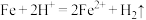 。
。
(3) 固体经灼烧后得到红棕色固体和
固体经灼烧后得到红棕色固体和 混合气体,若产物中
混合气体,若产物中 ,则“灼烧”过程中发生反应的化学方程式为
,则“灼烧”过程中发生反应的化学方程式为_______ 。
(4)取少量产品分散于水中,_______ (填操作步骤),可验证所得铁粉直径是否为纳米级
(5)纳米铁粉可用于处理含氧酸性废水中的 ,反应原理如图所示。
,反应原理如图所示。 的去除,原因是
的去除,原因是_______ 。
②该过程中体现了纳米铁粉的_______ 性(填“氧化”或“还原”)。
 杂质)为原料制备纳米铁粉流程如下:
杂质)为原料制备纳米铁粉流程如下:
 是一种二元酸
是一种二元酸(1)“酸溶”过程中可以加快反应速率和提高浸出率的方法有
(2)写出“酸溶”时氧化还原反应的离子方程式:
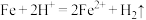 。
。(3)
 固体经灼烧后得到红棕色固体和
固体经灼烧后得到红棕色固体和 混合气体,若产物中
混合气体,若产物中 ,则“灼烧”过程中发生反应的化学方程式为
,则“灼烧”过程中发生反应的化学方程式为(4)取少量产品分散于水中,
(5)纳米铁粉可用于处理含氧酸性废水中的
 ,反应原理如图所示。
,反应原理如图所示。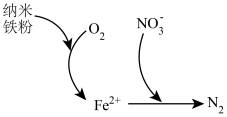
 的去除,原因是
的去除,原因是②该过程中体现了纳米铁粉的
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。填写下列空白:
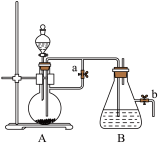
(1)B中盛有一定量的NaOH溶液,A中应预先加入的药品是__________ 。B中反应的离子方程式是______________________________________ 。
(2)实验开始时先将止水夹a_________ (填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程___________________________________________ 。
(4)实验完毕,打开b处止水夹,放入一部分空气,此时B瓶中发生的反应为______________ 。
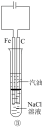
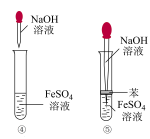
(5)知识拓展,下列各图示中能较长时间看到Fe(OH)2白色沉淀的是__________ (填序号)。


(1)B中盛有一定量的NaOH溶液,A中应预先加入的药品是
(2)实验开始时先将止水夹a
(3)简述生成Fe(OH)2的操作过程
(4)实验完毕,打开b处止水夹,放入一部分空气,此时B瓶中发生的反应为
(5)知识拓展,下列各图示中能较长时间看到Fe(OH)2白色沉淀的是



您最近一年使用:0次



