常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH⇌CH3COO-+H+,温度不变时,对于该电离平衡下列叙述正确的是
| A.加入少量NaOH固体,平衡向右移动,c(H+)减小 |
| B.加少量CH3COONa固体于醋酸溶液中,故醋酸的电离平衡向右移动 |
| C.加入水时,平衡向右移动,CH3COOH电离常数增大 |
| D.加入少量pH=5的硫酸,溶液中c(H+)增大 |
20-21高三上·海南省直辖县级单位·阶段练习 查看更多[4]
海南省北京师范大学万宁附属中学2021届高三上学期第一次月考化学试题(已下线)第23讲 弱电解质的电离平衡(精讲)-2022年一轮复习讲练测(已下线)专题24 弱电解质的电离(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练吉林省长春北师大附属学校2021-2022学年高二上学期期中考试化学试题
更新时间:2021-01-04 09:32:06
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】将 0.1mol/LCH3COOH 溶液加水稀释或者加入少量 CH3COONa 晶体时,都会引起
| A.溶液的 pH 变大 |
| B.CH3COOH 的电离程度增大 |
| C.溶液的导电能力增强 |
| D.溶液中c(OH-)减小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】室温下,向10 mL pH=11的氨水中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中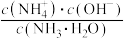 不变 不变 |
C.一水合氨的电离程度增大, 亦增大 亦增大 |
| D.将10 mL pH=11的氨水与10 mL pH=3的盐酸混合,所得溶液的pH=7 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】硼酸,化学式H3BO3,为白色结晶性粉末,大量用于玻璃工业,也可用作防腐、消毒剂。硼酸在水中存在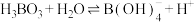 的平衡。下列关于硼酸说法正确的是
的平衡。下列关于硼酸说法正确的是
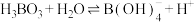 的平衡。下列关于硼酸说法正确的是
的平衡。下列关于硼酸说法正确的是| A.H3BO3是一元弱酸 |
| B.升高温度,该平衡逆向移动 |
| C.滴加少量浓盐酸,该平衡正向移动 |
D.H3BO3和足量的NaOH溶液反应: |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】醋酸溶液中存在电离平衡 CH3COOH CH3COO- + H+,下列叙述不正确的是
CH3COO- + H+,下列叙述不正确的是
 CH3COO- + H+,下列叙述不正确的是
CH3COO- + H+,下列叙述不正确的是| A.升高温度,平衡正向移动,醋酸的电离常数Ka增大 |
| B.CH3COOH溶液加少量的CH3COONa固体,平衡逆向移动 |
| C.室温下,欲使0.1 mol/L醋酸溶液的电离度α增大,可加入少量冰醋酸 |
| D.0.10 mol/L的CH3COOH 溶液加水稀释,溶液中c(CH3COOH)/c(CH3COO-)减小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+ H+,对于该平衡,下列叙述正确的是( )
CH3COO-+ H+,对于该平衡,下列叙述正确的是( )
 CH3COO-+ H+,对于该平衡,下列叙述正确的是( )
CH3COO-+ H+,对于该平衡,下列叙述正确的是( )| A.降温可以促进醋酸电离,会使氢离子浓度增大 |
| B.加入少量0.1 mol·L-1HCl溶液,溶液中c(H+)不变 |
| C.加入少量NaOH固体,平衡向正反应方向移动 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】在醋酸的电离平衡CH3COOH CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是
CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是
 CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是
CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是| A.加入NaOH(s) |
| B.通入HCl气体 |
| C.加蒸馏水 |
| D.升高温度 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐3】室温下,下列关于 的
的 溶液的叙述不正确的是
溶液的叙述不正确的是
 的
的 溶液的叙述不正确的是
溶液的叙述不正确的是A.溶液中 电离出的 电离出的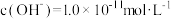 |
B.加入少量 固体后,溶液 固体后,溶液 升高 升高 |
C.加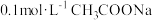 溶液使 溶液使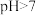 ,则 ,则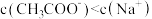 |
D.与等体积 的 的 溶液混合,所得溶液呈中性 溶液混合,所得溶液呈中性 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】在 溶液中存在电离平衡:
溶液中存在电离平衡: ,要使溶液中
,要使溶液中 浓度增大,且电离平衡逆向移动,可采取的措施是( )
浓度增大,且电离平衡逆向移动,可采取的措施是( )
 溶液中存在电离平衡:
溶液中存在电离平衡: ,要使溶液中
,要使溶液中 浓度增大,且电离平衡逆向移动,可采取的措施是( )
浓度增大,且电离平衡逆向移动,可采取的措施是( )| A.加水 | B.加热 | C.加 固体 固体 | D.加 固体 固体 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列方法中,不能使醋酸溶液中 CH3COOH⇌CH3COO- +H+ 电离程度增大的是
| A.升高温度 | B.加水稀释 |
| C.加入少量醋酸钠固体 | D.加入少量氢氧化钠固体 |
您最近一年使用:0次



