处理含硫烟气(主要成分为SO2)备受关注,主要有以下两种方法,请回答下列问题:
Ⅰ.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应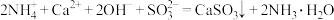 。
。
(1)已知:25℃时,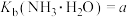 ;
;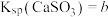 。该温度下,步骤2中反应的平衡常数K=
。该温度下,步骤2中反应的平衡常数K=___________ (用含a、b的代数式表示)。
Ⅱ.水煤气还原法
已知:ⅰ.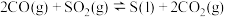
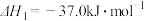
ⅱ.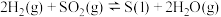
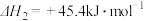
(2)写出 与
与 反应生成
反应生成 、
、 的热化学方程式为
的热化学方程式为___________ 。
Ⅲ.(3)将组成(物质的量分数)为m% SO2(g)、2m% H2(g)、和q%He(g)的气体通入密闭反应器,使反应:H2(g)+ SO2(g)
SO2(g)
 S(s)+H2O(g),在温度t、压强p条件下进行反应,平衡时,若H2转化率为a,则平衡常数Kp=
S(s)+H2O(g),在温度t、压强p条件下进行反应,平衡时,若H2转化率为a,则平衡常数Kp=___________ (以分压表示,分压=总压×物质的量分数)。
Ⅳ.常温下将NaOH溶液滴加到一定浓度的H2SO3溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
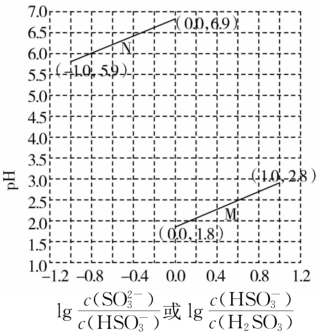
(4)Ka1(H2SO3)=___________ 。
(5)当滴加NaOH溶液使混合溶液呈中性时,溶液中各离子浓度大小关系为:___________ 。
Ⅰ.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应
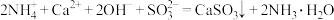 。
。(1)已知:25℃时,
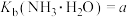 ;
;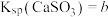 。该温度下,步骤2中反应的平衡常数K=
。该温度下,步骤2中反应的平衡常数K=Ⅱ.水煤气还原法
已知:ⅰ.
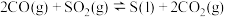
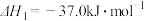
ⅱ.
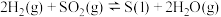
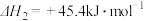
(2)写出
 与
与 反应生成
反应生成 、
、 的热化学方程式为
的热化学方程式为Ⅲ.(3)将组成(物质的量分数)为m% SO2(g)、2m% H2(g)、和q%He(g)的气体通入密闭反应器,使反应:H2(g)+
 SO2(g)
SO2(g)
 S(s)+H2O(g),在温度t、压强p条件下进行反应,平衡时,若H2转化率为a,则平衡常数Kp=
S(s)+H2O(g),在温度t、压强p条件下进行反应,平衡时,若H2转化率为a,则平衡常数Kp=Ⅳ.常温下将NaOH溶液滴加到一定浓度的H2SO3溶液中,混合溶液的pH与离子浓度变化的关系如图所示。

(4)Ka1(H2SO3)=
(5)当滴加NaOH溶液使混合溶液呈中性时,溶液中各离子浓度大小关系为:
更新时间:2021-01-05 00:59:00
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】“绿水青山就是金山银山”,因此研究 、
、 等大气污染物的妥善处理具有重要意义。
等大气污染物的妥善处理具有重要意义。
(1) 的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的
的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的 。已知吸收过程中相关反应的热化学方程式如下:
。已知吸收过程中相关反应的热化学方程式如下:
①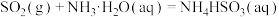
 ;
;
②
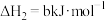 ;
;
③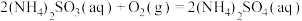
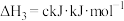 。
。
则反应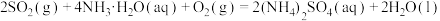 的
的
_____ 
(2)燃煤发电厂常利用反应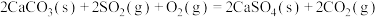
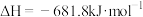 对煤进行脱硫处理来减少
对煤进行脱硫处理来减少 的排放。对于该反应,在
的排放。对于该反应,在 时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时,借助传感器测得反应在不同时间点上各物质的浓度如下:
① 内,平均反应速率
内,平均反应速率
________  ;当升高温度,该反应的平衡常数K
;当升高温度,该反应的平衡常数K________  填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。
② 后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是
后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________  填字母
填字母 。
。
A.加入一定量的粉状碳酸钙
B.通入一定量的
C.适当缩小容器的体积
D.加入合适的催化剂
(3) 的排放主要来自于汽车尾气,有人利用反应
的排放主要来自于汽车尾气,有人利用反应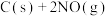

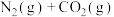
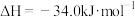 ,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
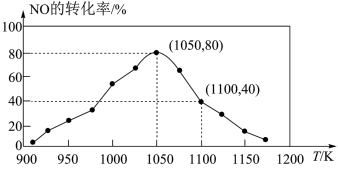
由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________ ;在1100K时, 的体积分数为
的体积分数为________ 。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数 记作
记作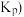 。在1050K、
。在1050K、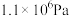 时,该反应的化学平衡常数
时,该反应的化学平衡常数
________  已知:气体分压
已知:气体分压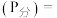 气体总压
气体总压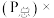 体积分数
体积分数 。
。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应

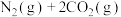
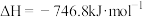 ,生成无毒的
,生成无毒的 和
和 。实验测得,
。实验测得,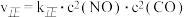 ,
,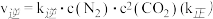 、
、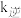 为速率常数,只与温度有关
为速率常数,只与温度有关 。
。
①达到平衡后,仅升高温度,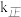 增大的倍数
增大的倍数________  填“
填“ ”“
”“ ”或“
”或“ ”
” 增大的倍数。
增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为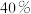 ,则
,则
__________ 。
 、
、 等大气污染物的妥善处理具有重要意义。
等大气污染物的妥善处理具有重要意义。(1)
 的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的
的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的 。已知吸收过程中相关反应的热化学方程式如下:
。已知吸收过程中相关反应的热化学方程式如下:①
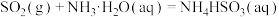
 ;
;②

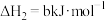 ;
;③
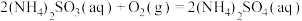
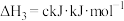 。
。则反应
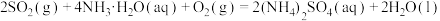 的
的

(2)燃煤发电厂常利用反应
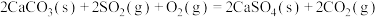
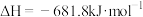 对煤进行脱硫处理来减少
对煤进行脱硫处理来减少 的排放。对于该反应,在
的排放。对于该反应,在 时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时,借助传感器测得反应在不同时间点上各物质的浓度如下:| 0 | 10 | 20 | 30 | 40 | 50 | |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①
 内,平均反应速率
内,平均反应速率
 ;当升高温度,该反应的平衡常数K
;当升高温度,该反应的平衡常数K 填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。②
 后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是
后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是 填字母
填字母 。
。A.加入一定量的粉状碳酸钙
B.通入一定量的

C.适当缩小容器的体积
D.加入合适的催化剂
(3)
 的排放主要来自于汽车尾气,有人利用反应
的排放主要来自于汽车尾气,有人利用反应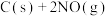

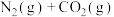
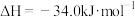 ,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为
 的体积分数为
的体积分数为(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数
 记作
记作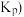 。在1050K、
。在1050K、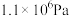 时,该反应的化学平衡常数
时,该反应的化学平衡常数
 已知:气体分压
已知:气体分压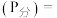 气体总压
气体总压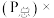 体积分数
体积分数 。
。(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应


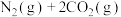
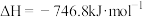 ,生成无毒的
,生成无毒的 和
和 。实验测得,
。实验测得,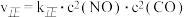 ,
,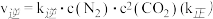 、
、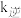 为速率常数,只与温度有关
为速率常数,只与温度有关 。
。①达到平衡后,仅升高温度,
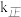 增大的倍数
增大的倍数 填“
填“ ”“
”“ ”或“
”或“ ”
” 增大的倍数。
增大的倍数。②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为
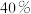 ,则
,则
您最近一年使用:0次
【推荐2】除去废水中Cr(Ⅵ)的方法有多种。请按要求回答下列问题。
(1)室温下,含Cr(Ⅵ)的微粒在水溶液中存在如下平衡:
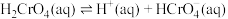

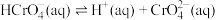

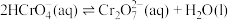

①室温下,反应
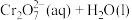 的
的
________ (用含 、
、 或
或 的代数式表示)。
的代数式表示)。
②基态 核外电子排布式为
核外电子排布式为________ 。
③室温下,初始浓度为 的
的 溶液中
溶液中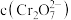 随
随 的变化如图所示。
的变化如图所示。
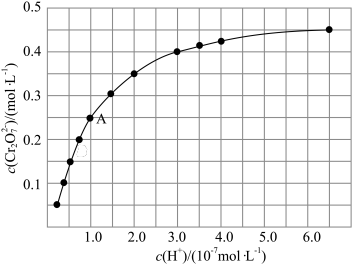
根据A点数据计算反应
 的
的
_________ ,下列关于该反应的说法不正确的是_________ 。
A.加水稀释,平衡右移,K值增大
B.若达到A点的时间为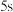 ,则
,则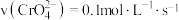
C.若升高温度,溶液中 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(2) 与熟石灰除Cr(VI)法:向酸性废水中加入
与熟石灰除Cr(VI)法:向酸性废水中加入 ,再加入熟石灰,使
,再加入熟石灰,使 沉淀。
沉淀。
①实验中的 作用是
作用是________ 。
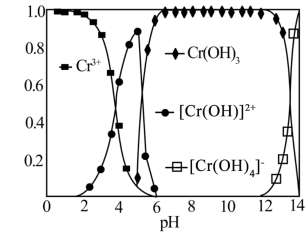
②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当 时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为_________ 。
(3)微生物法:
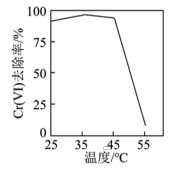
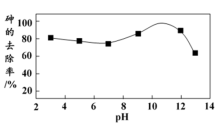
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(Ⅵ)去除率随温度的变化如图所示。 时,Cr(Ⅵ)的去除率很低的原因是
时,Cr(Ⅵ)的去除率很低的原因是____________ 。
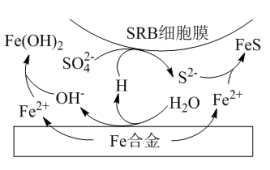
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为 ,
, 得到电子转化为H,
得到电子转化为H,________ 。
(4)可用电解法将废水中铬酸钾溶液制成重铬酸钾,其工作原理如图所示:
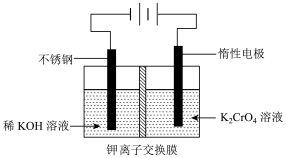
①该制备过程总反应的化学方程式为____________ 。
②电解一段时间后,阳极区溶液中 的物质的量由
的物质的量由
 变成
变成
 ,则生成的重铬酸钾的物质的量为
,则生成的重铬酸钾的物质的量为___________  。
。
(1)室温下,含Cr(Ⅵ)的微粒在水溶液中存在如下平衡:
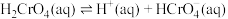

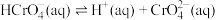

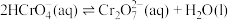

①室温下,反应

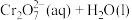 的
的
 、
、 或
或 的代数式表示)。
的代数式表示)。②基态
 核外电子排布式为
核外电子排布式为③室温下,初始浓度为
 的
的 溶液中
溶液中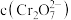 随
随 的变化如图所示。
的变化如图所示。
根据A点数据计算反应

 的
的
A.加水稀释,平衡右移,K值增大
B.若达到A点的时间为
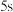 ,则
,则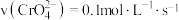
C.若升高温度,溶液中
 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(2)
 与熟石灰除Cr(VI)法:向酸性废水中加入
与熟石灰除Cr(VI)法:向酸性废水中加入 ,再加入熟石灰,使
,再加入熟石灰,使 沉淀。
沉淀。①实验中的
 作用是
作用是②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当
 时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
(3)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(Ⅵ)去除率随温度的变化如图所示。
 时,Cr(Ⅵ)的去除率很低的原因是
时,Cr(Ⅵ)的去除率很低的原因是
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为
 ,
, 得到电子转化为H,
得到电子转化为H,
(4)可用电解法将废水中铬酸钾溶液制成重铬酸钾,其工作原理如图所示:

①该制备过程总反应的化学方程式为
②电解一段时间后,阳极区溶液中
 的物质的量由
的物质的量由
 变成
变成
 ,则生成的重铬酸钾的物质的量为
,则生成的重铬酸钾的物质的量为 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】CO2是一种重要的化工原料,依据题给信息,回答下列问题:
Ⅰ.碳酸钠可利用CO2采用氨碱法生产
(1)碳酸钠可作为碱使用的原因是_____________ (用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ/mol
②NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=___________ kJ/mol。
Ⅱ.在体积为2 L的密闭容器中,充入1mol/LCO2和1mol/L H2,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应为____________ 反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是_______________ 。
a.容器中压强不变 b.混合气体中 c(CO)不变
c. υ正(H2)=υ逆(H2O) d. c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________ ℃。
(4)某温度下经2min反应达到平衡后c(CO)=0.8mol/L,此温度下的平衡常数为________ 。
Ⅰ.碳酸钠可利用CO2采用氨碱法生产
(1)碳酸钠可作为碱使用的原因是
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ/mol
②NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=
Ⅱ.在体积为2 L的密闭容器中,充入1mol/LCO2和1mol/L H2,进行如下化学反应:
CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 | |||
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为
(2)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c. υ正(H2)=υ逆(H2O) d. c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
(4)某温度下经2min反应达到平衡后c(CO)=0.8mol/L,此温度下的平衡常数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】用中和滴定法测定某烧碱样品的纯度,请回答下列问题:
(1)准确称量5.0 g含有少量易溶杂质的样品(杂质不与盐酸反应),配成250 mL待测溶液,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、___________________ 。
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,量取待测液10.00 mL应选用_________ 仪器(填字母)。
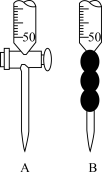
(3)滴定过程中,眼睛应注视___________________________________ ,以甲基橙做指示剂,正确判断滴定终点的现象是________________________________ 。
(4)由下表可知,第2次所用盐酸体积明显偏大,其可能的原因是_________ 。
a.锥形瓶用待测液润洗
b.滴定过程中锥形瓶中溶液溅出瓶外
c.滴定前滴定管尖嘴有气泡,滴定结束气泡消失
d.滴定结束时,俯视读数
(5)根据表中数据,计算被测烧碱溶液的物质的量浓度是_________ ,烧碱样品的纯度是_________ 。
(1)准确称量5.0 g含有少量易溶杂质的样品(杂质不与盐酸反应),配成250 mL待测溶液,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,量取待测液10.00 mL应选用

(3)滴定过程中,眼睛应注视
(4)由下表可知,第2次所用盐酸体积明显偏大,其可能的原因是
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 2.10 | 24.20 |
| 第三次 | 10.00 | 4.10 | 24.00 |
b.滴定过程中锥形瓶中溶液溅出瓶外
c.滴定前滴定管尖嘴有气泡,滴定结束气泡消失
d.滴定结束时,俯视读数
(5)根据表中数据,计算被测烧碱溶液的物质的量浓度是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
(1)工业上的湿法制备方法是用KClO与Fe(OH)3在KOH存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为________________ 。
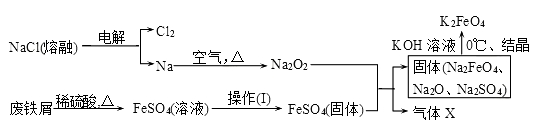
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
①操作(Ⅰ)的方法为_________________ ,隔绝空气减压干燥。
②检验产生X气体的方法是________________ 。
③最终在溶液中得到K2FeO4晶体利用的原理是____________________ 。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液,
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)2溶液的体积,做3次平行实验,平均消耗(NH4)2Fe(SO4)2溶液的体积30.00 mL。
已知:滴定时发生的反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mL K2FeO4溶液加入到锥形瓶中所用的仪器是______________ 。
②写出步骤3中发生反应的离子方程式__________________________ 。
③步骤5中能否不加指示剂_________ ,原因是________________ 。
④根据上述实验数据,测定该样品中K2FeO4的质量分数为__________ 。
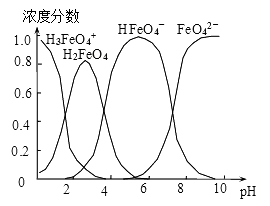
(4)配制0.1mol·L-1的K2FeO4,调节溶液pH,含铁离子在水溶液中的存在形态如图所示。下列说法正确的是__________ (填字母)。
A.pH=2时,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1
B.向pH=10的这种溶液中加硫酸铵,则HFeO4-的分布分数逐渐增大
C.向pH=1的溶液中加HI溶液,发生反应的离子方程式为:H2FeO4+H+=H3FeO4+
D.将K2FeO4晶体溶于水,水溶液呈弱碱性

(1)工业上的湿法制备方法是用KClO与Fe(OH)3在KOH存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
①操作(Ⅰ)的方法为
②检验产生X气体的方法是
③最终在溶液中得到K2FeO4晶体利用的原理是
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液,
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)2溶液的体积,做3次平行实验,平均消耗(NH4)2Fe(SO4)2溶液的体积30.00 mL。
已知:滴定时发生的反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mL K2FeO4溶液加入到锥形瓶中所用的仪器是
②写出步骤3中发生反应的离子方程式
③步骤5中能否不加指示剂
④根据上述实验数据,测定该样品中K2FeO4的质量分数为
(4)配制0.1mol·L-1的K2FeO4,调节溶液pH,含铁离子在水溶液中的存在形态如图所示。下列说法正确的是
A.pH=2时,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1
B.向pH=10的这种溶液中加硫酸铵,则HFeO4-的分布分数逐渐增大
C.向pH=1的溶液中加HI溶液,发生反应的离子方程式为:H2FeO4+H+=H3FeO4+
D.将K2FeO4晶体溶于水,水溶液呈弱碱性
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】用浓盐酸和MnO2制取Cl2的装置如下,某小组欲证明产生的气体中含有HCl。
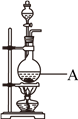
(1)Cl2的电子式是__________ ,A中反应的离子方程式为____________________ 。
(2)甲同学将A中产生的气体通入下列溶液:
①实验a中的现象为__________ 。
②不能证明产生的气体中含有HCl的实验是__________ (填字母序号)
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但实验不能证明气体中含有HCl,结合化学用语解释其原因:_______________________________________________________________________________
(4)已知:2S2O32-+I2=S4O62-+2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
实验I.测定X中溶解的Cl2。取25.00mL溶液X,加入过量KI溶液,然后用0.04mol·L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液VmL。
实验II.测定X中Cl元素重量。另取25.00mL溶液X,选用适当的还原将溶解的Cl2全部还原为Cl-,再用0.10mol·L-1AgNO3溶液滴定说的溶液中的CI-。
①X中的HClO不会影响实验I的测定结果,原因是__________ 。
②由I、II中实验数据可证明A中产生的气体中含有HCl,则II中0.10mol·L-1AgNO3溶液的体积应大于__________ mL(用含V的代数式表示)。

(1)Cl2的电子式是
(2)甲同学将A中产生的气体通入下列溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | |
| b | AgNO3 | 出现白色沉淀 |
②不能证明产生的气体中含有HCl的实验是
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但实验不能证明气体中含有HCl,结合化学用语解释其原因:
(4)已知:2S2O32-+I2=S4O62-+2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
实验I.测定X中溶解的Cl2。取25.00mL溶液X,加入过量KI溶液,然后用0.04mol·L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液VmL。
实验II.测定X中Cl元素重量。另取25.00mL溶液X,选用适当的还原将溶解的Cl2全部还原为Cl-,再用0.10mol·L-1AgNO3溶液滴定说的溶液中的CI-。
①X中的HClO不会影响实验I的测定结果,原因是
②由I、II中实验数据可证明A中产生的气体中含有HCl,则II中0.10mol·L-1AgNO3溶液的体积应大于
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】实验室采用三氟化硼( )与氯化铝(
)与氯化铝( )高温加热的方法制备
)高温加热的方法制备 ,装置如图所示(夹持装置及加热装置略)。
,装置如图所示(夹持装置及加热装置略)。

已知:Ⅰ.三氟化硼( )易与水反应:三氯化硼(
)易与水反应:三氯化硼( )易水解;三氯化铝(
)易水解;三氯化铝( )沸点低、易升华。
)沸点低、易升华。
Ⅱ.F装置中的溶液为 溶液。
溶液。
Ⅲ.部分物质的沸点如表所示:
回答下列问题:
(1)将氟硼酸钾(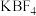 )和硼酐(
)和硼酐( )一起研磨均匀加入A中的圆底烧瓶。滴入浓硫酸并加热,产生
)一起研磨均匀加入A中的圆底烧瓶。滴入浓硫酸并加热,产生 气体,
气体, 和
和 的B原子杂化方式分别是
的B原子杂化方式分别是_______ 、_______ 。
(2)仪器E的名称是_______ ;实验开始时,A、C两处加热装置应先加热A处,原因是_______
(3)装置B中浓硫酸的作用除干燥外,还有_______
(4)装置C中仪器是将规格为1L的圆底烧瓶与500mL的蒸馏烧瓶的底部熔接在一起,再将玻璃管插到圆底烧瓶的底部,这样做的目的为_______
(5)装置D进行_______ (填“冰水浴”或“热水浴”)可得到产品,如果缺少装置E,造成的影响为_______ 。
(6)C中2.67g无水氯化铝完全反应后,取下U形管并注入水, 完全反应生成两种一元酸,反应的化学方程式为
完全反应生成两种一元酸,反应的化学方程式为_______ ,将所得溶液加水稀释到1000mL,取20mL加入锥形瓶中,滴入2滴酚酞溶液,用0.1mol/L的NaOH溶液滴定,重复实验2~3次,消耗NaOH的平均体积为12.50mL,则 的产率为
的产率为_______ %(保留2位小数),若达滴定终点后俯视读数则测得产率_______ (填“偏高”、“偏低”或“无影响”)
 )与氯化铝(
)与氯化铝( )高温加热的方法制备
)高温加热的方法制备 ,装置如图所示(夹持装置及加热装置略)。
,装置如图所示(夹持装置及加热装置略)。
已知:Ⅰ.三氟化硼(
 )易与水反应:三氯化硼(
)易与水反应:三氯化硼( )易水解;三氯化铝(
)易水解;三氯化铝( )沸点低、易升华。
)沸点低、易升华。Ⅱ.F装置中的溶液为
 溶液。
溶液。Ⅲ.部分物质的沸点如表所示:
| 物质 |  |  |  |  |
| 沸点/℃ | -101 | 12.5 | 180 | 1290 |
(1)将氟硼酸钾(
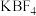 )和硼酐(
)和硼酐( )一起研磨均匀加入A中的圆底烧瓶。滴入浓硫酸并加热,产生
)一起研磨均匀加入A中的圆底烧瓶。滴入浓硫酸并加热,产生 气体,
气体, 和
和 的B原子杂化方式分别是
的B原子杂化方式分别是(2)仪器E的名称是
(3)装置B中浓硫酸的作用除干燥外,还有
(4)装置C中仪器是将规格为1L的圆底烧瓶与500mL的蒸馏烧瓶的底部熔接在一起,再将玻璃管插到圆底烧瓶的底部,这样做的目的为
(5)装置D进行
(6)C中2.67g无水氯化铝完全反应后,取下U形管并注入水,
 完全反应生成两种一元酸,反应的化学方程式为
完全反应生成两种一元酸,反应的化学方程式为 的产率为
的产率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】废水中的砷主要以无机砷(三价砷和五价砷)存在,常用的除砷方法有化学沉淀法、絮凝沉淀法等。
(1)铁盐絮凝沉淀法。H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图所示
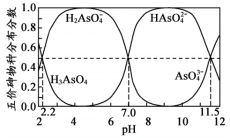
①当废水的pH=5时,往废水中加入硫酸铁可得到FeAsO4沉淀,反应的离子方程式为_______ 。
②Na2HAsO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是_______ (用离子方程式表示)。
③已知:Fe(OH)3胶体可以吸附废水中的五价砷物种而沉降,溶液的pH对Fe(OH)3胶体表面所带负电荷有影响。聚合硫酸铁{[Fe2(OH)6-2n](SO4)n}m是一种高效净水剂,溶于水能部分解离出Fe3+,随着溶液pH增大,[Fe2(OH)6-2n]2n+中n值逐渐减小,直至形成[Fe(OH)6]3-。向含五价砷的废水中加入聚合硫酸铁,含砷微粒的浓度与溶液pH的关系如图所示。pH>9时,废水中含砷的去除率迅速下降的原因是_______ 。
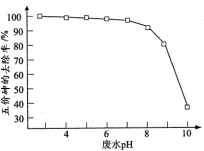
(2)石灰沉淀法。向含有一定浓度的Na3AsO4中加入Ca(OH)2溶液,在相同的n(Ca)/n(As)为6的条件下,调节溶液的pH,测得溶液中砷的去除率与pH的关系如图所示。已知:常温下Ksp[Ca3(AsO4)2]=1×10-21,Ksp[Ca(OH)2]= 6.0×10-6,Ksp(CaCO3)= 8.7×10-9,c(AsO )约为1.0×10-5时沉淀完全。
)约为1.0×10-5时沉淀完全。
①pH>12后,砷的去除率随pH的增大而下降,其原因是_______ 。
②保持相同的n(Ca)/n(As)为6,调节溶液的pH为12,控制不同的温度,将饱和的Ca(OH)2溶液与砷酸钠溶液混合反应,测得砷酸钠溶液中砷的去除率随温度升高而逐渐下降,可能的原因是_______ 。
(1)铁盐絮凝沉淀法。H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图所示

①当废水的pH=5时,往废水中加入硫酸铁可得到FeAsO4沉淀,反应的离子方程式为
②Na2HAsO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是
③已知:Fe(OH)3胶体可以吸附废水中的五价砷物种而沉降,溶液的pH对Fe(OH)3胶体表面所带负电荷有影响。聚合硫酸铁{[Fe2(OH)6-2n](SO4)n}m是一种高效净水剂,溶于水能部分解离出Fe3+,随着溶液pH增大,[Fe2(OH)6-2n]2n+中n值逐渐减小,直至形成[Fe(OH)6]3-。向含五价砷的废水中加入聚合硫酸铁,含砷微粒的浓度与溶液pH的关系如图所示。pH>9时,废水中含砷的去除率迅速下降的原因是

(2)石灰沉淀法。向含有一定浓度的Na3AsO4中加入Ca(OH)2溶液,在相同的n(Ca)/n(As)为6的条件下,调节溶液的pH,测得溶液中砷的去除率与pH的关系如图所示。已知:常温下Ksp[Ca3(AsO4)2]=1×10-21,Ksp[Ca(OH)2]= 6.0×10-6,Ksp(CaCO3)= 8.7×10-9,c(AsO
 )约为1.0×10-5时沉淀完全。
)约为1.0×10-5时沉淀完全。
①pH>12后,砷的去除率随pH的增大而下降,其原因是
②保持相同的n(Ca)/n(As)为6,调节溶液的pH为12,控制不同的温度,将饱和的Ca(OH)2溶液与砷酸钠溶液混合反应,测得砷酸钠溶液中砷的去除率随温度升高而逐渐下降,可能的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】某化学兴趣小组用金属工业废料(主要含铝、铁、铜,不考虑其他杂质)制取氯化铝、绿矾晶体和CuSO4溶液,设计了如下流程:

(1)X溶液为___________ 溶液,操作Ⅱ需要用___________ 作保护气。
(2)操作Ⅰ为通入足量CO2过滤后再加入足量稀盐酸,请写出通入足量CO2时的离子反应方程式:___________ 。
(3)在已控制好防止氧化的条件下,操作Ⅲ的具体步骤为:___________ 。
(4)写出通过途径②制取溶液D的离子反应方程式:___________ 。
(5)对比途径①和途径②,指出途径②的不足之处:___________ 。

(1)X溶液为
(2)操作Ⅰ为通入足量CO2过滤后再加入足量稀盐酸,请写出通入足量CO2时的离子反应方程式:
(3)在已控制好防止氧化的条件下,操作Ⅲ的具体步骤为:
(4)写出通过途径②制取溶液D的离子反应方程式:
(5)对比途径①和途径②,指出途径②的不足之处:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】氧化铬(Cr2O3)主要用于冶炼金属铬、有机化学合成的催化剂等。工业上是以铬铁矿[主要成份为Fe(CrO2)2,还含有Al2O3、SiO2等杂质]为主要原料进行生产,其主要工艺流程如下:
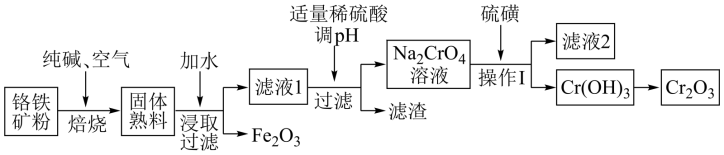
(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________ 。
(2)焙烧时的主要反应为:4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2,其中被氧化的元素为
8Na2CrO4+2Fe2O3+8CO2,其中被氧化的元素为______ ,每产生32 g Fe2O3,转移电子的数目为_______ 。该步骤不能使用陶瓷容器,原因是_____________________________ 。
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:___________ 。
(4)硫磺在与铬酸钠的反应中转化为硫代硫酸钠,反应的离子方程式为__________ 。滤渣中除Al(OH)3外还有__________ (填化学式)。
(5)某工厂用448 kg铬铁矿粉[含Fe(CrO2)280%]制备Cr2O3,最终得到产品182.4 kg,产率为______ %。
(6)Cr3+也有一定毒性,会污染水体,常温下要除去废液中多余的Cr3+,调节pH至少为_______ ,才能使铬离子沉淀完全。已知Cr(OH)3的溶度积常数为1.0×10-32。

(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是
(2)焙烧时的主要反应为:4FeO·Cr2O3+8Na2CO3+7O2
 8Na2CrO4+2Fe2O3+8CO2,其中被氧化的元素为
8Na2CrO4+2Fe2O3+8CO2,其中被氧化的元素为(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:
(4)硫磺在与铬酸钠的反应中转化为硫代硫酸钠,反应的离子方程式为
(5)某工厂用448 kg铬铁矿粉[含Fe(CrO2)280%]制备Cr2O3,最终得到产品182.4 kg,产率为
(6)Cr3+也有一定毒性,会污染水体,常温下要除去废液中多余的Cr3+,调节pH至少为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】钪的特殊性质,使其在电子工业、航天、核技术、激光技术、冶金、化工、医学、农业等各方面得到广泛应用。一种利用高温沸腾氯化烟尘(主要成分为AlCl3、FeCl3、TiCl4、ScCl3等,还含有其他难溶于酸的物质)回收Sc的工艺流程如图。

已知:钪(原子序数为21)与铝类似,其氢氧化物具有两性;钪离子可以在不同pH下生成[Sc(OH)n]3-n(n=1~6)。
请回答以下问题:
(1)某次实验中需要使用480mL3mol·L-1的盐酸,用浓盐酸(密度为1.2g·cm-3,质量分数为36.5%)配制实验所需要的盐酸,则需要量取浓盐酸的体积为_______ mL,需要使用的玻璃仪器除烧杯、量筒、玻璃棒外,还需要的是_______ 。
(2)钪的一种核素可用作示踪原子,用于对恶性肿瘤放射治疗,该种核素的中子数为25,则该核素的符号为_______ 。
(3)“反萃取”时,若加入的氢氧化钠溶液过量,则Sc(OH)3沉淀会溶解。写出Se(OH)3与过量NaOH溶液反应生成n=6的含钪产物的化学方程式:_______ 。
(4)加入草酸进行“沉淀转化”,将Sc(OH)3沉淀转化为Sc2(C2O4)3。25°C时pH=2的草酸溶液中 =
=_______ 。(25°C时,草酸的电离平衡常数为Ka1=5.0×10-2,Ka2=5.4×10-5)
(5)草酸钪在空气中“灼烧”可制得Sc2O3,写出反应的化学方程式:_______ 。
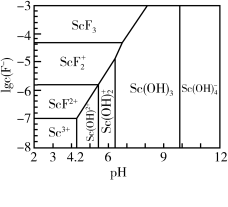
(6)常温下,三价Sc的部分存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。若溶液中c(F-)=1×10-5mol·L-1,“调pH”过程中控制pH=5,此时三价Sc的主要存在形式为_______ (填化学式)。

已知:钪(原子序数为21)与铝类似,其氢氧化物具有两性;钪离子可以在不同pH下生成[Sc(OH)n]3-n(n=1~6)。
请回答以下问题:
(1)某次实验中需要使用480mL3mol·L-1的盐酸,用浓盐酸(密度为1.2g·cm-3,质量分数为36.5%)配制实验所需要的盐酸,则需要量取浓盐酸的体积为
(2)钪的一种核素可用作示踪原子,用于对恶性肿瘤放射治疗,该种核素的中子数为25,则该核素的符号为
(3)“反萃取”时,若加入的氢氧化钠溶液过量,则Sc(OH)3沉淀会溶解。写出Se(OH)3与过量NaOH溶液反应生成n=6的含钪产物的化学方程式:
(4)加入草酸进行“沉淀转化”,将Sc(OH)3沉淀转化为Sc2(C2O4)3。25°C时pH=2的草酸溶液中
 =
=(5)草酸钪在空气中“灼烧”可制得Sc2O3,写出反应的化学方程式:
(6)常温下,三价Sc的部分存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。若溶液中c(F-)=1×10-5mol·L-1,“调pH”过程中控制pH=5,此时三价Sc的主要存在形式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取Na2CrO4晶体的工艺流程如下:
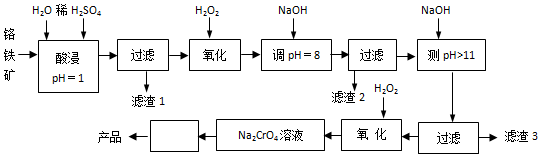
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO形式存在且易氧化;②常温下部分阳离子以氢氧化物形式沉淀时溶液pH如下:
(1)滤渣1主要成分是__________________ 。
(2)写出流程中第1次使用H2O2时,发生反应的离子方程式__________________ 。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?___________ 。
(4)写出第2次使用H2O2时,发生反应的离子方程式___________ 。
(5)流程图中从Na2CrO4溶液至产品中间“□”内的操作是__________ 、__________ 过滤、洗涤、干燥
(6)当溶液调pH=10时,则溶液中c(Mg2+) 为__________ 。【已知Ksp(Mg(OH)2)=5.6×10-12】
(7) 在酸性条件下转化为
在酸性条件下转化为 。工业上常用Fe2+处理酸性K2Cr2O7废水,先将
。工业上常用Fe2+处理酸性K2Cr2O7废水,先将 转化为Cr3+,该反应的离子方程式为
转化为Cr3+,该反应的离子方程式为_____________ ,再调节溶液的pH使金属离子生成沉淀而除去。

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO形式存在且易氧化;②常温下部分阳离子以氢氧化物形式沉淀时溶液pH如下:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | —— | —— |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
(1)滤渣1主要成分是
(2)写出流程中第1次使用H2O2时,发生反应的离子方程式
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?
(4)写出第2次使用H2O2时,发生反应的离子方程式
(5)流程图中从Na2CrO4溶液至产品中间“□”内的操作是
(6)当溶液调pH=10时,则溶液中c(Mg2+) 为
(7)
 在酸性条件下转化为
在酸性条件下转化为 。工业上常用Fe2+处理酸性K2Cr2O7废水,先将
。工业上常用Fe2+处理酸性K2Cr2O7废水,先将 转化为Cr3+,该反应的离子方程式为
转化为Cr3+,该反应的离子方程式为
您最近一年使用:0次



