现有含有Fe2+杂质的硫酸铜晶体(CuSO4·5H2O),为了制取纯净的 CuSO4·5H2O),首先将其制成水溶液,然后按图示步骤进行提纯:
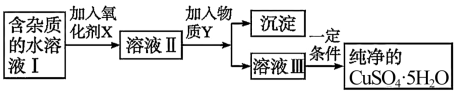
已知:各离子开始沉淀和完全沉淀时的pH如下表:
请回答下列问题:
(1)加入氧化剂的目的是______ ,最适合的氧化剂X是______ (填字母)。
A. KMnO4 B.氯水 C.H2O2 D.HNO3
(2)物质Y是(写一种即可)______ (填化学式)。
(3)本实验用加碱沉淀法能不能达到目的?______ ,原因是______ 。
(4)除去 Fe3+的有关离子方程式为______ 。
(5)请设计一种实验方案检验溶液中Fe3+是否被完全除去(写出操作步骤、现象和结论):______ 。
(6)除铁后得到的 Fe(OH)3可用KClO 溶液在碱性环境中将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式:______ 。

已知:各离子开始沉淀和完全沉淀时的pH如下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
 | 6.4 | 9.6 |
 | 1.5 | 3.2 |
 | 4.7 | 6.7 |
(1)加入氧化剂的目的是
A. KMnO4 B.氯水 C.H2O2 D.HNO3
(2)物质Y是(写一种即可)
(3)本实验用加碱沉淀法能不能达到目的?
(4)除去 Fe3+的有关离子方程式为
(5)请设计一种实验方案检验溶液中Fe3+是否被完全除去(写出操作步骤、现象和结论):
(6)除铁后得到的 Fe(OH)3可用KClO 溶液在碱性环境中将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式:
更新时间:2021-02-01 08:51:04
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】常温下,几种物质的溶度积常数见表:
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得净CuCl2溶液,宜加入___________ (填化学式),将溶液调至pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)___________ mol/L。
(2)上述溶液过滤后,将所得滤液经过___________ ,再经过滤,可得到CuCl2·2H2O晶体。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入适当过量的KI固体,充分反应,生成白色沉淀。用0.1000mol/LNa2S2O3标准溶液滴定,到滴定终点时,消耗Na2S2O3标准溶液40.00 mL(已知:I2+2S2O = S4O
= S4O +2I-)
+2I-)
①可选用淀粉作滴定指示剂,滴定终点的现象是___________ 。
②CuCl2溶液与KI反应的离子方程式为___________ 。
③含有 晶体的试样的纯度是
晶体的试样的纯度是___________ 。
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)上述溶液过滤后,将所得滤液经过
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入适当过量的KI固体,充分反应,生成白色沉淀。用0.1000mol/LNa2S2O3标准溶液滴定,到滴定终点时,消耗Na2S2O3标准溶液40.00 mL(已知:I2+2S2O
 = S4O
= S4O +2I-)
+2I-)①可选用淀粉作滴定指示剂,滴定终点的现象是
②CuCl2溶液与KI反应的离子方程式为
③含有
 晶体的试样的纯度是
晶体的试样的纯度是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】已知有原子序数依次增大的A、B、C、D、E五种短周期元素和过渡元素F,其相关信息如表所示:
(1)上述六种元素中,金属性最强的元素在周期表中的位置是_______ 。
(2)分子式为B5Al2且其一氯代物只有一种的有机物的名称为_______ 。
(3)C元素的气态氢化物与其最高价氧化物对应的水化物化合生成M,M的水溶液呈_______ 性;将M的浓溶液滴加到Mg(OH)2悬浊液中,描述现象并解释产生该现象的原因_______ 。
(4)D元素的最高价氧化物对应的水化物与E元素的单质反应的离子方程式为_______ 。
(5)F与B形成的合金在潮湿的空气中易发生电化学腐蚀形成红棕色固体,腐蚀过程中正极的电极反应式为_______ 。
1 | A与C形成化合物的水溶液呈碱性 |
2 | B的最高正价与最低负价的代数和为0 |
3 | D的常见化合物的焰色反应为黄色 |
4 | E是同周期中简单离子半径最小的元素 |
(2)分子式为B5Al2且其一氯代物只有一种的有机物的名称为
(3)C元素的气态氢化物与其最高价氧化物对应的水化物化合生成M,M的水溶液呈
(4)D元素的最高价氧化物对应的水化物与E元素的单质反应的离子方程式为
(5)F与B形成的合金在潮湿的空气中易发生电化学腐蚀形成红棕色固体,腐蚀过程中正极的电极反应式为
您最近一年使用:0次
【推荐3】国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
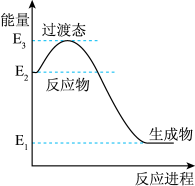
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式____________ (△H可用E1、E2、E3表示)。
(2)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓
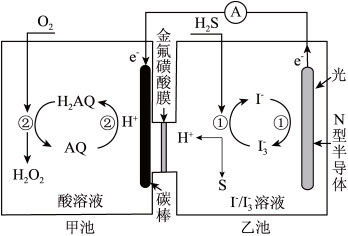
①装置中H+向________ 池迁移。
②乙池溶液中发生反应的离子方程式:____________
(3)2NO(g)+O2(g)⇌2NO2(g)的反应历程如下:
反应I:2NO(g)⇌N2O2(g)(快); <0 v1正=k1正 ▪c2(NO) 、v1逆=k1逆 ▪c(N2O2)
<0 v1正=k1正 ▪c2(NO) 、v1逆=k1逆 ▪c(N2O2)
反应Ⅱ:N2O2(g)+O2(g)⇌2NO2(g)(慢) 2<0 v2正=k2正 ▪c(N2O2)▪c(O2) v2逆=k2逆 ▪c2(NO2);
2<0 v2正=k2正 ▪c(N2O2)▪c(O2) v2逆=k2逆 ▪c2(NO2);
在一定条件下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,平衡常数=___________ (用含K1正、K1逆、K2正、K2逆的代数式表示)。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为____ 。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式

(2)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓

①装置中H+向
②乙池溶液中发生反应的离子方程式:
(3)2NO(g)+O2(g)⇌2NO2(g)的反应历程如下:
反应I:2NO(g)⇌N2O2(g)(快);
 <0 v1正=k1正 ▪c2(NO) 、v1逆=k1逆 ▪c(N2O2)
<0 v1正=k1正 ▪c2(NO) 、v1逆=k1逆 ▪c(N2O2) 反应Ⅱ:N2O2(g)+O2(g)⇌2NO2(g)(慢)
 2<0 v2正=k2正 ▪c(N2O2)▪c(O2) v2逆=k2逆 ▪c2(NO2);
2<0 v2正=k2正 ▪c(N2O2)▪c(O2) v2逆=k2逆 ▪c2(NO2);在一定条件下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,平衡常数=
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】草酸钴( )用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿(主要成分为
)用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿(主要成分为 ,含少量
,含少量 、
、 、
、 、
、 、
、 等)制取
等)制取 的工艺流程如图所示:
的工艺流程如图所示:

已知:①浸出液含有的阳离子主要有 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;
②酸性条件下, 不会氧化
不会氧化 ;
;
③部分金属离子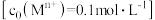 以氢氧化物形式沉淀时溶液的
以氢氧化物形式沉淀时溶液的 见下表:
见下表:
(1)浸出过程中加入 的目的是将
的目的是将___________ (填离子符号)还原。
(2) 的作用是将
的作用是将 氧化成
氧化成 ,相应的离子方程式为
,相应的离子方程式为___________ 。
(3)请用平衡移动原理分析加 能使浸出液中
能使浸出液中 、
、 转化成氢氧化物沉淀的原因:
转化成氢氧化物沉淀的原因:___________ 。
(4)萃取剂对金属离子的萃取率与 的关系如图所示。
的关系如图所示。
滤液Ⅱ中加入萃取剂的作用是___________ ;使用萃取剂适宜的 是
是___________ (填标号)。
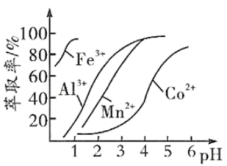
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中 与
与 转化为
转化为 、
、 沉淀。已知
沉淀。已知 、
、 .当加入过量
.当加入过量 后,所得滤液中
后,所得滤液中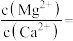
___________ 。
 )用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿(主要成分为
)用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿(主要成分为 ,含少量
,含少量 、
、 、
、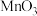 、
、 、
、 等)制取
等)制取 的工艺流程如图所示:
的工艺流程如图所示:
已知:①浸出液含有的阳离子主要有
 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;②酸性条件下,
 不会氧化
不会氧化 ;
;③部分金属离子
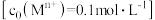 以氢氧化物形式沉淀时溶液的
以氢氧化物形式沉淀时溶液的 见下表:
见下表:| 沉淀物 |  |  |  |  |  |
完全沉淀的 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入
 的目的是将
的目的是将(2)
 的作用是将
的作用是将 氧化成
氧化成 ,相应的离子方程式为
,相应的离子方程式为(3)请用平衡移动原理分析加
 能使浸出液中
能使浸出液中 、
、 转化成氢氧化物沉淀的原因:
转化成氢氧化物沉淀的原因:(4)萃取剂对金属离子的萃取率与
 的关系如图所示。
的关系如图所示。滤液Ⅱ中加入萃取剂的作用是
 是
是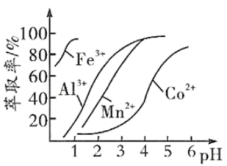
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中
 与
与 转化为
转化为 、
、 沉淀。已知
沉淀。已知 、
、 .当加入过量
.当加入过量 后,所得滤液中
后,所得滤液中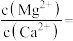
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以
可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以 形式存在,还含有
形式存在,还含有 、
、 、
、 、
、 等物质。以独居石为原料制备
等物质。以独居石为原料制备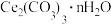 的工艺流程如下:
的工艺流程如下:
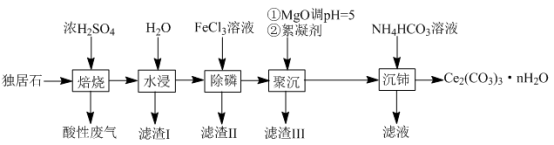
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为_______ ;
(2)为提高“水浸”效率,可采取的措施有_______ (至少写两条);
(3)滤渣Ⅲ的主要成分是_______ (填化学式);
(4)加入絮凝剂的目的是_______ ;
(5)“沉铈”过程中,生成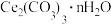 的离子方程式为
的离子方程式为_______ ,常温下加入的 溶液呈
溶液呈_______ (填“酸性”“碱性”或“中性”)(已知: 的
的 ,
, 的
的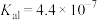 ,
, );
);
(6)滤渣Ⅱ的主要成分为 ,在高温条件下,
,在高温条件下, 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成
,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______
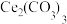 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以
可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以 形式存在,还含有
形式存在,还含有 、
、 、
、 、
、 等物质。以独居石为原料制备
等物质。以独居石为原料制备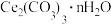 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为
(2)为提高“水浸”效率,可采取的措施有
(3)滤渣Ⅲ的主要成分是
(4)加入絮凝剂的目的是
(5)“沉铈”过程中,生成
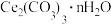 的离子方程式为
的离子方程式为 溶液呈
溶液呈 的
的 ,
, 的
的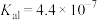 ,
, );
);(6)滤渣Ⅱ的主要成分为
 ,在高温条件下,
,在高温条件下, 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成
,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
【推荐3】锌是一种常用金属,冶炼方法有火法和湿法。回答下列问题:
I. 镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga在元素周期表中的位置为_______________ 。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为_______________ 。
(3)下列有关镓和镓的化合物的说法正确的是_____________ (填字母)。
A. 一定条件下,Ga可溶于盐酸和氢氧化钠溶液
B. 常温下,Ga可与水剧烈反应放出氢气
C. Ga2O3可由Ga(OH)3受热分解得到
D. 一定条件下,Ga2O3可与NaOH反应生成盐
II. 工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示。
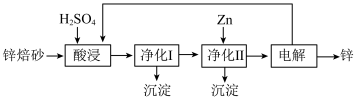
已知:Fe的活泼性强于Ni。
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式___________________ 。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,仅使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________________________ 。
(6)净化II中加入Zn的目的是_______________________________________ 。
III. (7)某化学课外小组拟用废旧电池锌皮(含杂质铁),结合如图所示信息,从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。

实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1的稀硫酸,加入_______ (选填字母,下同);
A. 30%H2O2 B. 新制氯水
C. FeCl3溶液 D. KSCN溶液
②加入__________ ;
A. 纯锌粉 B. 纯碳酸钙粉末
C. 纯ZnO粉末 D. 3mol·L-1的稀硫酸
③加热到60℃左右并不断搅拌;
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是________________________________ 。
I. 镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga在元素周期表中的位置为
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为
(3)下列有关镓和镓的化合物的说法正确的是
A. 一定条件下,Ga可溶于盐酸和氢氧化钠溶液
B. 常温下,Ga可与水剧烈反应放出氢气
C. Ga2O3可由Ga(OH)3受热分解得到
D. 一定条件下,Ga2O3可与NaOH反应生成盐
II. 工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示。

已知:Fe的活泼性强于Ni。
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,仅使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是
(6)净化II中加入Zn的目的是
III. (7)某化学课外小组拟用废旧电池锌皮(含杂质铁),结合如图所示信息,从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。

实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1的稀硫酸,加入
A. 30%H2O2 B. 新制氯水
C. FeCl3溶液 D. KSCN溶液
②加入
A. 纯锌粉 B. 纯碳酸钙粉末
C. 纯ZnO粉末 D. 3mol·L-1的稀硫酸
③加热到60℃左右并不断搅拌;
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】锂、铍等金属广泛应用于航空航天、核能和新能源汽车等高新产业。一种从萤石矿(主要含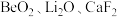 及少量
及少量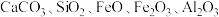 )中提取铍的工艺如图所示:
)中提取铍的工艺如图所示:
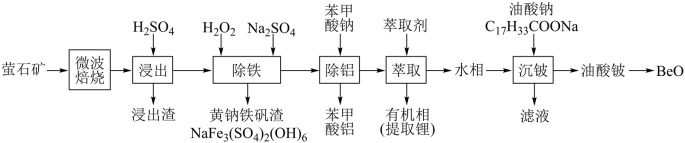
已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,温度升高,溶解度增大。
回答下列问题:
(1)“微波焙烧”使矿物内部变得疏松多孔,目的是_______ 。
(2)由油酸铍制备 的方法是
的方法是_______ 。
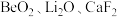 及少量
及少量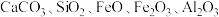 )中提取铍的工艺如图所示:
)中提取铍的工艺如图所示:
已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,温度升高,溶解度增大。
回答下列问题:
(1)“微波焙烧”使矿物内部变得疏松多孔,目的是
(2)由油酸铍制备
 的方法是
的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】甘氨酸亚铁[(NH2CH2COO)2Fe]是新一代畜禽饲料补铁添加剂。某实验小组以硫酸亚铁为铁源制备甘氨酸亚铁,其简要流程如下。

已知相关物质的信息如下:
回答下列问题:
(1)步骤(a)中加入铁粉的作用是_______ ;写出生成沉淀的化学方程式:_______ 。
(2)步骤(b)中为了提高甘氨酸亚铁的产率,需要控制溶液的pH在5.5~6.0之间,pH过低甘氨酸亚铁产率将下降,其原因为_______ ;柠檬酸的作用包括_______ (填字母)。
A.调节溶液的pH
B.除去步骤(a)中加入的铁粉
C.防止Fe2+被氧化
D.促进沉淀的溶解,加快反应速率
(3)步骤(b)中趁热过滤的目的是_______ 。
(4)步骤(c)中加入乙醇的目的是_______ 。
(5)产品中Fe2+含量的检测:称取m g样品溶解于适量蒸馏水中,配制成100.0 mL溶液。用移液管取出25.00 mL溶液于锥形瓶中,向其中加入一定量混酸X进行酸化,用c mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4溶液的体积为V mL。
①混酸X可以是_______ (填字母)。
A.HCl和H2SO4 B.HCl和H3PO4 C.H2SO4和H3PO4 D.H2SO4和HNO3 E.HCl和HNO3
②滴定终点的现象为_______ 。
③据此计算Fe2+的质量分数为_______ 。

已知相关物质的信息如下:
甘氨酸 (NH2CH2COOH) | 柠檬酸 (3-羟基-1,3,5-戊三酸) | 甘氨酸亚铁 [(NH2CH2COO)2Fe] |
| 易溶于水,微溶于乙醇,具有两性 | 易溶于水和乙醇,具有较强的酸性和还原性 | 浅黄褐绿色结晶粉末,易溶于水,难溶于乙醇,结构如下图: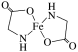 |
回答下列问题:
(1)步骤(a)中加入铁粉的作用是
(2)步骤(b)中为了提高甘氨酸亚铁的产率,需要控制溶液的pH在5.5~6.0之间,pH过低甘氨酸亚铁产率将下降,其原因为
A.调节溶液的pH
B.除去步骤(a)中加入的铁粉
C.防止Fe2+被氧化
D.促进沉淀的溶解,加快反应速率
(3)步骤(b)中趁热过滤的目的是
(4)步骤(c)中加入乙醇的目的是
(5)产品中Fe2+含量的检测:称取m g样品溶解于适量蒸馏水中,配制成100.0 mL溶液。用移液管取出25.00 mL溶液于锥形瓶中,向其中加入一定量混酸X进行酸化,用c mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4溶液的体积为V mL。
①混酸X可以是
A.HCl和H2SO4 B.HCl和H3PO4 C.H2SO4和H3PO4 D.H2SO4和HNO3 E.HCl和HNO3
②滴定终点的现象为
③据此计算Fe2+的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】某小组以黄铜矿(主要成分为 CuFeS2,含少量SiO2等杂质)为原料制备铜化工产品CuAlO2的一种工艺如下:

已知①过滤1所得滤液中含金属离子有:Cu2+、Fe2+和Fe3+,滤渣1的主要成分是SiO2和S;
②Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。
(1)从产品纯度、环保操作方便等角度考虑,试剂A、B的最佳组合是__________ (填代号)
(2)铵明矾的化学式为NH4Al(SO4)2·12H2O,它为制备铜的化工产品提供铝源。铵明矾溶液中NH4+、A13+、H+、OH-、SO42-浓度大小排序为_______________ 。
(3)过滤3得到A1(OH)3和Cu(OH)2,写出“灼烧”发生化学反应的方程式:_________________ 。
(4)单位时间内“浸取”Cu2+的百分率(称为浸出率)与溶液浓度、温度关系如下图所示。
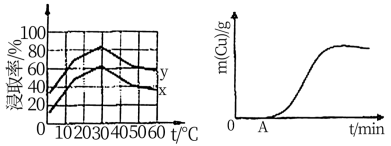
在20℃时,1L溶液中有效碰撞总次数:x_________ y(填“>”“<”或“=”)。相同浓度下,温度高于30℃,“浸出率”降低的主要原因是_________________ 。
(5)以铜、石墨为电极,电解“过滤1”所得溶液制备铜,铜的质量与通电时间关系如上图所示。写出OA段阴极的反应方程式:___________________________ 。
(6)常温下,Ksp[Fe(OH)3]=4.0×10-38。加入试剂B调节pH=3时c(Fe3+)=_________ mol/L

已知①过滤1所得滤液中含金属离子有:Cu2+、Fe2+和Fe3+,滤渣1的主要成分是SiO2和S;
②Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。
(1)从产品纯度、环保操作方便等角度考虑,试剂A、B的最佳组合是
| a | b | c | d | |
| A | HNO3 | NaClO | H2O2 (酸化) | H2O2 (酸化) |
| B | Cu(OH)2 | NaOH | 氨水 | Cu(OH)2 CO3 |
(3)过滤3得到A1(OH)3和Cu(OH)2,写出“灼烧”发生化学反应的方程式:
(4)单位时间内“浸取”Cu2+的百分率(称为浸出率)与溶液浓度、温度关系如下图所示。

在20℃时,1L溶液中有效碰撞总次数:x
(5)以铜、石墨为电极,电解“过滤1”所得溶液制备铜,铜的质量与通电时间关系如上图所示。写出OA段阴极的反应方程式:
(6)常温下,Ksp[Fe(OH)3]=4.0×10-38。加入试剂B调节pH=3时c(Fe3+)=
您最近一年使用:0次



