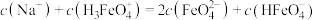常温下,磷酸钠溶液中含磷微粒的分布随pH的变化如图所示,M、N、P三点对应的pH分别为a、b、c,其中δ表示含磷微粒的物质的量分数。下列说法错误的是
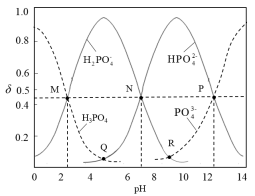

A.常温下, 的一级电离平衡常数Ka1=10-a 的一级电离平衡常数Ka1=10-a |
B.常温下,溶液中水电离出的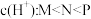 |
C.Q点与R点对应溶液的pH差: |
D.用磷酸标准溶液滴定NaOH溶液,选择酚酞作指示剂,终点时溶质主要为 |
20-21高二上·河南新乡·期末 查看更多[7]
河南省新乡市2020-2021学年高二上学期期末考试化学试题湖北省仙桃中学、天门中学(B班)2021-2022学年高二上学期期中考试化学试题(已下线)专题18 酸碱混合图像为载体考查离子平衡-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)江西省宜春市铜鼓中学2021-2022学年高二下学期第一次月考(实验班)化学试卷(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题四 电解质溶液图象(练)湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题
更新时间:2021-02-03 15:59:45
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】常温下,向10mL0.2mol/LH2C2O4溶液中滴加0.2mol/LKOH溶液,水电离出氢离子浓度c(H+)与加入氢氧化钾溶液的体积的变化如下图,已知常温下,H2C2O4的电离常数为:K1=5.0×10-2,K2=5.4×10-5,根据图示判断,下列说法不正确的是


| A.c点的溶液显碱性 |
| B.a点时,加入KOH溶液的体积V1=10mL |
| C.b点时,溶液中各粒子浓度的大小顺序为:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) |
| D.当V(KOH)=15mL时,溶液中存在以下关系:2c(K+)=3c(C2O42-)+3c(HC2O4-)+3c(H2C2O4) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】常温下,向20mL 0.2mol/LH2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是
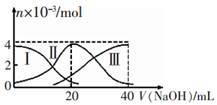

| A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
| B.等浓度的NaOH溶液与H2A溶液按体积2:1混合后,其溶液中水的电离程度比纯水大 |
| C.NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A) |
| D.向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】室温下,向20.00mL0.1000mol•L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与pH随加如稀硫酸体积的变化如图所示。下列说法正确的是
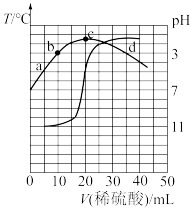

| A.稀硫酸的浓度为0.1000mol•L-1 |
| B.室温下MOH的电离平衡常数Kb=1.0×10-6 |
| C.b点对应的溶液中:2c(OH-)+c(MOH)=c(M+)+2c(H+) |
D.当pH=7时,溶液中存在c(H+)=c(OH-)<c(M+)<c(SO ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
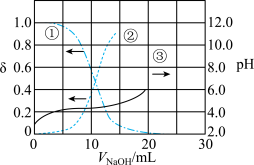
【推荐2】以酚酞为指示剂,用 溶液滴定
溶液滴定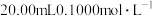 一元酸
一元酸 的溶液。溶液中,
的溶液。溶液中, 、分布系数(
、分布系数( ,比如
,比如 的分布系数:
的分布系数: )随
)随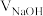 的变化关系如图所示,下列叙述不正确的是
的变化关系如图所示,下列叙述不正确的是
 溶液滴定
溶液滴定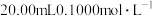 一元酸
一元酸 的溶液。溶液中,
的溶液。溶液中, 、分布系数(
、分布系数( ,比如
,比如 的分布系数:
的分布系数: )随
)随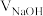 的变化关系如图所示,下列叙述不正确的是
的变化关系如图所示,下列叙述不正确的是
A.曲线①代表 ,曲线②代表 ,曲线②代表 |
B. 的数量级为 的数量级为 |
C.滴定过程中,溶液中 不断减小 不断减小 |
D.滴定终点时,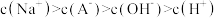 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】已知 ,25℃时,
,25℃时, 的
的 ,
,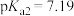 。常温下,用
。常温下,用 NaOH溶液滴定20mL
NaOH溶液滴定20mL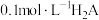 溶液的滴定曲线如图所示。下列说法不正确的是
溶液的滴定曲线如图所示。下列说法不正确的是
 ,25℃时,
,25℃时, 的
的 ,
,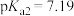 。常温下,用
。常温下,用 NaOH溶液滴定20mL
NaOH溶液滴定20mL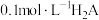 溶液的滴定曲线如图所示。下列说法不正确的是
溶液的滴定曲线如图所示。下列说法不正确的是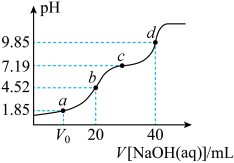
| A.a、b、c、d四点对应的溶液中水的电离程度a<b<c<d |
B.c点所对应的溶液中各粒子浓度满足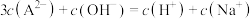 |
C.当加入NaOH溶液的体积为20mL时,溶液中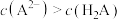 |
D.a点加入NaOH溶液的体积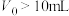 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】 时,用
时,用 溶液滴定
溶液滴定 溶液,溶液中
溶液,溶液中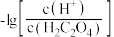 和
和 的
的 或
或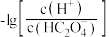 和
和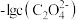 关系如图所示,下列说法不正确的是
关系如图所示,下列说法不正确的是

 时,用
时,用 溶液滴定
溶液滴定 溶液,溶液中
溶液,溶液中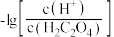 和
和 的
的 或
或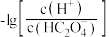 和
和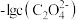 关系如图所示,下列说法不正确的是
关系如图所示,下列说法不正确的是
A.曲线 表示 表示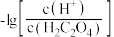 和 和 的关系 的关系 |
B.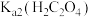 的数量级为 的数量级为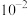 |
C.已知  溶液的 溶液的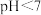 ,则溶液中 ,则溶液中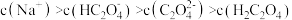 |
D.向  溶液中加入少量水, 溶液中加入少量水,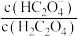 增大 增大 |
您最近一年使用:0次

 的酸性强于
的酸性强于 ,分别向
,分别向 的
的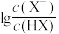 (X表示F或
(X表示F或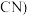 随
随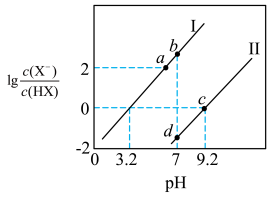
 随
随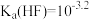
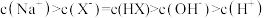
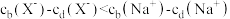
 的NaOH溶液滴定体积均是20mL、浓度均为
的NaOH溶液滴定体积均是20mL、浓度均为
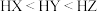
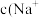
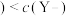
 )溶液中,溶液中含铁微粒存在如下平衡:
)溶液中,溶液中含铁微粒存在如下平衡: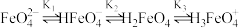 ,各微粒的物质的量分数
,各微粒的物质的量分数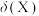 随pOH变化如图
随pOH变化如图 。下列说法正确的是
。下列说法正确的是
 变化
变化 时,溶液
时,溶液
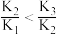
 时,溶液中
时,溶液中