CO、CH4 和 N2H4都可以作为燃料。回答下列问题:
(1)工业制氢气原理如下:CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H= +206.4 kJ·mol-1。该反应能自发进行的条件为:______ 。(选填“任何条件”、“低温”、“高温”、“任何条件均不能自发”)
(2)对于上述反应一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是______ 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(3)恒温恒容条件下,以下能说明该反应达到平衡状态的是______ 。
a.v消耗(CO)=v生成(H2O) b.c(H2O)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
e.混合气体平均相对分子质量不再改变 f.氢气的质量分数不再改变
(4)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8 g气体肼在上述反应中放出142 kJ热量,其热化学方程式为______ 。
(5)草酸与KMnO4在酸性条件下能够发生如下反应:MnO +H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4 mL0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4 mL0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
如果研究催化剂对化学反应速率的影响,应选用实验______ 和______ (用Ⅰ~Ⅳ表示)。
(1)工业制氢气原理如下:CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H= +206.4 kJ·mol-1。该反应能自发进行的条件为:
(2)对于上述反应一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(3)恒温恒容条件下,以下能说明该反应达到平衡状态的是
a.v消耗(CO)=v生成(H2O) b.c(H2O)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
e.混合气体平均相对分子质量不再改变 f.氢气的质量分数不再改变
(4)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8 g气体肼在上述反应中放出142 kJ热量,其热化学方程式为
(5)草酸与KMnO4在酸性条件下能够发生如下反应:MnO
 +H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4 mL0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4 mL0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | / |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | / |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
如果研究催化剂对化学反应速率的影响,应选用实验
更新时间:2021-02-28 09:14:04
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】化学反应速率和限度是中学化学原理中很重要部分,根据所学知识回答下列问题:
I.用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:

(1)实验过程如图所示,分析判断_______ 段化学反应速率最快。
(2)将锌粒投入盛有稀盐酸的烧杯中,产生H2的速率逐渐加快,其主要原因是_______ 。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质少许,你认为可行的是_______
II.某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
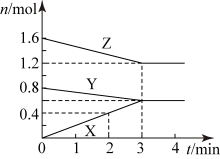
(4)该反应的化学方程式:_______ ;
(5)反应开始至2 min末,Y的平均反应速率为_______ 。(保留3位小数)
I.用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:

(1)实验过程如图所示,分析判断
(2)将锌粒投入盛有稀盐酸的烧杯中,产生H2的速率逐渐加快,其主要原因是
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质少许,你认为可行的是_______
| A.几滴硫酸铜溶液 | B.蒸馏水 | C.CH3COONa固体 | D.浓盐酸 |
II.某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:

(4)该反应的化学方程式:
(5)反应开始至2 min末,Y的平均反应速率为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】请你查找资料,了解合成氨的工业生产中采取了哪些措施提高原料的利用率,以及合成氨工艺有哪些新的进展____ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】按要求回答下列问题:
(1)下列变化中属于吸热反应的是___ 。
①铝片与稀盐酸的反应
②将胆矾加热变为白色粉末
③干冰汽化
④氯酸钾分解制氧气
⑤甲烷在氧气中的燃烧反应
⑥NaHCO3与盐酸的反应
(2)反应C(s)+H2O(g) CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是___ 。
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积变大
(3)在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图:
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图:

①从3min到9min,v(CO2)=__ (结果保留两位有效数字);a点时v(正)__ v(逆)(填﹥、﹤或=,下同);第9分钟时v逆(CH3OH)___ 第3分钟时v正(CH3OH)。
②若已知生成标准状况下2.24LCH3OH(g)时放出热量为4.9kJ,而上述反应的实际放热量总小于49kJ,其原因是___ 。
(4)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。

①该微生物燃料电池,负极为___ (填“a”或“b”)。
②该电池正极电极反应式为___ 。
③当电路中有0.5mol电子发生转移,则有___ mol的H+通过质子交换膜。
(1)下列变化中属于吸热反应的是
①铝片与稀盐酸的反应
②将胆矾加热变为白色粉末
③干冰汽化
④氯酸钾分解制氧气
⑤甲烷在氧气中的燃烧反应
⑥NaHCO3与盐酸的反应
(2)反应C(s)+H2O(g)
 CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积变大
(3)在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图:
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图:
①从3min到9min,v(CO2)=
②若已知生成标准状况下2.24LCH3OH(g)时放出热量为4.9kJ,而上述反应的实际放热量总小于49kJ,其原因是
(4)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。

①该微生物燃料电池,负极为
②该电池正极电极反应式为
③当电路中有0.5mol电子发生转移,则有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知2A2(g)+B2(g) 2C3(g),ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。
2C3(g),ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。
(1)比较a_______ b(填“>”“=”或“<”)。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将___________ (填“增大”“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是___________ 。
a.v(C3)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的操作是__________ 。
a.及时分离出C3气体 b.适当升高温度
c.增大B2的浓度 d.选择高效的催化剂
 2C3(g),ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。
2C3(g),ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。(1)比较a
(2)若将反应温度升高到700 ℃,该反应的平衡常数将
(3)能说明该反应已经达到平衡状态的是
a.v(C3)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的操作是
a.及时分离出C3气体 b.适当升高温度
c.增大B2的浓度 d.选择高效的催化剂
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s) +6C(s)+2N2(g)  Si3N4(s) +
Si3N4(s) +____ CO(g)
(1)在横线上填上化学计量数;
(2)该反应的氧化剂是________ ,
(3)该反应的平衡常数表达式为K=__________ ;
(4)若知上述反应为放热反应,则其反应热△H_____ 0(填“大于”、“小于”或“等于”);升高温度,其平衡常数值______ (填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向______ 反应方向移动(填“正”或“逆”)。
 Si3N4(s) +
Si3N4(s) +(1)在横线上填上化学计量数;
(2)该反应的氧化剂是
(3)该反应的平衡常数表达式为K=
(4)若知上述反应为放热反应,则其反应热△H
(5)若使压强增大,则上述平衡向
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】I.目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应过程中能量的变化。
CH3OH(g)+H2O(g),如图表示该反应过程中能量的变化。
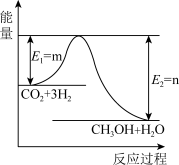
(1)该反应为____ 反应(“吸热”或“放热”)。
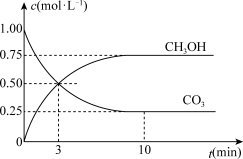
(2)在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=____ 。反应达到平衡时CO2的转化率为____ 。平衡时CH3OH的体积分数为____ 。
II.在298K时,将0.1molN2O4气体充入1L抽空的密闭容器中,回答下列问题:
(3)当反应达到平衡时,对于反应N2O4(g) 2NO2(g),改变某一条件后,下列说法中,一定能说明化学平衡向正反应方向移动的是
2NO2(g),改变某一条件后,下列说法中,一定能说明化学平衡向正反应方向移动的是____ (填序号)。
①气体颜色加深②NO2的体积分数增加③单位时间内消耗N2O4和NO2的物质的量之比大于1∶2④恒温恒压充入He
(4)达到平衡后下列条件的改变可使NO2反应速率增大的是____ (填字母序号)。
a.扩大容器的容积 b.再充入一定量的N2O4 c.分离出一定量的NO2
(5)在固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)。已知Fe3+对H2O2的分解具有催化作用。利用如图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的
N2O4(g)。已知Fe3+对H2O2的分解具有催化作用。利用如图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的____ (填“深”或“浅”),其原因是____ 。

 CH3OH(g)+H2O(g),如图表示该反应过程中能量的变化。
CH3OH(g)+H2O(g),如图表示该反应过程中能量的变化。
(1)该反应为
(2)在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=

II.在298K时,将0.1molN2O4气体充入1L抽空的密闭容器中,回答下列问题:
(3)当反应达到平衡时,对于反应N2O4(g)
 2NO2(g),改变某一条件后,下列说法中,一定能说明化学平衡向正反应方向移动的是
2NO2(g),改变某一条件后,下列说法中,一定能说明化学平衡向正反应方向移动的是①气体颜色加深②NO2的体积分数增加③单位时间内消耗N2O4和NO2的物质的量之比大于1∶2④恒温恒压充入He
(4)达到平衡后下列条件的改变可使NO2反应速率增大的是
a.扩大容器的容积 b.再充入一定量的N2O4 c.分离出一定量的NO2
(5)在固定体积的密闭容器中,发生可逆反应:2NO2(g)
 N2O4(g)。已知Fe3+对H2O2的分解具有催化作用。利用如图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的
N2O4(g)。已知Fe3+对H2O2的分解具有催化作用。利用如图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】Ⅰ、一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
II、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
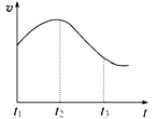
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
(1)试分析实验①中t1~t2速率变化的主要原因是____ ,t2~t3速率变化的主要原因是___ 。
(2)实验②放出氢气的量减少的原因是______ 。
 bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应化学方程式中 =
=
(2)t1到t2时刻,以N的浓度变化表示的平均反应速率为:
(3)下列叙述中能说明上述反应达到平衡状态的是
A.反应中M与N的物质的量之比为1︰1
B.N的质量分数在混合气体中保持不变
C.单位时间内每消耗a mol N,同时生成b mol M
D.混合气体的总物质的量不随时间的变化而变化
E.混合气体的压强不随时间的变化而变化
F.混合气体的总质量不随时间的变化而变化
II、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是
(2)实验②放出氢气的量减少的原因是
您最近一年使用:0次
【推荐2】研究二氧化碳合成甲醇对实现“碳中和”具有重要意义,二氧化碳加氢制甲醇的总反应可表示为: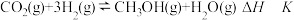 ,该反应一般认为通过如下步骤来实现,反应进程与体系能量变化关系如图所示:
,该反应一般认为通过如下步骤来实现,反应进程与体系能量变化关系如图所示:

①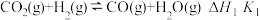
②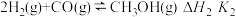
回答下列问题:
(1)
___________ 0(填“>”或“<”,)。
(2)对于合成甲醇总反应,要加快其反应速率并使其在一定条件下建立的平衡正向移动,可采取的措施有___________ (填字母,后同)。
A.增大反应容器的容积
B.缩小反应容器的容积
C.从平衡体系中及时分离出
D.升高温度
E.使用合适的催化剂
(3)一定温度下,将 和
和 以物质的量之比为1:1充入盛有催化剂的密闭容器中,发生合成甲醇总反应;某时刻t1,当下列量不再变化时,一定能说明该反应处于平衡状态的是___________(填字母)
以物质的量之比为1:1充入盛有催化剂的密闭容器中,发生合成甲醇总反应;某时刻t1,当下列量不再变化时,一定能说明该反应处于平衡状态的是___________(填字母)
(4)500℃时,已知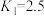 ,
,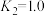 。往2L恒容密闭容器中充入
。往2L恒容密闭容器中充入 和
和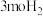 ,测得某时刻t2,合成甲醇总反应中
,测得某时刻t2,合成甲醇总反应中 的转化率为66.67%(约转化了
的转化率为66.67%(约转化了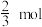 ),则t2时合成甲醇总反应的
),则t2时合成甲醇总反应的
___________ 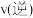 (填“>、<”或“=”),并通过计算说明理由
(填“>、<”或“=”),并通过计算说明理由___________ 。
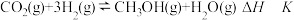 ,该反应一般认为通过如下步骤来实现,反应进程与体系能量变化关系如图所示:
,该反应一般认为通过如下步骤来实现,反应进程与体系能量变化关系如图所示:
①
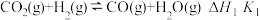
②
回答下列问题:
(1)

(2)对于合成甲醇总反应,要加快其反应速率并使其在一定条件下建立的平衡正向移动,可采取的措施有
A.增大反应容器的容积
B.缩小反应容器的容积
C.从平衡体系中及时分离出

D.升高温度
E.使用合适的催化剂
(3)一定温度下,将
 和
和 以物质的量之比为1:1充入盛有催化剂的密闭容器中,发生合成甲醇总反应;某时刻t1,当下列量不再变化时,一定能说明该反应处于平衡状态的是___________(填字母)
以物质的量之比为1:1充入盛有催化剂的密闭容器中,发生合成甲醇总反应;某时刻t1,当下列量不再变化时,一定能说明该反应处于平衡状态的是___________(填字母)| A.平衡常数K不再变化 | B. 的体积分数不再变化 的体积分数不再变化 |
C. 的体积分数不再变化 的体积分数不再变化 | D.反应的焓变 不再变化 不再变化 |
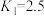 ,
,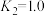 。往2L恒容密闭容器中充入
。往2L恒容密闭容器中充入 和
和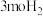 ,测得某时刻t2,合成甲醇总反应中
,测得某时刻t2,合成甲醇总反应中 的转化率为66.67%(约转化了
的转化率为66.67%(约转化了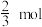 ),则t2时合成甲醇总反应的
),则t2时合成甲醇总反应的
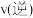 (填“>、<”或“=”),并通过计算说明理由
(填“>、<”或“=”),并通过计算说明理由
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)如图所示,将锌、铜通过导线相连,置于稀硫酸中。___ 。
②电解质溶液中的H+离子往__ 极移动。
③当收集到氢气4.48L(标况下)时,通过导线的电子为__ mol。
(2)工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。___ min,该密闭容器的容积是___ L。
②在前10min内,用CO2浓度的变化表示的反应速率v(CO2)=__ 。
③反应达平衡状态时,下列描述正确的是__ 。
A.c(CH3OH)=c(H2O)
B.单位时间内,CO2的消耗速率等于H2O的消耗速率
C.CH3OH的浓度保持不变
D.CO2与H2的质量之和等于CH3OH与H2O的质量之和

②电解质溶液中的H+离子往
③当收集到氢气4.48L(标况下)时,通过导线的电子为
(2)工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
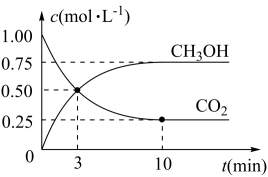
②在前10min内,用CO2浓度的变化表示的反应速率v(CO2)=
③反应达平衡状态时,下列描述正确的是
A.c(CH3OH)=c(H2O)
B.单位时间内,CO2的消耗速率等于H2O的消耗速率
C.CH3OH的浓度保持不变
D.CO2与H2的质量之和等于CH3OH与H2O的质量之和
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】含硫化合物是实验室和工业上的常用化学品。请回答:
(1)实验室可用铜与浓硫酸反应制备少量SO2:Cu(s)+2H2SO4(l)=CuSO4(s)+SO2(g)+2H2O(l) ΔH=−11.9kJ·mol-1。判断该反应的自发性并说明理由___________ 。
(2)已知2SO2(g)+O2 2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。
2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。
①反应开始到第10分钟,SO3反应速率为________ 。
②该温度下反应的平衡常数为________ 。
③平衡时SO2的转化率为________ 。
(3)工业上主要采用接触法用含硫矿石制备硫酸。其主要工艺是焙烧、炉气精制、用钒做催化剂将SO2氧化成SO3、吸收等。结合本大题的信息,完成下题。
①下列说法正确的是______ 。
a.须采用高温高压的反应条件使SO2氧化为SO3
b.通入过量的空气可以提高含硫矿石和SO2的转化率
c.进入接触室之前的气流无需净化处理
②在焙烧前要将硫铁矿粉碎,这样做的目的是______ 。
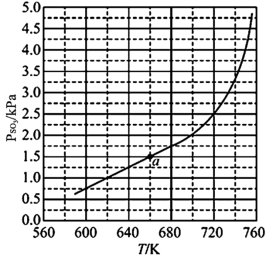
(4)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s) Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)
Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)_____ kPa,Kp(Ⅰ)随反应温度升高而_____ (填“增大”“减小”或“不变”)。
(1)实验室可用铜与浓硫酸反应制备少量SO2:Cu(s)+2H2SO4(l)=CuSO4(s)+SO2(g)+2H2O(l) ΔH=−11.9kJ·mol-1。判断该反应的自发性并说明理由
(2)已知2SO2(g)+O2
 2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。
2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。①反应开始到第10分钟,SO3反应速率为
②该温度下反应的平衡常数为
③平衡时SO2的转化率为
(3)工业上主要采用接触法用含硫矿石制备硫酸。其主要工艺是焙烧、炉气精制、用钒做催化剂将SO2氧化成SO3、吸收等。结合本大题的信息,完成下题。
①下列说法正确的是
a.须采用高温高压的反应条件使SO2氧化为SO3
b.通入过量的空气可以提高含硫矿石和SO2的转化率
c.进入接触室之前的气流无需净化处理
②在焙烧前要将硫铁矿粉碎,这样做的目的是
(4)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s)
 Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)
Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】请回答下列问题:
(1)写出N2H 的电子式
的电子式___________ 。
(2)CH4、H2O、H2S沸点由低到高的顺序是___________ 。
(3)判断2H2(g)+O2(g)=2H2O(l)反应的自发性并说明理由___________ 。
(1)写出N2H
 的电子式
的电子式(2)CH4、H2O、H2S沸点由低到高的顺序是
(3)判断2H2(g)+O2(g)=2H2O(l)反应的自发性并说明理由
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
(1)在密闭容器中充入NH3和CO2 ,一定条件能自发进行的原因是__________________ ;
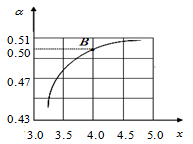
(2)T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)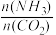 =x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是
=x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是_________________ ;
(3)当x=2,上述反应至5min时各物质的浓不再发生变化,若起始的压强为P0 KPa,测得平衡体系压强变为起始时的 。反应结束后,分离得到90g尿素。
。反应结束后,分离得到90g尿素。
试计算该反应的平均速率v(CO2)=___________________ ,
该反应的平衡常数(K)=________________ ,
达到平衡后NH3的物质的量浓度为_________________ 。
2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)(1)在密闭容器中充入NH3和CO2 ,一定条件能自发进行的原因是

(2)T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)
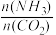 =x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是
=x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是(3)当x=2,上述反应至5min时各物质的浓不再发生变化,若起始的压强为P0 KPa,测得平衡体系压强变为起始时的
 。反应结束后,分离得到90g尿素。
。反应结束后,分离得到90g尿素。试计算该反应的平均速率v(CO2)=
该反应的平衡常数(K)=
达到平衡后NH3的物质的量浓度为
您最近一年使用:0次



