中科院大连化物所研发的甲醇制乙烯技术能有效解决化工生产依赖进口石油的问题。该技术涉及如下反应:
甲醇制乙烯:2CH3OH(g)⇌C2H4(g)+2H2O(g)ΔH1
甲醇脱水:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)ΔH2=-24.0kJ·mol-1
已知:C2H5OH(g)⇌CH3OCH3(g)ΔH3=+50.8kJ·mol-1
C2H4(g)+H2O(g)⇌C2H5OH(g)ΔH4=-45.8kJ·mol-1
下列说法不正确 的是
甲醇制乙烯:2CH3OH(g)⇌C2H4(g)+2H2O(g)ΔH1
甲醇脱水:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)ΔH2=-24.0kJ·mol-1
已知:C2H5OH(g)⇌CH3OCH3(g)ΔH3=+50.8kJ·mol-1
C2H4(g)+H2O(g)⇌C2H5OH(g)ΔH4=-45.8kJ·mol-1
下列说法
| A.ΔH1>0 |
| B.甲醇脱水是放热反应 |
| C.减小压强,利于提高甲醇的平衡转化率 |
| D.加入选择性催化剂可抑制甲醇脱水反应的发生 |
21-22高三上·北京昌平·期末 查看更多[5]
(已下线)化学-2022年高考押题预测卷01(北京卷)黑龙江省哈尔滨市第一六二中学2021-2022学年高三上学期第三次月考化学试题(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)北京市昌平区2021届高三上学期期末考试化学试题
更新时间:2021-03-08 10:29:41
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】向100 mL 0.5 mol·L-1 Ba(OH)2溶液中加入足量硫酸铜溶液充分反应后,放出a kJ的热量。如果向100 mL 0.5 mol·L-1 NaOH溶液中加入足量硫酸铜溶液充分反应后,放出b kJ的热量,则硫酸钠溶液与氯化钡溶液反应的热化学方程式为
A.Ba2+(aq)+SO (aq)=BaSO4(s) △H=-(a-b) kJ·mol-1 (aq)=BaSO4(s) △H=-(a-b) kJ·mol-1 |
B.Ba2+(aq)+SO (aq)=BaSO4(s) △H=-20(a-b) kJ·mol-1 (aq)=BaSO4(s) △H=-20(a-b) kJ·mol-1 |
C.Ba2+(aq)+SO (aq)=BaSO4(s) △H=-20(a-2b) kJ·mol-1 (aq)=BaSO4(s) △H=-20(a-2b) kJ·mol-1 |
D.Ba2+(aq)+SO (aq)=BaSO4(s) △H=-20(2a-b) kJ·mol-1 (aq)=BaSO4(s) △H=-20(2a-b) kJ·mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
| A.CH3OH(l)的燃烧热为1 452 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C. H2SO4(aq)+ H2SO4(aq)+ Ba(OH)2(aq)=== Ba(OH)2(aq)=== BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.6kJ·mol-1。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的图示与过程如下:
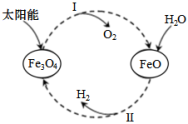
过程I:……
过程II:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+129.2kJ·mol﹣1
下列说法错误的是

过程I:……
过程II:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+129.2kJ·mol﹣1
下列说法错误的是
| A.该过程I能量转化形式是太阳能→化学能 |
B.过程I热化学方程式为:Fe3O4(s)=3FeO(s)+ O2(g) ΔH=﹣156.6kJ·mol﹣1 O2(g) ΔH=﹣156.6kJ·mol﹣1 |
| C.氢气的燃烧热为ΔH=﹣285.8 kJ·mol﹣1 |
| D.铁氧化合物循环制H2具有成本低、产物易分离等优点 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下述实验不能达到预期实验目的是
| 序号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸测定NaClO溶液和CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一会过滤 | 除去MgCl2中少量FeCl3 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】2021年我国科学家以 为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
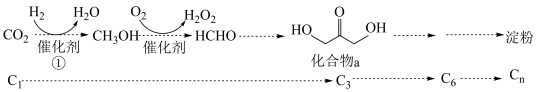
①
②
③
④
 为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
①

②

③

④

| A.第①步反应断裂了非极性键与极性键 |
| B.催化剂降低了反应的活化能,改变了反应的焓变,降低了合成淀粉的难度 |
C. |
| D.反应④是吸热反应,活化能较大,所以是决速步 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)是我国科学家2021年发布的由CO2人工合成淀粉中的重要反应之一、CO2与H2制备甲醇在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的物种用*标注,TS为过渡态),下列说法不正确的是
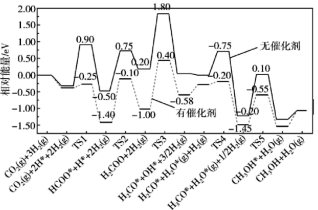

| A.升高温度,CO2与H2制备甲醇的反应v(逆)比v(正)增大的更多 |
| B.催化剂可使反应历程中决速步骤活化能降低0.20eV |
| C.加压、降温对制备甲醇有利,因此应该在高压、低温下进行上述反应 |
| D.CO2与H2制备甲醇反应往往伴随副反应,选择合适催化剂可提高甲醇反应的选择性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】一定条件下,体积为10L的密闭容器中,2molX和1molY进行反应:2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )| A.若压强增大1倍,则物质Y的转化率增大1倍 |
B.将容器体积变为20L,Z的平衡浓度变为原来的 |
| C.若升高温度,X的浓度增大,则该反应的正反应为吸热反应 |
| D.以X浓度变化表示的反应速率为0.001mol·L-1·s-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】往某恒温密闭容器中加入 ,发生反应:
,发生反应: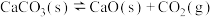 ,反应达到平衡后,
,反应达到平衡后, 时缩小容器体积,x随时间(t)变化的关系如图所示。x不可能是
时缩小容器体积,x随时间(t)变化的关系如图所示。x不可能是

 ,发生反应:
,发生反应: ,反应达到平衡后,
,反应达到平衡后, 时缩小容器体积,x随时间(t)变化的关系如图所示。x不可能是
时缩小容器体积,x随时间(t)变化的关系如图所示。x不可能是
A. | B. | C. | D.ρ(容器内气体密度) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】700℃时,向容积为2L的密闭容器中充入一定量的CO和 ,发生反应:
,发生反应: ,反应过程中测定的部分数据见下表:
,反应过程中测定的部分数据见下表:
下列说法正确的是
 ,发生反应:
,发生反应: ,反应过程中测定的部分数据见下表:
,反应过程中测定的部分数据见下表:| 反应时间/min |  |  |
| 0 | 1.20 | 0.60 |
| 10 | 0.80 | 0.20 |
| 20 | 0.20 |
A.反应在10min内的平均速率为 |
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20mol ,到达平衡时, ,到达平衡时, |
C.保持其他条件不变,向平衡体系中再通入0.20mol ,平衡正向移动, ,平衡正向移动, 的体积分数减小 的体积分数减小 |
| D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
您最近一年使用:0次



