某探究小组设计如下线路处理废液和资源回收:
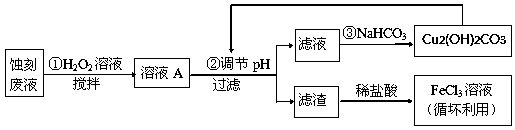
(1)用少量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:___________ 。
(2)FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:___________ 。
(3)步骤①中加入H2O2溶液的目的是:___________ 。
(4)已知:生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是:___________ 。
(5)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:___________ ,该过程中调节溶液的pH为5,则c(Fe3+)为:___________ mol·L-1.(已知:Ksp[Fe(OH)3]= 3.80×10-38)

(1)用少量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:
(2)FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:
(3)步骤①中加入H2O2溶液的目的是:
(4)已知:生成氢氧化物沉淀的pH
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.3 |
根据表中数据推测调节pH的范围是:
(5)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:
更新时间:2021-03-12 13:41:29
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
【推荐1】某混合物粉末样品,可能含有NaHCO3、Fe2O3、Cu2O、Na2SO4、Fe3O4、Al、NH4Cl中的一种或几种,某同学利用实验确定该样品的成分,操作如下:
①取一定量样品于烧杯中,加足量NaOH溶液,加热,产生气体A,过滤得到无色溶液B和固体C;
②将气体A通入到浓硫酸中,气体全部被吸收;
③向无色溶液B中加入BaCl2溶液,出现白色沉淀,再加入足量稀硫酸,产生气体,且仍有白色沉淀存在;
④向固体C中加入足量稀硫酸,固体完全溶解,得到溶液D;
⑤向溶液D中加入足量NaClO溶液,并调节pH至4~5,产生红褐色沉淀,过滤后得到蓝绿色溶液E。
已知:Cu2O难溶于水,与稀硫酸会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
请回答:
(1)上述混合物粉末样品中,一定存在的物质有___ ;一定不存在的物质有___ 。
(2)写出溶液D中加入足量NaClO溶液的离子反应方程式为___ 。
(3)仅通过操作④___ (填“可以”或“不可以”)判断Cu2O的存在情况,理由是___ (结合离子反应方程式加以说明)。
(4)结合整个操作过程,判断Na2SO4的存在情况:___ 。(若一定存在或一定不存在,则指出可判断的操作步骤;若可能存在,则请设计实验方案加以说明)。
①取一定量样品于烧杯中,加足量NaOH溶液,加热,产生气体A,过滤得到无色溶液B和固体C;
②将气体A通入到浓硫酸中,气体全部被吸收;
③向无色溶液B中加入BaCl2溶液,出现白色沉淀,再加入足量稀硫酸,产生气体,且仍有白色沉淀存在;
④向固体C中加入足量稀硫酸,固体完全溶解,得到溶液D;
⑤向溶液D中加入足量NaClO溶液,并调节pH至4~5,产生红褐色沉淀,过滤后得到蓝绿色溶液E。
已知:Cu2O难溶于水,与稀硫酸会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
请回答:
(1)上述混合物粉末样品中,一定存在的物质有
(2)写出溶液D中加入足量NaClO溶液的离子反应方程式为
(3)仅通过操作④
(4)结合整个操作过程,判断Na2SO4的存在情况:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】 是中学化学的常见物质,其中
是中学化学的常见物质,其中 均含有同一种元素。在一定条件下的相互转化关系如下图所示(部分反应产物已略去)。请回答:
均含有同一种元素。在一定条件下的相互转化关系如下图所示(部分反应产物已略去)。请回答:

(1)若A可用于制取漂白粉,D是生产、生活中用量最大的金属单质。漂白粉的有效成分是___ ,工业上常用B的溶液刻蚀铜制印刷线路板,该反应的离子方程式是_____ 。
(2)若溶液A焰色试验的火焰呈黄色,D是一种温室气体,反应③的离子方程式是_______ 。
(3)若反应①是制取水煤气的反应,则D的电子式为___ ,反应②的化学方程式是_____ 。
 是中学化学的常见物质,其中
是中学化学的常见物质,其中 均含有同一种元素。在一定条件下的相互转化关系如下图所示(部分反应产物已略去)。请回答:
均含有同一种元素。在一定条件下的相互转化关系如下图所示(部分反应产物已略去)。请回答:
(1)若A可用于制取漂白粉,D是生产、生活中用量最大的金属单质。漂白粉的有效成分是
(2)若溶液A焰色试验的火焰呈黄色,D是一种温室气体,反应③的离子方程式是
(3)若反应①是制取水煤气的反应,则D的电子式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被__ (填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如图:

①步骤1的离子方程式为__ ,证明步骤1所加FeCl3溶液过量的方法是__ 。
②步骤2中所加的氧化剂最适宜的是__ 。
A.HNO3 B.H2O2 C.KMnO4 D.氯水
写出加氧化剂相关的离子方程式__ (写一个即可)。
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的试剂1是___ 。(写出一种即可)
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是___ (用化学方程式并结合简要的文字说明),再经___ 、过滤得到CuCl2·2H2O。
(3)方法二:用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l) △H1=-320kJ/mol
又知:2H2O2(l)=2H2O(l)+O2(g) △H2=-196kJ/mol
H2(g)+ O2(g)=H2O(l) △H3=-286kJ/mol
O2(g)=H2O(l) △H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)的△H=___ 。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2
 2Cu+SO2
2Cu+SO2湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如图:

①步骤1的离子方程式为
②步骤2中所加的氧化剂最适宜的是
A.HNO3 B.H2O2 C.KMnO4 D.氯水
写出加氧化剂相关的离子方程式
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的试剂1是
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是
(3)方法二:用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l) △H1=-320kJ/mol
又知:2H2O2(l)=2H2O(l)+O2(g) △H2=-196kJ/mol
H2(g)+
 O2(g)=H2O(l) △H3=-286kJ/mol
O2(g)=H2O(l) △H3=-286kJ/mol则反应Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)的△H=
您最近一年使用:0次
【推荐1】磷锌白[Zn3(PO4)2]可用于生产无毒防锈颜料和水溶性涂料。一种利用烧铸灰(主要含ZnO,还含少量Fe3O4、PbO、SnO2、CuO及SiO2等)为原料制取磷锌白的工艺流程如下图所示:

回答下列问题:
(1)为提高“酸溶”时锌的浸出率,可采取的措施有_______ (列举1条),“滤渣1”的主要成分为_______ (填化学式)。
(2)写出“沉锰”步骤的离子方程式:_______ 。
(3)几种金属离子开始沉淀与沉淀完全的pH如下表所示:
“调pH”为4.0的目的是除去Fe3+和_______ ,为检验“过滤2”后的滤液中是否含有Fe3+,可选用的化学试剂是_______ 。
(4)“制备”时,加Na2HPO4至Zn2+恰好沉淀完全的离子方程式为_______ 。
(5)本实验采用过量的锌粉除去铜离子杂质,还可以通入H2S除铜离子,当通入H2S达到饱和时测得溶液的pH = 1,此时溶液中c(Cu2+)为_______ 。[已知:25℃,H2S溶于水形成饱和溶液时,c(H2S) = 0.1 mol/L;H2S的电离平衡常数Ka1 = 1×10−7,Ka2 = 1×10−13;Ksp(CuS) = 6×10−36]
(6)某工厂用7 t烧铸灰(氧化锌的质量分数为81%)进行上述工艺流程,最终制得Zn3(PO4)2 7.7 t,则产率为_______ (保留三位有效数字)。

回答下列问题:
(1)为提高“酸溶”时锌的浸出率,可采取的措施有
(2)写出“沉锰”步骤的离子方程式:
(3)几种金属离子开始沉淀与沉淀完全的pH如下表所示:
| 金属离子 | Sn4+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 0.5 | 2.2 | 4.8 | 6.5 |
| 沉淀完全的pH | 1.3 | 3.6 | 6.4 | 8.5 |
(4)“制备”时,加Na2HPO4至Zn2+恰好沉淀完全的离子方程式为
(5)本实验采用过量的锌粉除去铜离子杂质,还可以通入H2S除铜离子,当通入H2S达到饱和时测得溶液的pH = 1,此时溶液中c(Cu2+)为
(6)某工厂用7 t烧铸灰(氧化锌的质量分数为81%)进行上述工艺流程,最终制得Zn3(PO4)2 7.7 t,则产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7的主要流程如下:
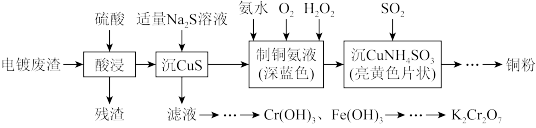
(1)“酸浸”时,用硫酸而不用盐酸,这是因为___________ 。
(2)“沉CuNH4SO3”时可用如下装置(夹持、加热仪器略):
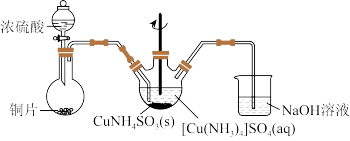
①“沉CuNH4SO3”时,反应液需控制在45℃,合适的加热方式是___________ 。
②反应完成的实验现象是___________ 。
(3)一水合硫酸四氨合铜加热到650℃可分解为铜、氨气、二氧化硫和水以及一种无污染气体,写出其化学方程式___________ 。
(4)设计以“Cr(OH)3、Fe(OH)3”的混合物为原料,制取K2Cr2O7的实验方案,选出其正确操作并按序列出字母:将Cr(OH)3、Fe(OH)3的混合物加入烧杯中,加适量的水调成浆状,___________ 、___________ ,维持pH大于7,充分反应后,煮沸,静置、过滤,滤液用稀盐酸酸化至pH<5,___________ 、___________ 、___________ 、___________ ,干燥。
已知:①碱性条件下,H2O2可将+3价的Cr氧化为 ;酸性条件下,H2O2可将+6价的Cr还原为+3价的Cr;+6价的Cr在溶液pH<5时,主要以
;酸性条件下,H2O2可将+6价的Cr还原为+3价的Cr;+6价的Cr在溶液pH<5时,主要以 的形式存在;在pH>7时,主要以
的形式存在;在pH>7时,主要以 的形式存在。
的形式存在。
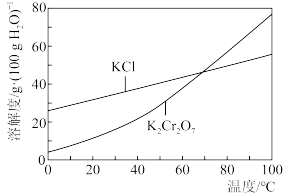
②部分物质溶解度曲线如图所示:
③实验中必须使用的试剂:KOH溶液、10%H2O2溶液、稀盐酸。
a.蒸发浓缩至适量晶体析出
b.常温下冷却结晶
c.冰浴冷却结晶
d.加入过量的10%H2O2溶液
e.不断搅拌下加入适量KOH溶液
f.趁热过滤
g.过滤
h.热水洗涤
i.冰水洗涤
(5)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.000g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L–1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复再进行二次实验。(已知 被还原为Cr3+),下列说法正确的是
被还原为Cr3+),下列说法正确的是___________
A.配制K2Cr2O7溶液的过程中,若定容时俯视容量瓶刻度线,最终会引起产品K2Cr2O7含量偏大
B.移取K2Cr2O7溶液时,向锥形瓶中放液完毕,立即取出移液管
C.滴定管读数时,放置在滴定管夹上读数比取下滴定管并竖直读数更合理、更准确
D.若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为24.00mL,则所得产品K2Cr2O7的纯度为58.80%。[已知M(K2Cr2O7)=294g·mol-1]

(1)“酸浸”时,用硫酸而不用盐酸,这是因为
(2)“沉CuNH4SO3”时可用如下装置(夹持、加热仪器略):

①“沉CuNH4SO3”时,反应液需控制在45℃,合适的加热方式是
②反应完成的实验现象是
(3)一水合硫酸四氨合铜加热到650℃可分解为铜、氨气、二氧化硫和水以及一种无污染气体,写出其化学方程式
(4)设计以“Cr(OH)3、Fe(OH)3”的混合物为原料,制取K2Cr2O7的实验方案,选出其正确操作并按序列出字母:将Cr(OH)3、Fe(OH)3的混合物加入烧杯中,加适量的水调成浆状,
已知:①碱性条件下,H2O2可将+3价的Cr氧化为
 ;酸性条件下,H2O2可将+6价的Cr还原为+3价的Cr;+6价的Cr在溶液pH<5时,主要以
;酸性条件下,H2O2可将+6价的Cr还原为+3价的Cr;+6价的Cr在溶液pH<5时,主要以 的形式存在;在pH>7时,主要以
的形式存在;在pH>7时,主要以 的形式存在。
的形式存在。②部分物质溶解度曲线如图所示:

③实验中必须使用的试剂:KOH溶液、10%H2O2溶液、稀盐酸。
a.蒸发浓缩至适量晶体析出
b.常温下冷却结晶
c.冰浴冷却结晶
d.加入过量的10%H2O2溶液
e.不断搅拌下加入适量KOH溶液
f.趁热过滤
g.过滤
h.热水洗涤
i.冰水洗涤
(5)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.000g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L–1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复再进行二次实验。(已知
 被还原为Cr3+),下列说法正确的是
被还原为Cr3+),下列说法正确的是A.配制K2Cr2O7溶液的过程中,若定容时俯视容量瓶刻度线,最终会引起产品K2Cr2O7含量偏大
B.移取K2Cr2O7溶液时,向锥形瓶中放液完毕,立即取出移液管
C.滴定管读数时,放置在滴定管夹上读数比取下滴定管并竖直读数更合理、更准确
D.若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为24.00mL,则所得产品K2Cr2O7的纯度为58.80%。[已知M(K2Cr2O7)=294g·mol-1]
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)做电极材料。对LiFePO4废旧电极(含杂质Al、石墨粉)回收并获得高纯Li2CO3的工业流程图如图:

资料:碳酸锂在水中溶解度:

(1)过程i研磨粉碎的目的是__________ 。
(2)过程ii加入足量NaOH溶液的作用(用反应方程式表示)___________ 。
(3)过程iii采用不同氧化剂分别进行实验,均采用Li含量为3.7%的原料,控制pH为3.5,浸取1.5h后,实验结果如表所示:
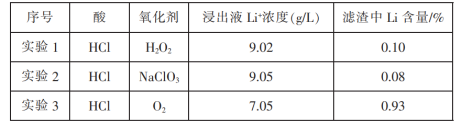
①实验2中,NaClO3与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为__________ 。
②综合考虑Li+的浸出率及环保因素,选择的氧化剂最好为___________ 。
③过程iii得到的浸出液循环两次的目的是________ 。
(4)浸出液中存在大量 和
和 ,已知:
,已知:

 +H+,
+H+,

 +H+,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因
+H+,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因____________ 。
(5)简述过程vi的操作___________ 。

资料:碳酸锂在水中溶解度:

(1)过程i研磨粉碎的目的是
(2)过程ii加入足量NaOH溶液的作用(用反应方程式表示)
(3)过程iii采用不同氧化剂分别进行实验,均采用Li含量为3.7%的原料,控制pH为3.5,浸取1.5h后,实验结果如表所示:

①实验2中,NaClO3与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为
②综合考虑Li+的浸出率及环保因素,选择的氧化剂最好为
③过程iii得到的浸出液循环两次的目的是
(4)浸出液中存在大量
 和
和 ,已知:
,已知:

 +H+,
+H+,

 +H+,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因
+H+,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因(5)简述过程vi的操作
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】科学家研制的新型铝合金(掺杂镁、锌和铜)将航天器屏蔽辐射能力提高百倍。某小组以铝质废料(主要成分是Al、 ,含少量
,含少量 、MgO、
、MgO、 等)为原料制备高纯度铝的流程如图所示:
等)为原料制备高纯度铝的流程如图所示:
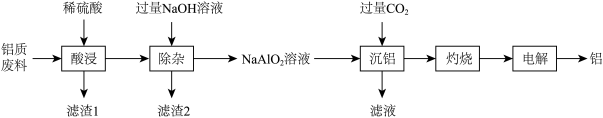
回答下列问题:
(1)滤渣2的主要成分是_______ (填化学式)。
(2)“酸浸”时,粉碎铝质废料的目的是_______ 。
(3)其他条件相同,“酸浸”中金属浸出率与硫酸浓度的关系如图所示。
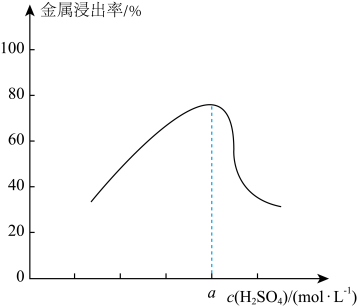
 时,金属浸出率急剧降低的可能原因是
时,金属浸出率急剧降低的可能原因是_______ 。
(4)已知常温下, 的
的 ,
, 的
的 。若酸浸液中
。若酸浸液中 mol·L
mol·L ,当
,当 开始沉淀时,
开始沉淀时,
_______ mol·L 。
。
(5)写出“沉铝”的离子方程式:_______ 。
(6)“电解”中以石墨为阳极、铝为阴极,写出阴极反应式:_______ 。电解过程中,需要定期在阳极更换石墨的原因是_______ 。
 ,含少量
,含少量 、MgO、
、MgO、 等)为原料制备高纯度铝的流程如图所示:
等)为原料制备高纯度铝的流程如图所示:
回答下列问题:
(1)滤渣2的主要成分是
(2)“酸浸”时,粉碎铝质废料的目的是
(3)其他条件相同,“酸浸”中金属浸出率与硫酸浓度的关系如图所示。

 时,金属浸出率急剧降低的可能原因是
时,金属浸出率急剧降低的可能原因是(4)已知常温下,
 的
的 ,
, 的
的 。若酸浸液中
。若酸浸液中 mol·L
mol·L ,当
,当 开始沉淀时,
开始沉淀时,
 。
。(5)写出“沉铝”的离子方程式:
(6)“电解”中以石墨为阳极、铝为阴极,写出阴极反应式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】已知草酸(H2C2O4)是一种二元弱酸,草酸及其盐广泛用于医药、印染、塑料等工业。
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
①25℃时,浓度均为0.1mol·L-1的Na2C2O4、CH3COONa、NaCN、Na2CO3的pH由大到小的顺序是___ 。中和等体积、等pH的HCOOH和HCN消耗NaOH的量___ (填“前者大”“后者大”或“相等”)。
②下列关于0.1mol·L-1NaHC2O4溶液的说法正确的是___ 。
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示。又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是____

A.在t℃时,MgC2O4的Ksp=8.1×10-5mol2·L-2
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4(s)+2OH-(aq)⇌Mg(OH)2(s)+C2O42-(aq)平衡常数K=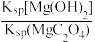
(3)草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解。某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
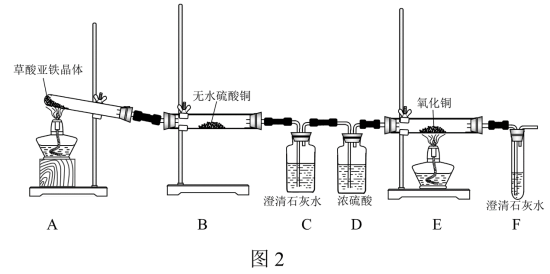
①从环保角度考虑,该套实验装置的明显缺陷是___ 。
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃___ (填“A”或“E”)处的酒精灯。
③若实验过程中观察到B中白色无水CuSO4变成蓝色,___ (补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2。
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4·2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g。若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为___ 。草酸亚铁晶体分解的化学方程式为___ 。
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
| 电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
| 电离常数(mol·L-1) | K1=5.6×10-2 K2=5.4×10-3 | K1=1.7×10-5 | K2=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
②下列关于0.1mol·L-1NaHC2O4溶液的说法正确的是
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示。又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是

A.在t℃时,MgC2O4的Ksp=8.1×10-5mol2·L-2
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4(s)+2OH-(aq)⇌Mg(OH)2(s)+C2O42-(aq)平衡常数K=
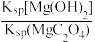
(3)草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解。某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:

①从环保角度考虑,该套实验装置的明显缺陷是
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃
③若实验过程中观察到B中白色无水CuSO4变成蓝色,
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4·2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g。若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】锂辉矿是生产锂离子电池的重要矿物资源。锂辉矿的主要成分为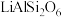 ,主要杂质为
,主要杂质为 。盐焙烧工艺提取锂辉矿中锂的工艺流程如图所示:
。盐焙烧工艺提取锂辉矿中锂的工艺流程如图所示:

已知:① 的
的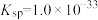 ,
, 的
的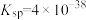 ,溶液中离子浓度小于
,溶液中离子浓度小于 时,即认为沉淀完全。
时,即认为沉淀完全。
②碳酸锂在不同温度下的溶解度如表所示:
回答下列问题:
(1)已知滤渣1的主要成分是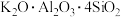 ,“焙烧”过程发生反应的化学方程式为
,“焙烧”过程发生反应的化学方程式为_______ 。
(2)“水浸”过程中,为提高浸出速率,可采取的措施有_______ (写出两条);加入NaOH溶液的目的是去除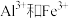 ,“调节pH”过程需要调节pH的范围是
,“调节pH”过程需要调节pH的范围是_______ 。
(3)“沉锂”过程发生反应的化学方程式为_______ 。
(4)洗涤产品 需要使用
需要使用_______ (填“冷水”或热水”),理由是_______ ,检验已洗涤干净的方法是_______ 。
(5)某工厂用at锂辉矿(含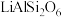 93%)制得bt
93%)制得bt  ,则
,则 的产率为
的产率为_______ 。
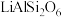 ,主要杂质为
,主要杂质为 。盐焙烧工艺提取锂辉矿中锂的工艺流程如图所示:
。盐焙烧工艺提取锂辉矿中锂的工艺流程如图所示:
已知:①
 的
的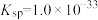 ,
, 的
的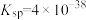 ,溶液中离子浓度小于
,溶液中离子浓度小于 时,即认为沉淀完全。
时,即认为沉淀完全。②碳酸锂在不同温度下的溶解度如表所示:
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
 的溶解度/g 的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
回答下列问题:
(1)已知滤渣1的主要成分是
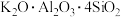 ,“焙烧”过程发生反应的化学方程式为
,“焙烧”过程发生反应的化学方程式为(2)“水浸”过程中,为提高浸出速率,可采取的措施有
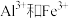 ,“调节pH”过程需要调节pH的范围是
,“调节pH”过程需要调节pH的范围是(3)“沉锂”过程发生反应的化学方程式为
(4)洗涤产品
 需要使用
需要使用(5)某工厂用at锂辉矿(含
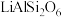 93%)制得bt
93%)制得bt  ,则
,则 的产率为
的产率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】草酸钴晶体难溶于水,可用于指示剂和催化剂的制备等。用含钴废料[主要成分为Co(OH)3,还含有一定量Fe(OH)3、SiO2等杂质]制备草酸钴和钴氧化物流程如下:

(1)为了加快含钴废料酸浸溶解时的速率,可采用的方法是______ (至少两条)。
(2)滤渣1的成分为______ ,Co(OH)3溶解还原反应的离子方程式为______ 。
(3)加入NaClO3发生反应的离子方程式是______ 。
(4)已知NH3·H2O的电离常数为Kb=1.8×10−5;H2C2O4的电离常数为Ka1=5.4×10−2,Ka2=5.4×10−5。则(NH4)2C2O4溶液的pH______ 7(填“>”、“<”或“=”)。
(5)“沉钴”过程的离子方程式为______ 。
(6)在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后剩余固体质量为4.82g,生成CO2的体积为2.688L(标准状况),则钴氧化物的化学式为______ 。

(1)为了加快含钴废料酸浸溶解时的速率,可采用的方法是
(2)滤渣1的成分为
(3)加入NaClO3发生反应的离子方程式是
(4)已知NH3·H2O的电离常数为Kb=1.8×10−5;H2C2O4的电离常数为Ka1=5.4×10−2,Ka2=5.4×10−5。则(NH4)2C2O4溶液的pH
(5)“沉钴”过程的离子方程式为
(6)在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后剩余固体质量为4.82g,生成CO2的体积为2.688L(标准状况),则钴氧化物的化学式为
您最近一年使用:0次
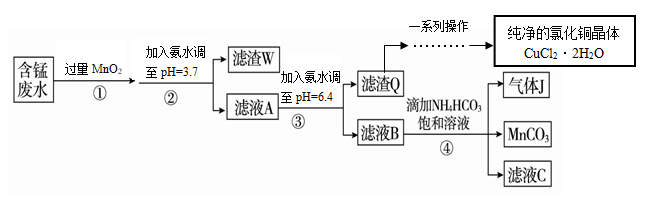
【推荐2】利用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)可制备高性能磁性材料(MnCO3)及纯净的氯化铜晶体(CuCl2•2H2O)。工业流程如图:
已知:几种金属离子沉淀的pH如表:
回答下列问题:
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为__ 。
(2)过程②中,所得滤渣W的成分是__ 。
(3)过程③中,调pH=6.4目的是__ 。
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是__ 。
(5)将滤渣Q溶解在过量的盐酸中,经过__ ,过滤、洗涤、低温烘干,即可获得纯净的氯化铜晶体(CuCl2•2H2O)。
(6)从滤液C可得到的副产品是__ (填化学式)。

已知:几种金属离子沉淀的pH如表:
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
回答下列问题:
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为
(2)过程②中,所得滤渣W的成分是
(3)过程③中,调pH=6.4目的是
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是
(5)将滤渣Q溶解在过量的盐酸中,经过
(6)从滤液C可得到的副产品是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、 和
和 的相互分离。相应的实验过程可用下图表示:
的相互分离。相应的实验过程可用下图表示:
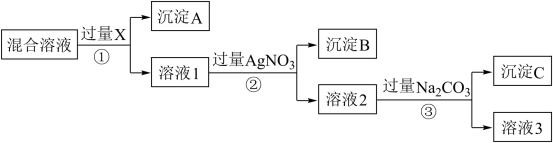
请回答下列问题:
(1)上述实验流程中①②③充分反应后进行物质的分离操作时所需玻璃仪器有____________ ;
(2)上述实验流程中试剂X为____________ ,溶液3所含溶质___________ (均用化学式表示);
(3)上述实验流程中加入过量的Na2CO3的目的是_____________ 。
(4)写出上述流程各步所涉及到的化学方程式:
①____________________ ②_________________
(5)简述检验溶液1中是否含有 实验操作方法
实验操作方法________________ 。
 和
和 的相互分离。相应的实验过程可用下图表示:
的相互分离。相应的实验过程可用下图表示:
请回答下列问题:
(1)上述实验流程中①②③充分反应后进行物质的分离操作时所需玻璃仪器有
(2)上述实验流程中试剂X为
(3)上述实验流程中加入过量的Na2CO3的目的是
(4)写出上述流程各步所涉及到的化学方程式:
①
(5)简述检验溶液1中是否含有
 实验操作方法
实验操作方法
您最近一年使用:0次



