下列实验事实不能证明 是弱酸的是
是弱酸的是
 是弱酸的是
是弱酸的是A.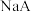 溶液显碱性 溶液显碱性 |
B.常温下,测得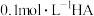 溶液的 溶液的 |
C.等浓度、等体积的 溶液和 溶液和 溶液恰好完全反应 溶液恰好完全反应 |
D.相同条件下,盐酸的导电性比 溶液的强 溶液的强 |
更新时间:2021-03-18 09:29:18
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是
A. 的物质的量 的物质的量 | B.醋酸的电离常数 |
C.中和时所需 的量 的量 | D.加足量锌粉产生氢气的量 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】已知酸性 ,下列有关叙述中正确的是
,下列有关叙述中正确的是
①向 溶液中通入少量二氧化碳的离子反应方程式为
溶液中通入少量二氧化碳的离子反应方程式为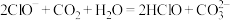
②向 和
和 混合溶液中加入足量
混合溶液中加入足量 溶液,用
溶液,用 萃取后,取上层中的液体少许并加入
萃取后,取上层中的液体少许并加入 溶液,有淡黄色沉淀生成
溶液,有淡黄色沉淀生成
③向 溶液中滴加少量氯水,反应的离子方程式为
溶液中滴加少量氯水,反应的离子方程式为
④“84”消毒液(有效成分 )和“洁厕灵”(主要成分盐酸)混合使用时放出氯气,其离子方程式为
)和“洁厕灵”(主要成分盐酸)混合使用时放出氯气,其离子方程式为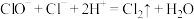
⑤在海带灰的浸出液(含有 )中滴加
)中滴加 得到
得到 ,其离子方程式为
,其离子方程式为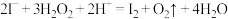
 ,下列有关叙述中正确的是
,下列有关叙述中正确的是①向
 溶液中通入少量二氧化碳的离子反应方程式为
溶液中通入少量二氧化碳的离子反应方程式为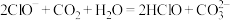
②向
 和
和 混合溶液中加入足量
混合溶液中加入足量 溶液,用
溶液,用 萃取后,取上层中的液体少许并加入
萃取后,取上层中的液体少许并加入 溶液,有淡黄色沉淀生成
溶液,有淡黄色沉淀生成③向
 溶液中滴加少量氯水,反应的离子方程式为
溶液中滴加少量氯水,反应的离子方程式为
④“84”消毒液(有效成分
 )和“洁厕灵”(主要成分盐酸)混合使用时放出氯气,其离子方程式为
)和“洁厕灵”(主要成分盐酸)混合使用时放出氯气,其离子方程式为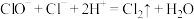
⑤在海带灰的浸出液(含有
 )中滴加
)中滴加 得到
得到 ,其离子方程式为
,其离子方程式为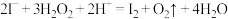
| A.②④ | B.①③⑤ | C.②③ | D.①④⑤ |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】下列有关 的说法中错误的是
的说法中错误的是
 的说法中错误的是
的说法中错误的是A. 溶液中: 溶液中: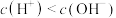 |
B. 溶液中: 溶液中: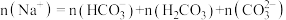 |
C.苏打是 的俗称,可用于食品加工 的俗称,可用于食品加工 |
D.加热滴加有酚酞的 溶液时,溶液颜色会加深 溶液时,溶液颜色会加深 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】某二元酸(化学式用H2A表示)在水中的电离方程式是H2A =H++HA- HA- H++A2-,则NaHA的水溶液显
H++A2-,则NaHA的水溶液显
 H++A2-,则NaHA的水溶液显
H++A2-,则NaHA的水溶液显| A.酸性 | B.碱性 | C.中性 | D.无法确定 |
您最近一年使用:0次




