以铁、磷酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]。
(1)磷酸根离子的空间构型为_______ ,其中P的价层电子对数为_______
(2)NH3分子中氮原子的轨道杂化类型是_______ ;C、N、O元素的第一电离能由大到小的顺序为_______ 。
(3)基态Fe2+与Fe3+离子中未成对的电子数之比为_______ 。 中与Fe2+配位的原子是
中与Fe2+配位的原子是_______ (填元素符号)。
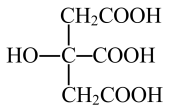
(4)柠檬酸的结构简式如图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为_______ mol。柠檬酸含有的官能团有(写名称)_______ 和_______
(1)磷酸根离子的空间构型为
(2)NH3分子中氮原子的轨道杂化类型是
(3)基态Fe2+与Fe3+离子中未成对的电子数之比为
 中与Fe2+配位的原子是
中与Fe2+配位的原子是(4)柠檬酸的结构简式如图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为

20-21高二下·辽宁大连·阶段练习 查看更多[2]
辽宁省大连市普兰店区第二中学2020-2021学年高二4月阶段性测试化学试题(已下线)3.4 配合物与超分子(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)
更新时间:2021-04-12 14:50:53
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】钛的化合物在化工、医药、材料等领域具有广泛应用。回答下列问题:
(1)基态Ti原子的未成对电子数是______ ,基态Ti原子4s轨道上的一个电子激发到 4p轨道上形成激发态,写出该激发态价层电子排布式______ 。
(2)钛卤化物的熔点和沸点如下表所示,TiCl4、TiBr4、TiI4 熔沸点依次升高的原因是______ ;TiF4熔点反常的原因是______ 。
Ti可形成配合物[Ti(urea)6](ClO4)3, urea表示尿素,其结构如图所示:

(3)配合物中Ti化合价为______ 。
(4)尿素中C原子的杂化轨道类型为______ 。
(5) ClO 的立体构型为
的立体构型为______ 。
(6)如图为具有较高催化活性材料金红石的晶胞结构,其化学式为______ 。

(1)基态Ti原子的未成对电子数是
(2)钛卤化物的熔点和沸点如下表所示,TiCl4、TiBr4、TiI4 熔沸点依次升高的原因是
TiF4 | TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | 377 | -24 | 38 | 150 |
沸点/℃ | —— | 136 | 230 | 377 |

(3)配合物中Ti化合价为
(4)尿素中C原子的杂化轨道类型为
(5) ClO
 的立体构型为
的立体构型为(6)如图为具有较高催化活性材料金红石的晶胞结构,其化学式为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1) 的价电子排布图为:
的价电子排布图为:__ ;基态磷原子有___ 种空间运动状态不同的电子。
(2)Li、O、P三种元素的电负性由大到小的顺序是:__ 。
(3)写出一种与 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:__ ,该分子的中心原子的价层电子对数等于__ 。
(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:__ 。
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)N和P是同主族元素,但是 分子中的键角大于
分子中的键角大于 分子中的键角,原因是:
分子中的键角,原因是:___ 。
(6) 为离子晶体,具有反萤石结构,晶胞如下图所示。则
为离子晶体,具有反萤石结构,晶胞如下图所示。则 配位数为:
配位数为:__ ,若晶胞参数为bnm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为__  (列出计算式即可)。
(列出计算式即可)。

(1)
 的价电子排布图为:
的价电子排布图为:(2)Li、O、P三种元素的电负性由大到小的顺序是:
(3)写出一种与
 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)N和P是同主族元素,但是
 分子中的键角大于
分子中的键角大于 分子中的键角,原因是:
分子中的键角,原因是:(6)
 为离子晶体,具有反萤石结构,晶胞如下图所示。则
为离子晶体,具有反萤石结构,晶胞如下图所示。则 配位数为:
配位数为: ,则
,则 的密度为
的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】锌在工业中有重要作用,也是人体必需的微量元素。
(1)基态 原子的价电子轨道表示式为
原子的价电子轨道表示式为_______ 。
(2)锌离子的一种配合物为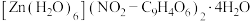 ,其阴离子的结构如下:
,其阴离子的结构如下:
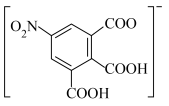
①该配合物中 的配位数是
的配位数是_______ ;由_______ (填名称,下同)分子中的_______ 原子提供孤电子对形成配位键。
②阴离子中碳原子的杂化轨道类型是_______ 。
(3)一种硫化锌的晶胞结构如图1所示,从晶胞上底面向下底面的俯视图如图2所示。
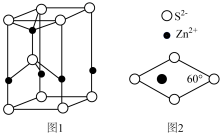
①该晶胞中含_______ 个 。
。
②已知该晶体的密度为 ,晶胞底面边长为
,晶胞底面边长为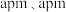 ,用
,用 表示阿伏加德罗常数的值,则该晶胞的高为
表示阿伏加德罗常数的值,则该晶胞的高为_______  (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(1)基态
 原子的价电子轨道表示式为
原子的价电子轨道表示式为(2)锌离子的一种配合物为
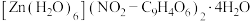 ,其阴离子的结构如下:
,其阴离子的结构如下:
①该配合物中
 的配位数是
的配位数是②阴离子中碳原子的杂化轨道类型是
(3)一种硫化锌的晶胞结构如图1所示,从晶胞上底面向下底面的俯视图如图2所示。

①该晶胞中含
 。
。②已知该晶体的密度为
 ,晶胞底面边长为
,晶胞底面边长为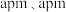 ,用
,用 表示阿伏加德罗常数的值,则该晶胞的高为
表示阿伏加德罗常数的值,则该晶胞的高为 (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】以CuSO4、NaOH和抗坏血酸为原料,可制备Cu₂O。_____ 。
(2) 的空间构型为
的空间构型为_____ (用文字描述);Cu2+与OH−反应能生成[Cu(OH)4]2−,[Cu(OH)4]2−中的配位原子为_____ (填元素符号)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为_____ ;推测抗坏血酸在水中的溶解性:_____ (填“难溶于水”或“易溶于水”)。
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为_____ 。


(2)
 的空间构型为
的空间构型为(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐2】硫酸镍溶于氨水形成 蓝色溶液。
蓝色溶液。
(1) 中阴离子的空间结构是
中阴离子的空间结构是_______ 。
(2)在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为_______ ,提供孤电子对的成键原子是_______ 。
(3)向盛有少量氯化钠溶液的试管中滴入少量硝酸银溶液,再加入氨水。
①上述实验过程中观察到的现象是_______ 。
②用平衡移动的理论解释加入氨水后,现象发生变化的原因是_______ 。
 蓝色溶液。
蓝色溶液。(1)
 中阴离子的空间结构是
中阴离子的空间结构是(2)在
 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为(3)向盛有少量氯化钠溶液的试管中滴入少量硝酸银溶液,再加入氨水。
①上述实验过程中观察到的现象是
②用平衡移动的理论解释加入氨水后,现象发生变化的原因是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐3】氢能是一种极具发展潜力的清洁能源,下列物质是具有广阔应用前景的储氢材料。
(1)氢化钠(NaH)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的化学方程式为___________ 。
(2) (氨硼烷)具有很高的储氢容量及相对低的放氢温度,是颇具潜力的储氢材料,它可通过环硼氮烷、
(氨硼烷)具有很高的储氢容量及相对低的放氢温度,是颇具潜力的储氢材料,它可通过环硼氮烷、 与
与 进行合成。
进行合成。
① 中涉及的元素H、B、N电负性最大的是
中涉及的元素H、B、N电负性最大的是___________ (填元素符号,下同);根据对角线规则,B的一些化学性质与元素___________ 相似。
② 分子中存在配位键,
分子中存在配位键,___________ 原子提供空轨道,___________ 原子提供孤对电子。
③键角:
___________  (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是___________ 。
(3)某种新型储氢材料的晶胞如图。

①该物质摩尔质量为188g/mol,其化学式为___________ 。
②该化合物中M离子的价电子排布图为___________ 。
③该晶体密度为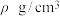 ,晶胞的边长为
,晶胞的边长为___________ nm。
(1)氢化钠(NaH)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的化学方程式为
(2)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度,是颇具潜力的储氢材料,它可通过环硼氮烷、
(氨硼烷)具有很高的储氢容量及相对低的放氢温度,是颇具潜力的储氢材料,它可通过环硼氮烷、 与
与 进行合成。
进行合成。①
 中涉及的元素H、B、N电负性最大的是
中涉及的元素H、B、N电负性最大的是②
 分子中存在配位键,
分子中存在配位键,③键角:

 (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是(3)某种新型储氢材料的晶胞如图。

①该物质摩尔质量为188g/mol,其化学式为
②该化合物中M离子的价电子排布图为
③该晶体密度为
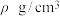 ,晶胞的边长为
,晶胞的边长为
您最近一年使用:0次



