研究大气中含硫化合物(主要是 和
和 )的转化率具有重要意义。
)的转化率具有重要意义。
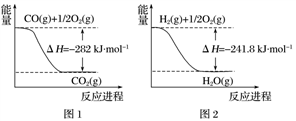
(1)土壤中的微生物可将大气中的 经两步反应氧化成
经两步反应氧化成 ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
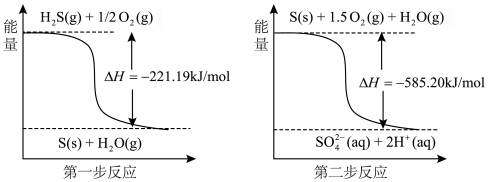
 全部氧化成
全部氧化成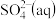 的热化学方程式为
的热化学方程式为___________ 。
(2) 是工业制硫酸的原料气体之一,一定温度下,向容积为
是工业制硫酸的原料气体之一,一定温度下,向容积为 的密闭容器中充入一定量的
的密闭容器中充入一定量的 和
和 ,发生反应:
,发生反应: ,过程中测定的部分数据见表:
,过程中测定的部分数据见表:
①反应在 内的平均速率为
内的平均速率为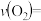
___________ ;
②此温度下该反应的化学平衡常数K=___________ ;
③研究表明, 催化氧化的反应速率方程为:
催化氧化的反应速率方程为: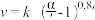 。式中:k为反应速率常数,随温度t升高而增大;
。式中:k为反应速率常数,随温度t升高而增大; 为
为 平衡转化率,
平衡转化率,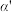 为某时刻
为某时刻 转化率,n为常数。在
转化率,n为常数。在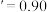 时,将一系列温度下的k、
时,将一系列温度下的k、 值代入上述速率方程,得到v~t曲线如图所示。
值代入上述速率方程,得到v~t曲线如图所示。
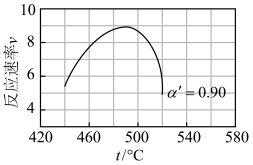
曲线上v最大值所对应温度称为该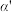 下反应的最适宜温度
下反应的最适宜温度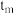 。下列说法正确的是
。下列说法正确的是___________ 。
A.v达到最大值时, 平衡转化率
平衡转化率 最大
最大
B.温度是影响反应速率的主要因素,温度越高,反应速率越快
C.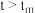 后,v逐渐下降,原因是升高温度,
后,v逐渐下降,原因是升高温度, 逐渐降低
逐渐降低
D.t<tm时,v逐渐提高,原因是升高温度,k逐渐增大
(3)一般来说,如果一个反应的平衡常数大于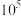 ,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于
,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于 ,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数:
,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数:
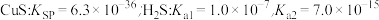 ,
,
计算反应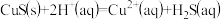 反应的平衡常数
反应的平衡常数
___________ 。
(4)工业上常用 与碳酸钠溶液的反应制备焦亚硫酸钠(
与碳酸钠溶液的反应制备焦亚硫酸钠( ),
), 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中 残留量时,取
残留量时,取 葡萄酒样品,用
葡萄酒样品,用 的碘标准液滴定至终点,消耗碘标准液
的碘标准液滴定至终点,消耗碘标准液 。滴定反应的离子方程式为
。滴定反应的离子方程式为___________ ,该样品中 的残留量为
的残留量为___________ 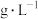 (以
(以 计,保留三位有效数字)。
计,保留三位有效数字)。
 和
和 )的转化率具有重要意义。
)的转化率具有重要意义。(1)土壤中的微生物可将大气中的
 经两步反应氧化成
经两步反应氧化成 ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
 全部氧化成
全部氧化成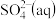 的热化学方程式为
的热化学方程式为(2)
 是工业制硫酸的原料气体之一,一定温度下,向容积为
是工业制硫酸的原料气体之一,一定温度下,向容积为 的密闭容器中充入一定量的
的密闭容器中充入一定量的 和
和 ,发生反应:
,发生反应: ,过程中测定的部分数据见表:
,过程中测定的部分数据见表:时间/ | 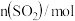 | 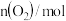 |
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | 0.020 |
①反应在
 内的平均速率为
内的平均速率为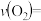
②此温度下该反应的化学平衡常数K=
③研究表明,
 催化氧化的反应速率方程为:
催化氧化的反应速率方程为: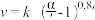 。式中:k为反应速率常数,随温度t升高而增大;
。式中:k为反应速率常数,随温度t升高而增大; 为
为 平衡转化率,
平衡转化率,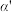 为某时刻
为某时刻 转化率,n为常数。在
转化率,n为常数。在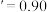 时,将一系列温度下的k、
时,将一系列温度下的k、 值代入上述速率方程,得到v~t曲线如图所示。
值代入上述速率方程,得到v~t曲线如图所示。
曲线上v最大值所对应温度称为该
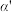 下反应的最适宜温度
下反应的最适宜温度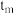 。下列说法正确的是
。下列说法正确的是A.v达到最大值时,
 平衡转化率
平衡转化率 最大
最大B.温度是影响反应速率的主要因素,温度越高,反应速率越快
C.
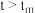 后,v逐渐下降,原因是升高温度,
后,v逐渐下降,原因是升高温度, 逐渐降低
逐渐降低D.t<tm时,v逐渐提高,原因是升高温度,k逐渐增大
(3)一般来说,如果一个反应的平衡常数大于
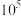 ,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于
,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于 ,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数:
,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数: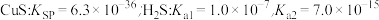 ,
,计算反应
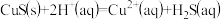 反应的平衡常数
反应的平衡常数
(4)工业上常用
 与碳酸钠溶液的反应制备焦亚硫酸钠(
与碳酸钠溶液的反应制备焦亚硫酸钠( ),
), 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中 残留量时,取
残留量时,取 葡萄酒样品,用
葡萄酒样品,用 的碘标准液滴定至终点,消耗碘标准液
的碘标准液滴定至终点,消耗碘标准液 。滴定反应的离子方程式为
。滴定反应的离子方程式为 的残留量为
的残留量为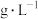 (以
(以 计,保留三位有效数字)。
计,保留三位有效数字)。
更新时间:2021-04-16 13:59:24
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As是33号元素,则其在周期表中的位置是________________ 。
(2)N元素非金属性比As强,下列说法正确的是_________________________ 。
①NH3的热稳定性比AsH3差 ②HNO3的酸性比H3AsO4强 ③N的原子半径比As的原子半径小
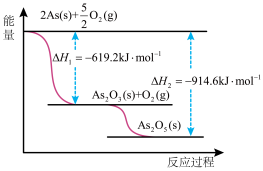
(3)根据下图写出As2O5分解为As2O3的热化学方程式 __________________ 。
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:

①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应______ (填“是”或“不是”)氧化还原反应。
②过程Ⅲ的系列操作包括________________________________________________ 。
③写出过程Ⅲ的离子方程式__________________________________________________ ,过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因______________________________ 。
(1)As是33号元素,则其在周期表中的位置是
(2)N元素非金属性比As强,下列说法正确的是
①NH3的热稳定性比AsH3差 ②HNO3的酸性比H3AsO4强 ③N的原子半径比As的原子半径小
(3)根据下图写出As2O5分解为As2O3的

(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:

①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应
②过程Ⅲ的系列操作包括
③写出过程Ⅲ的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为____________ (答出一条即可)。
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ),其中
),其中 元素的化合价为
元素的化合价为______ 。
(3)已知: 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素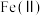 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ ;再加入石灰乳,所得滤渣中主要成分是 、
、______ 。
②通入混合气中 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是____________ ; 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是____________ 。 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成
 沉淀的离子方程式:
沉淀的离子方程式:______ 。
②若“镍钴分离”后溶液中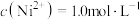 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中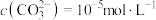 ,则沉镍率=
,则沉镍率=______ 。[已知: ,沉镍率=
,沉镍率=
 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。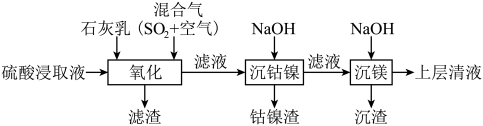
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(
 ),其中
),其中 元素的化合价为
元素的化合价为(3)已知:
 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素
 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、②通入混合气中
 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是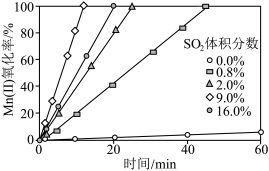
 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成 沉淀的离子方程式:
沉淀的离子方程式:②若“镍钴分离”后溶液中
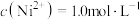 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中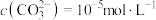 ,则沉镍率=
,则沉镍率= ,沉镍率=
,沉镍率=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
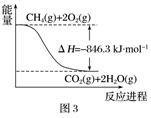
【推荐3】 是重要的基本有机原料。
是重要的基本有机原料。
Ⅰ.利用反应A可将 转化为
转化为 。
。
反应A: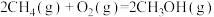

(1)已知:破坏1mol化学键所需要的能量如下表所示。

_______  。
。
(2)一定条件下将 与
与 直接混合实现反应A,往往产生
直接混合实现反应A,往往产生 等副产物。我国科研工作者利用
等副产物。我国科研工作者利用 实现
实现 的选择性氯化,使
的选择性氯化,使 转化为
转化为 ,并进一步水解得到
,并进一步水解得到 ,流程示意如下。
,流程示意如下。
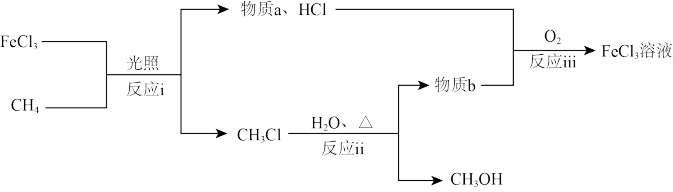
①反应i的化学方程式是_______ 。
②由 溶液结晶得到
溶液结晶得到 晶体,在HCl的气流中加热
晶体,在HCl的气流中加热 晶体,能得到无水
晶体,能得到无水 ,实现物质的循环利用。结合平衡移动原理解释HCl的作用:
,实现物质的循环利用。结合平衡移动原理解释HCl的作用:_______ 。
Ⅱ.以 为原料合成甲醇可以减少
为原料合成甲醇可以减少 的排放,实现碳的循环利用。
的排放,实现碳的循环利用。
一定条件下使 、
、 混合气体通过反应器,检测反应器出口气体的成分及其含量,计算
混合气体通过反应器,检测反应器出口气体的成分及其含量,计算 的转化率和
的转化率和 的选择性以评价催化剂的性能。
的选择性以评价催化剂的性能。
已知:i.反应器内发生的反应有:
a.
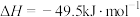
b.
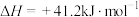
ii. 选择性
选择性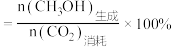
iii.其他条件相同时,反应温度对 的转化率和
的转化率和 的选择性的影响如下图所示;
的选择性的影响如下图所示;

(3)由图1可知实验中反应均未达到化学平衡状态的依据是_______ 。
(4)温度高于260℃时, 平衡转化率变化的原因是
平衡转化率变化的原因是_______ 。
(5)温度相同时, 选择性的实验值略高于其平衡值(见图2),从化学反应速率的角度解释原因:
选择性的实验值略高于其平衡值(见图2),从化学反应速率的角度解释原因:_______ 。
 是重要的基本有机原料。
是重要的基本有机原料。Ⅰ.利用反应A可将
 转化为
转化为 。
。反应A:
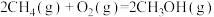

(1)已知:破坏1mol化学键所需要的能量如下表所示。
| 化学键 | C-H |  | O-H | C-O |
| 能量/kJ | a | b | c | d |

 。
。(2)一定条件下将
 与
与 直接混合实现反应A,往往产生
直接混合实现反应A,往往产生 等副产物。我国科研工作者利用
等副产物。我国科研工作者利用 实现
实现 的选择性氯化,使
的选择性氯化,使 转化为
转化为 ,并进一步水解得到
,并进一步水解得到 ,流程示意如下。
,流程示意如下。
①反应i的化学方程式是
②由
 溶液结晶得到
溶液结晶得到 晶体,在HCl的气流中加热
晶体,在HCl的气流中加热 晶体,能得到无水
晶体,能得到无水 ,实现物质的循环利用。结合平衡移动原理解释HCl的作用:
,实现物质的循环利用。结合平衡移动原理解释HCl的作用:Ⅱ.以
 为原料合成甲醇可以减少
为原料合成甲醇可以减少 的排放,实现碳的循环利用。
的排放,实现碳的循环利用。一定条件下使
 、
、 混合气体通过反应器,检测反应器出口气体的成分及其含量,计算
混合气体通过反应器,检测反应器出口气体的成分及其含量,计算 的转化率和
的转化率和 的选择性以评价催化剂的性能。
的选择性以评价催化剂的性能。已知:i.反应器内发生的反应有:
a.

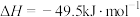
b.

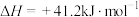
ii.
 选择性
选择性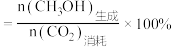
iii.其他条件相同时,反应温度对
 的转化率和
的转化率和 的选择性的影响如下图所示;
的选择性的影响如下图所示;
(3)由图1可知实验中反应均未达到化学平衡状态的依据是
(4)温度高于260℃时,
 平衡转化率变化的原因是
平衡转化率变化的原因是(5)温度相同时,
 选择性的实验值略高于其平衡值(见图2),从化学反应速率的角度解释原因:
选择性的实验值略高于其平衡值(见图2),从化学反应速率的角度解释原因:
您最近一年使用:0次
【推荐1】氮及其化合物在生活和生产中应用广泛。
(1)合成氨用的H2可以CH4为原料制得。有关化学反应的能量变化如下图所示。则CH4(g) 与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为________________________________________________ 。
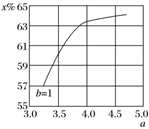
(2)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(
CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率( x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。
x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。_______ 。
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业生产NaN3主要是在175 ℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式:__________________ 。
(4)叠氮酸(HN3)是一种 一元弱酸,在水溶液中存在:HN
一元弱酸,在水溶液中存在:HN 3
3 H++N
H++N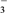 ,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=
,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=____________ (用含字母的代数式表示,忽略溶液体积变化)。
(5)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO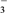 可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为
可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为_____________________________________________________________ 。
(1)合成氨用的H2可以CH4为原料制得。有关化学反应的能量变化如下图所示。则CH4(g) 与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为


(2)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(
CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率( x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。
x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业生产NaN3主要是在175 ℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式:
(4)叠氮酸(HN3)是一种
 一元弱酸,在水溶液中存在:HN
一元弱酸,在水溶液中存在:HN 3
3 H++N
H++N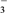 ,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=
,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=(5)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO
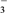 可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为
可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】近年,甲醇的制取与应用在全球引发了关于“甲醇经济”的广泛探讨。
 .在
.在 催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:
反应a:

反应b:
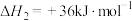
反应c: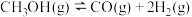

(1)已知反应b中相关化学键键能数据如下表:
计算:x=___________  ,
,
___________  。
。
(2)恒温恒容时,下列能说明反应a一定达到平衡状态的是___________(填标号)。
(3)在催化剂作用下,将物质的量之比为1:2的 和
和 的混合气体充入一恒容密闭容器中发生反应a、b,已知反应b的反应速率
的混合气体充入一恒容密闭容器中发生反应a、b,已知反应b的反应速率 ,
,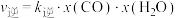 ,
, 、
、 为速率常数,x为物质的量分数。
为速率常数,x为物质的量分数。
①平衡时, 转化率为60%,
转化率为60%, 和
和 的物质的量之比为1:1,若反应b的
的物质的量之比为1:1,若反应b的 ,则平衡
,则平衡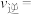
___________  。
。
②Arrhenius经验公式为 ,其中
,其中 为活化能,T为热力学温度,k为速率常数,R和C为常数,则
为活化能,T为热力学温度,k为速率常数,R和C为常数,则
___________  (用含
(用含 、
、 、T、R的代数式表示)。
、T、R的代数式表示)。
(4)其他条件相同时,反应温度对 选择性的影响如下图所示。由图可知,温度相同时
选择性的影响如下图所示。由图可知,温度相同时 选择性的实验值略高于其平衡值,可能的原因是
选择性的实验值略高于其平衡值,可能的原因是___________ 。(已知 的选择性
的选择性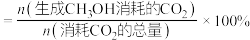 )
) .利用甲醇分解制取烯烃,涉及如下反应:
.利用甲醇分解制取烯烃,涉及如下反应:
a.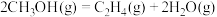
b.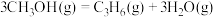
c.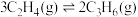
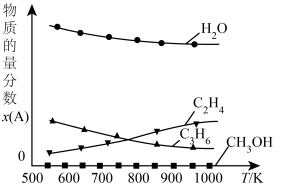
(5)恒压条件下,平衡体系中各物质的量分数随温度变化如图所示。已知650K时, ,平衡体系总压强为p,则650K反应c的平衡常数
,平衡体系总压强为p,则650K反应c的平衡常数
___________ 。
 .在
.在 催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:反应a:


反应b:

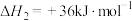
反应c:
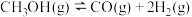

(1)已知反应b中相关化学键键能数据如下表:
| 化学键 | H-H | C=O | C≡O | H-O |
 | x | 803 | 1076 | 465 |
 ,
,
 。
。(2)恒温恒容时,下列能说明反应a一定达到平衡状态的是___________(填标号)。
A. |
B. |
| C.混合气体的密度不再发生变化 |
D.混合气体中 的百分含量保持不变 的百分含量保持不变 |
 和
和 的混合气体充入一恒容密闭容器中发生反应a、b,已知反应b的反应速率
的混合气体充入一恒容密闭容器中发生反应a、b,已知反应b的反应速率 ,
,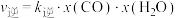 ,
, 、
、 为速率常数,x为物质的量分数。
为速率常数,x为物质的量分数。①平衡时,
 转化率为60%,
转化率为60%, 和
和 的物质的量之比为1:1,若反应b的
的物质的量之比为1:1,若反应b的 ,则平衡
,则平衡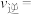
 。
。②Arrhenius经验公式为
 ,其中
,其中 为活化能,T为热力学温度,k为速率常数,R和C为常数,则
为活化能,T为热力学温度,k为速率常数,R和C为常数,则
 (用含
(用含 、
、 、T、R的代数式表示)。
、T、R的代数式表示)。(4)其他条件相同时,反应温度对
 选择性的影响如下图所示。由图可知,温度相同时
选择性的影响如下图所示。由图可知,温度相同时 选择性的实验值略高于其平衡值,可能的原因是
选择性的实验值略高于其平衡值,可能的原因是 的选择性
的选择性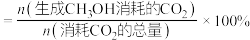 )
)
 .利用甲醇分解制取烯烃,涉及如下反应:
.利用甲醇分解制取烯烃,涉及如下反应:a.
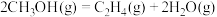
b.
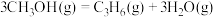
c.
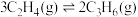
(5)恒压条件下,平衡体系中各物质的量分数随温度变化如图所示。已知650K时,
 ,平衡体系总压强为p,则650K反应c的平衡常数
,平衡体系总压强为p,则650K反应c的平衡常数
您最近一年使用:0次
【推荐3】二甲醚(CH3OCH3)是重要的能源物质,其制备、应用与转化是研究的热点。
(1) 利用合成气制备二甲醚主要包含三个反应:
CO(g)+2H2(g)=CH3OH(g);ΔH=-90.4 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g);ΔH=-23.4 kJ·mol-1
CO(g) +H2O(g)=H2(g)+CO2(g);ΔH=-41.0 kJ·mol-1
则3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);ΔH=________ 。
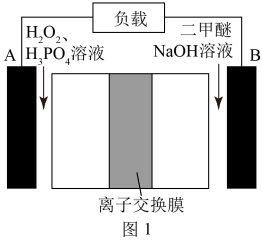
(2) 某二甲醚/双氧水燃料电池的工作原理如图1所示。电池工作时,电极A附近溶液pH________ (填“减小”“增大”或“不变”);电极B的电极反应式为_____________ 。
(3) 二甲醚催化羰化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g)=CH3COOCH3(g);ΔH1
反应Ⅱ:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g);ΔH2
反应Ⅰ、Ⅱ的平衡常数的对数lg K1、lg K2与温度的关系如图2所示;在固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图3所示。
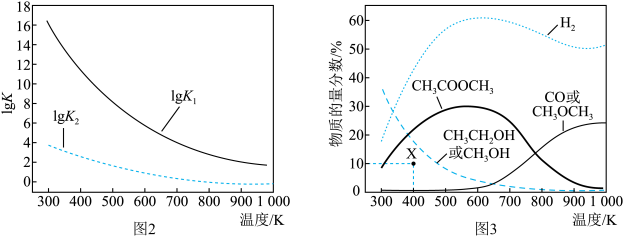
① ΔH1________ (填“>”“<”或“=”)0。
②300~400 K时,CH3CH2OH物质的量分数随温度升高而降低的原因是________ 。
③ 600~700 K时,CH3COOCH3物质的量分数随温度升高而降低的原因是________ 。
④ 400 K时,在催化剂作用下,反应一段时间后,测得CH3CH2OH物质的量分数为10%(图3中X点)。不改变原料比、温度和压强,一定能提高CH3CH2OH物质的量分数的措施有________________________ 。
(1) 利用合成气制备二甲醚主要包含三个反应:
CO(g)+2H2(g)=CH3OH(g);ΔH=-90.4 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g);ΔH=-23.4 kJ·mol-1
CO(g) +H2O(g)=H2(g)+CO2(g);ΔH=-41.0 kJ·mol-1
则3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);ΔH=
(2) 某二甲醚/双氧水燃料电池的工作原理如图1所示。电池工作时,电极A附近溶液pH

(3) 二甲醚催化羰化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g)=CH3COOCH3(g);ΔH1
反应Ⅱ:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g);ΔH2
反应Ⅰ、Ⅱ的平衡常数的对数lg K1、lg K2与温度的关系如图2所示;在固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图3所示。

① ΔH1
②300~400 K时,CH3CH2OH物质的量分数随温度升高而降低的原因是
③ 600~700 K时,CH3COOCH3物质的量分数随温度升高而降低的原因是
④ 400 K时,在催化剂作用下,反应一段时间后,测得CH3CH2OH物质的量分数为10%(图3中X点)。不改变原料比、温度和压强,一定能提高CH3CH2OH物质的量分数的措施有
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】研究氨的合成和分解对工业生产和防治污染有重要意义,回答下列问题:
(1)化学键键能数据如下:
氨分解反应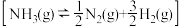 的活化能
的活化能 ,由此计算合成氨反应
,由此计算合成氨反应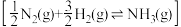 的活化能
的活化能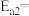
_______  。
。
(2)在Fe催化剂作用下由氮气和氢气直接合成氨的反应历程为(*表示吸附态):化学吸附: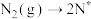 ;
;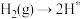 ;表面反应:
;表面反应: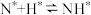 ;
; ;
; ;脱附:
;脱附: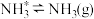 ;其中,
;其中, 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中 和
和 物质的量之比为
物质的量之比为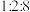 。从速率和转化率角度说明原料气中
。从速率和转化率角度说明原料气中 适度过量的理由:
适度过量的理由:
①速率角度:_______ ;
②转化率角度:_______ 。
(3)已知反应: 标准平衡常数
标准平衡常数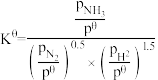 ,其中
,其中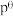 为标准压强(
为标准压强(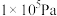 ),
),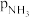 、
、 和
和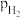 为各组分的平衡分压,如:
为各组分的平衡分压,如: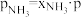 ,p为平衡总压,
,p为平衡总压,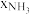 为平衡系统中
为平衡系统中 的物质的量分数。若
的物质的量分数。若 和
和 起始物质的量之比为
起始物质的量之比为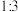 ,反应在恒定温度和标准压强下进行,
,反应在恒定温度和标准压强下进行, 的平衡转化率为
的平衡转化率为 ,则
,则
_______ (用含 的最简式表示)
的最简式表示)
(4)氨催化分解既可防治氨气污染,又能得到氢能源。在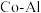 催化剂体系中,压强
催化剂体系中,压强 下氨气以一定流速通过反应器得到不同催化剂下相同时间内
下氨气以一定流速通过反应器得到不同催化剂下相同时间内 转化率随温度变化的关系如图所示。
转化率随温度变化的关系如图所示。

使活化能最小的催化剂为_______ ;温度一定时,如果增大气体流速,则b点对应的点可能是____ (填“a”“c”“d”“e”或“f”)。
(1)化学键键能数据如下:
| 化学键 | H—H | N≡N | N—H |
 | 436 | 946 | 391 |
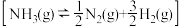 的活化能
的活化能 ,由此计算合成氨反应
,由此计算合成氨反应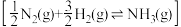 的活化能
的活化能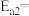
 。
。(2)在Fe催化剂作用下由氮气和氢气直接合成氨的反应历程为(*表示吸附态):化学吸附:
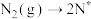 ;
;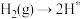 ;表面反应:
;表面反应: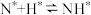 ;
; ;
; ;脱附:
;脱附: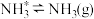 ;其中,
;其中, 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中 和
和 物质的量之比为
物质的量之比为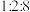 。从速率和转化率角度说明原料气中
。从速率和转化率角度说明原料气中 适度过量的理由:
适度过量的理由:①速率角度:
②转化率角度:
(3)已知反应:
 标准平衡常数
标准平衡常数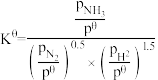 ,其中
,其中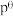 为标准压强(
为标准压强(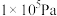 ),
),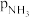 、
、 和
和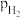 为各组分的平衡分压,如:
为各组分的平衡分压,如: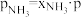 ,p为平衡总压,
,p为平衡总压,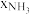 为平衡系统中
为平衡系统中 的物质的量分数。若
的物质的量分数。若 和
和 起始物质的量之比为
起始物质的量之比为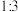 ,反应在恒定温度和标准压强下进行,
,反应在恒定温度和标准压强下进行, 的平衡转化率为
的平衡转化率为 ,则
,则
 的最简式表示)
的最简式表示)(4)氨催化分解既可防治氨气污染,又能得到氢能源。在
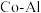 催化剂体系中,压强
催化剂体系中,压强 下氨气以一定流速通过反应器得到不同催化剂下相同时间内
下氨气以一定流速通过反应器得到不同催化剂下相同时间内 转化率随温度变化的关系如图所示。
转化率随温度变化的关系如图所示。
使活化能最小的催化剂为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】甲烷的直接转化具有较高的经济价值,因此备受科学家关注。回答下列问题:
(1)用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
I.CH4(g)+ O2(g)
O2(g) CH3OH(g) △H1=-126.4kJ•mol-1
CH3OH(g) △H1=-126.4kJ•mol-1
II.CH4(g)+H2O(g) CH3OH(g)+H2(g) △H2
CH3OH(g)+H2(g) △H2
已知:H2的标准燃烧热为285.8kJ/mol;H2O(l)=H2O(g) △H=+44kJ•mol-1。计算△H2=______ kJ/mol。
(2)若采用方法I生产甲醇。在200℃下,向恒容为5L的密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,体系的总压强随时间的变化如图所示。

①下列措施可提高CH4的平衡转化率的是______ (填标号)。
A.升高温度 B.初始总压强不变,提高CH4的分压
C.投料比不变,增大反应物浓度 D.反应达到平衡后,再充入一定量He
②在200℃下,方法I的标准压力平衡常数K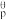 =
=______ (可保留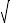 )。
)。
已知:2A(g) B(g)的标准平衡常数K
B(g)的标准平衡常数K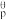 =
=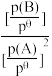 ,其中pθ为标准压强(100kPa),p(A)和p(B)为平衡分压(某成分的物质的量分数×总压)。
,其中pθ为标准压强(100kPa),p(A)和p(B)为平衡分压(某成分的物质的量分数×总压)。
③若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率将______ (填:变大、变小或不变)。
(3)为提高生产效率,利用方法II进行连续生产时采用如图所示的步骤控制体系温度和通入气体(各阶段气体流速相同)。已知大多数气体分子在催化剂表面的吸附过程是放热的,He不会在催化剂表面吸附,吸附和解吸不会导致体系温度的变化。

①通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是______ 。
②从反应速率的角度分析,通入CH4后维持200℃的原因______ (不考虑催化剂失活)。
(1)用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
I.CH4(g)+
 O2(g)
O2(g) CH3OH(g) △H1=-126.4kJ•mol-1
CH3OH(g) △H1=-126.4kJ•mol-1II.CH4(g)+H2O(g)
 CH3OH(g)+H2(g) △H2
CH3OH(g)+H2(g) △H2已知:H2的标准燃烧热为285.8kJ/mol;H2O(l)=H2O(g) △H=+44kJ•mol-1。计算△H2=
(2)若采用方法I生产甲醇。在200℃下,向恒容为5L的密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,体系的总压强随时间的变化如图所示。

①下列措施可提高CH4的平衡转化率的是
A.升高温度 B.初始总压强不变,提高CH4的分压
C.投料比不变,增大反应物浓度 D.反应达到平衡后,再充入一定量He
②在200℃下,方法I的标准压力平衡常数K
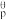 =
=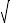 )。
)。已知:2A(g)
 B(g)的标准平衡常数K
B(g)的标准平衡常数K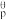 =
=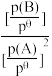 ,其中pθ为标准压强(100kPa),p(A)和p(B)为平衡分压(某成分的物质的量分数×总压)。
,其中pθ为标准压强(100kPa),p(A)和p(B)为平衡分压(某成分的物质的量分数×总压)。③若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率将
(3)为提高生产效率,利用方法II进行连续生产时采用如图所示的步骤控制体系温度和通入气体(各阶段气体流速相同)。已知大多数气体分子在催化剂表面的吸附过程是放热的,He不会在催化剂表面吸附,吸附和解吸不会导致体系温度的变化。

①通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是
②从反应速率的角度分析,通入CH4后维持200℃的原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】苯乙烯是生产塑料和合成橡胶的重要有机原料,乙苯催化脱氢制备苯乙烯是目前生产苯乙烯的主要方法,反应如下: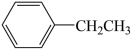 (g)
(g) 
 (g) +H2(g)
(g) +H2(g)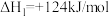 。
。
(1)工业上,通常在乙苯蒸气中掺混水蒸气,反应温度维持在600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了 以外的产物中苯乙烯的物质的量分数)示意图如下:
以外的产物中苯乙烯的物质的量分数)示意图如下:

①一般控制原料气中水油比n(水):n(乙苯)为9∶1,若水油比增大,乙苯的平衡转化率______ (填“增大”或“减小”),理由是________________________ 。
②控制反应温度为600℃的理由是________________________ 。
(2)某研究机构用 代替水蒸气开发了绿色化学合成工艺。反应方程式为:
代替水蒸气开发了绿色化学合成工艺。反应方程式为: (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g)
(g)+CO(g)+H2O(g) 。反应历程如图:
。反应历程如图:

①已知: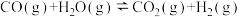
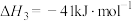 。则
。则
______  。
。
②催化剂表面酸碱性对乙苯脱氢反应性能影响较大,根据反应历程分析,如果催化剂表面碱性太强,对反应造成的影响为:________________________ (说出一点即可)。
③一定温度下,向恒容密闭容器中充入2mol乙苯和2mol ,起始压强为p0,平衡时容器内气体总物质的量为5mol,乙苯的转化率为
,起始压强为p0,平衡时容器内气体总物质的量为5mol,乙苯的转化率为______ ,用平衡分压代替平衡浓度表示的化学平衡常数
______ 。(已知:气体分压=气体总压×气体体积分数)
 (g)
(g) 
 (g) +H2(g)
(g) +H2(g) 。
。(1)工业上,通常在乙苯蒸气中掺混水蒸气,反应温度维持在600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了
 以外的产物中苯乙烯的物质的量分数)示意图如下:
以外的产物中苯乙烯的物质的量分数)示意图如下:
①一般控制原料气中水油比n(水):n(乙苯)为9∶1,若水油比增大,乙苯的平衡转化率
②控制反应温度为600℃的理由是
(2)某研究机构用
 代替水蒸气开发了绿色化学合成工艺。反应方程式为:
代替水蒸气开发了绿色化学合成工艺。反应方程式为: (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g)
(g)+CO(g)+H2O(g) 。反应历程如图:
。反应历程如图:
①已知:
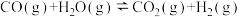
 。则
。则
 。
。②催化剂表面酸碱性对乙苯脱氢反应性能影响较大,根据反应历程分析,如果催化剂表面碱性太强,对反应造成的影响为:
③一定温度下,向恒容密闭容器中充入2mol乙苯和2mol
 ,起始压强为p0,平衡时容器内气体总物质的量为5mol,乙苯的转化率为
,起始压强为p0,平衡时容器内气体总物质的量为5mol,乙苯的转化率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如下(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是___________ ;仪器c的名称是________ ,反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_________ 。下列仪器中可用于分离苯乙酸粗品的是_____________ (填标号)。A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是_________ ,最终得到44 g纯品,则苯乙酸的产率是__________ 。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。

制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是
(3)提纯粗苯乙酸的方法是
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】铝镁合金是飞机制造、化工生产等行业的重要材料。研究性学习小组的同学为测定某含镁5%~8%的铝镁合金(不含其他元素)中铝的质量分数,设计了下列两种不同实验方案进行研究。
【方案一】
【实验方案】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是_______ 。
(2)称取13.5g铝镁合金粉末样品,溶于体积为V、物质的量浓度为5.0 的NaOH溶液中,充分反应。则NaOH溶液的体积
的NaOH溶液中,充分反应。则NaOH溶液的体积
_______ mL。写出加入NaOH溶液发生反应的离子方程式_______ 。
(3)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铝的质量分数将_______ (填“偏高”、“偏低”或“无影响”)。
【方案二】
【实验方案】将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积,实验装置如图所示。
(4)装置中导管a的作用是_______ 。
(5)上述操作的顺序是_______ ;(填序号)实验结束记录量气管的液面位置时,除视线平视外,还应_______ 。
(6)若实验用铝镁合金的质量为ag,测得氢气体积为VL(已换算为标准状况),则铝的质量分数为_______ 。
(7)实验过程中,若未恢复至室温就读取气体体积,则计算出铝的质量分数将_______ 。(填“偏大”、“偏小”、“不受影响”)
【方案一】
【实验方案】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是
(2)称取13.5g铝镁合金粉末样品,溶于体积为V、物质的量浓度为5.0
 的NaOH溶液中,充分反应。则NaOH溶液的体积
的NaOH溶液中,充分反应。则NaOH溶液的体积
(3)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铝的质量分数将
【方案二】
【实验方案】将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积,实验装置如图所示。

(4)装置中导管a的作用是
(5)上述操作的顺序是
(6)若实验用铝镁合金的质量为ag,测得氢气体积为VL(已换算为标准状况),则铝的质量分数为
(7)实验过程中,若未恢复至室温就读取气体体积,则计算出铝的质量分数将
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】一种从火法炼铜烟道灰(主要成分是 的硫酸盐,还有少量
的硫酸盐,还有少量 和
和 的氧化物)中回收铅,并制取三盐基硫酸铅(
的氧化物)中回收铅,并制取三盐基硫酸铅(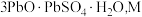 为
为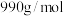 )的工艺如图:
)的工艺如图:
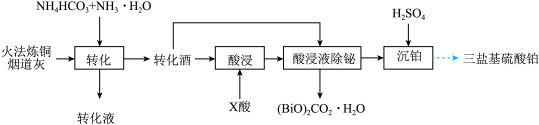
已知: 微溶于水
微溶于水
(1)写出铅原子的核外电子排布式:
_______ ,它位于元素周期表的_______ 区。
(2)转化过程温度选择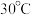 ,原因是
,原因是_______ 。
(3)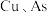 元素均进入转化液中,相关的离子分别为
元素均进入转化液中,相关的离子分别为_______ 、_______ (填离子符号)。
(4)转化渣主要成分为碳酸铅和碳酸氧铋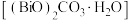 ,写出
,写出 转化为
转化为 的离子反应方程式:
的离子反应方程式:_______ 。
(5)加入适量的 酸,
酸, 酸宜为_______(填序号)。
酸宜为_______(填序号)。
(6)转化渣除铋的离子方程式为_______ 。
(7)若使用 烟道灰,最终制得纯度为
烟道灰,最终制得纯度为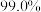 的三盐基硫酸铅
的三盐基硫酸铅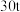 ,已知该工艺铅的回收率约为
,已知该工艺铅的回收率约为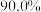 ,则烟道灰中含铅的质量分数为
,则烟道灰中含铅的质量分数为_______ 。
 的硫酸盐,还有少量
的硫酸盐,还有少量 和
和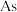 的氧化物)中回收铅,并制取三盐基硫酸铅(
的氧化物)中回收铅,并制取三盐基硫酸铅(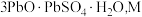 为
为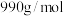 )的工艺如图:
)的工艺如图:
已知:
 微溶于水
微溶于水(1)写出铅原子的核外电子排布式:

(2)转化过程温度选择
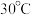 ,原因是
,原因是(3)
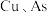 元素均进入转化液中,相关的离子分别为
元素均进入转化液中,相关的离子分别为(4)转化渣主要成分为碳酸铅和碳酸氧铋
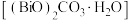 ,写出
,写出 转化为
转化为 的离子反应方程式:
的离子反应方程式:(5)加入适量的
 酸,
酸, 酸宜为_______(填序号)。
酸宜为_______(填序号)。| A.盐酸 | B.硫酸 | C.硝酸 | D.氢硫酸 |
(6)转化渣除铋的离子方程式为
(7)若使用
 烟道灰,最终制得纯度为
烟道灰,最终制得纯度为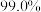 的三盐基硫酸铅
的三盐基硫酸铅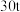 ,已知该工艺铅的回收率约为
,已知该工艺铅的回收率约为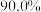 ,则烟道灰中含铅的质量分数为
,则烟道灰中含铅的质量分数为
您最近一年使用:0次



