氯的许多化合物是高效、广谱的灭菌消毒剂,在疫情防控中发挥了重要作用。
(1)工业制取氯气可用如图装置,图中的离子膜为_______ 膜(填“阳离子”或“阴离子”)。写出阴极的电极反应式_______ 。

(2)一种有效成分为 、
、 、
、 的“二氧化氯泡腾片”,快速溶于水后溢出大量气泡,得到
的“二氧化氯泡腾片”,快速溶于水后溢出大量气泡,得到 溶液。产生“气泡”的化学方程式为
溶液。产生“气泡”的化学方程式为_______ ;生成 的离子方程式为
的离子方程式为_______ 。
(3)已知AgCl、 (砖红色)的
(砖红色)的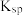 分别为
分别为 和
和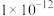 ,分析化学中,测定含氯的中性溶液中
,分析化学中,测定含氯的中性溶液中 的含量,常以
的含量,常以 作指示剂,用标准
作指示剂,用标准 溶液滴定。当溶液中出现砖红色沉淀时,假设
溶液滴定。当溶液中出现砖红色沉淀时,假设 ,则
,则
_______  。
。
(1)工业制取氯气可用如图装置,图中的离子膜为

(2)一种有效成分为
 、
、 、
、 的“二氧化氯泡腾片”,快速溶于水后溢出大量气泡,得到
的“二氧化氯泡腾片”,快速溶于水后溢出大量气泡,得到 溶液。产生“气泡”的化学方程式为
溶液。产生“气泡”的化学方程式为 的离子方程式为
的离子方程式为(3)已知AgCl、
 (砖红色)的
(砖红色)的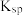 分别为
分别为 和
和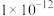 ,分析化学中,测定含氯的中性溶液中
,分析化学中,测定含氯的中性溶液中 的含量,常以
的含量,常以 作指示剂,用标准
作指示剂,用标准 溶液滴定。当溶液中出现砖红色沉淀时,假设
溶液滴定。当溶液中出现砖红色沉淀时,假设 ,则
,则
 。
。
更新时间:2021-04-27 21:56:52
|
相似题推荐
【推荐1】某硫铅矿的主要成分为PbS,含有杂质Fe2O3、Al2O3、FeO、SiO2等,利用粉碎过的硫铅矿粉制备高纯铅的流程如图:

已知:①PbS不溶于强碱溶液;
②25℃时,Ksp(PbSO4)=1.5×10-8,Ksp(PbCO3)=8.0×10-14,Ksp(PbS)=1.0×10-28;
③H2SiF6、PbSiF6均为强电解质。
请回答下列问题:
(1)“碱浸”的目的是为了除去某些杂质,为了能使除杂更完全,可采取的有效措施有____ (写两条)。
(2)向滤液I中通入足量的CO2,有白色沉淀产生,则白色沉淀的主要成分为____ (填化学式)。
(3)“氧化、酸浸”过程中,双氧水的实际用量远高于理论用量,其原因可能是____ ;写出PbS转化为PbSO4的化学方程式:____ 。
(4)“转化”是为了使PbSO4转化为PbCO3若滤液III中c(SO )=1.5 mol·L-1、c(CO
)=1.5 mol·L-1、c(CO )=4.0×10-5 mol·L-1,试通过计算判断“转化”过程中所得PbCO3固体中是否含有PbSO4:
)=4.0×10-5 mol·L-1,试通过计算判断“转化”过程中所得PbCO3固体中是否含有PbSO4:____ (简要写出重要计算过程)。
(5)写出“溶解”过程中反应的离子方程式:____ 。
(6)研究发现,电解“H2SiF6、PbSiF6混合液”时,适当提高c(H2SiF6)有利于提高铅的产率,但若c(H2SiF6)太大,铅的产率反而下降,其下降的原因可能是____ 。

已知:①PbS不溶于强碱溶液;
②25℃时,Ksp(PbSO4)=1.5×10-8,Ksp(PbCO3)=8.0×10-14,Ksp(PbS)=1.0×10-28;
③H2SiF6、PbSiF6均为强电解质。
请回答下列问题:
(1)“碱浸”的目的是为了除去某些杂质,为了能使除杂更完全,可采取的有效措施有
(2)向滤液I中通入足量的CO2,有白色沉淀产生,则白色沉淀的主要成分为
(3)“氧化、酸浸”过程中,双氧水的实际用量远高于理论用量,其原因可能是
(4)“转化”是为了使PbSO4转化为PbCO3若滤液III中c(SO
 )=1.5 mol·L-1、c(CO
)=1.5 mol·L-1、c(CO )=4.0×10-5 mol·L-1,试通过计算判断“转化”过程中所得PbCO3固体中是否含有PbSO4:
)=4.0×10-5 mol·L-1,试通过计算判断“转化”过程中所得PbCO3固体中是否含有PbSO4:(5)写出“溶解”过程中反应的离子方程式:
(6)研究发现,电解“H2SiF6、PbSiF6混合液”时,适当提高c(H2SiF6)有利于提高铅的产率,但若c(H2SiF6)太大,铅的产率反而下降,其下降的原因可能是
您最近一年使用:0次
【推荐2】以某四氯化钛精制厂的尾渣(主要含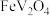 、
、 、NaCl及少量的
、NaCl及少量的 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下: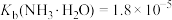 ;
; ;
;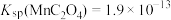
(1)“水洗”的目的为___________ 。“水洗”和“酸浸”后均采用减压过滤,与常压过滤相比,其优点为___________ 。
(2)“焙烧”的目的是将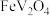 转化为
转化为 和可溶于水的
和可溶于水的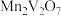 ,以利于“酸浸”时钒浸出。
,以利于“酸浸”时钒浸出。
①该反应的化学方程式为___________ 。
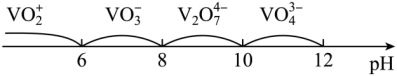
②钒浸出率与焙烧温度、锰钒比的关系如图所示。“焙烧”的最佳温度和锰钒比分别为___________ 、___________ 温度不宜过低的可能原因为___________ 。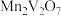 与
与 按物质的量比1:1进行反应的离子方程式为
按物质的量比1:1进行反应的离子方程式为___________
(4)“沉钒”时,在25℃下维持溶液pH=7,向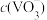 =0.2
=0.2 的酸浸液中加入等体积的
的酸浸液中加入等体积的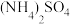 溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中
溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中 =0.005
=0.005 ,则沉钒率为
,则沉钒率为___________ %。
(5)“煅烧”所得 可制成铝钒合金(
可制成铝钒合金(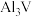 ),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为
),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为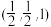 。
。___________ 。
②B点原子的分数坐标为(1, ,
,___________ )(用含b、c的代数式表示),V原子的配位数为___________ 。
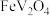 、
、 、NaCl及少量的
、NaCl及少量的 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下: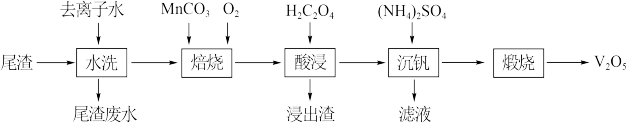
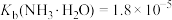 ;
; ;
;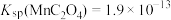
(1)“水洗”的目的为
(2)“焙烧”的目的是将
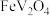 转化为
转化为 和可溶于水的
和可溶于水的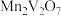 ,以利于“酸浸”时钒浸出。
,以利于“酸浸”时钒浸出。①该反应的化学方程式为
②钒浸出率与焙烧温度、锰钒比的关系如图所示。“焙烧”的最佳温度和锰钒比分别为
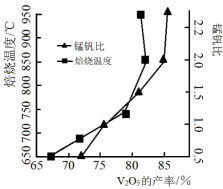
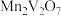 与
与 按物质的量比1:1进行反应的离子方程式为
按物质的量比1:1进行反应的离子方程式为(4)“沉钒”时,在25℃下维持溶液pH=7,向
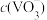 =0.2
=0.2 的酸浸液中加入等体积的
的酸浸液中加入等体积的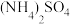 溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中
溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中 =0.005
=0.005 ,则沉钒率为
,则沉钒率为(5)“煅烧”所得
 可制成铝钒合金(
可制成铝钒合金(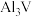 ),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为
),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为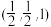 。
。
②B点原子的分数坐标为(1,
 ,
,
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】现以铅蓄电池的填充物铅高(主要含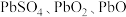 和少量
和少量 )为原料,可生产三盐基硫酸铅
)为原料,可生产三盐基硫酸铅 和副产品
和副产品 ,其工艺流程如下:
,其工艺流程如下:

已知:
(1)“转化”后的难溶物质为 和少量
和少量 ,则
,则 转化为
转化为 的离子方程式为
的离子方程式为_______ ,滤液1中 和
和 的浓度比为
的浓度比为_______ 。
(2)“酸浸”过程,产生的气体主要有 (氮氧化物)和
(氮氧化物)和_______ (填化学式)。
(3)“沉铅”后循环利用的物质Y是_______ (填化学式)。
(4)“除杂”中滤渣的主要成分为_______ (填化学式):在 “合成”三盐基硫酸铅的化学方程式为
“合成”三盐基硫酸铅的化学方程式为_______ 。
(5)根据图2所示的溶解度随温度的变化曲线,由“滤液1”和“滤液2”获得 晶体的操作为将“滤液”调节
晶体的操作为将“滤液”调节 为7,然后
为7,然后_______ 、_______ ,洗涤后干燥。

 和少量
和少量 )为原料,可生产三盐基硫酸铅
)为原料,可生产三盐基硫酸铅 和副产品
和副产品 ,其工艺流程如下:
,其工艺流程如下:
已知:

(1)“转化”后的难溶物质为
 和少量
和少量 ,则
,则 转化为
转化为 的离子方程式为
的离子方程式为 和
和 的浓度比为
的浓度比为(2)“酸浸”过程,产生的气体主要有
 (氮氧化物)和
(氮氧化物)和(3)“沉铅”后循环利用的物质Y是
(4)“除杂”中滤渣的主要成分为
 “合成”三盐基硫酸铅的化学方程式为
“合成”三盐基硫酸铅的化学方程式为(5)根据图2所示的溶解度随温度的变化曲线,由“滤液1”和“滤液2”获得
 晶体的操作为将“滤液”调节
晶体的操作为将“滤液”调节 为7,然后
为7,然后
您最近一年使用:0次
【推荐1】Ⅰ.钢铁容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一、可采用电化学防护技术减缓海水中钢铁设施的腐蚀,下图是钢铁桥墩部分防护原理示意图。
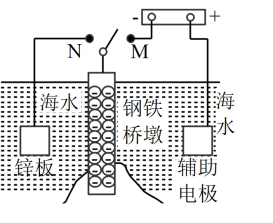
(1)K 与 M 连接时钢铁桥墩的电化学防护方法为___________ 。
(2)K与N连接时,钢铁桥墩为___________ 极(填"正"、"负"、"阴"或"阳"),电极反应式为___________ 。
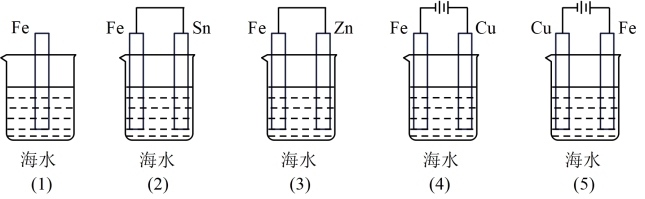
(3)下列各情况中,Fe片腐蚀由快到慢的顺序是___________ 。
(4)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH = +234.1 kJ/mol
C(s)+O2(g)=CO2(g) ΔH = -393.5 kJ/mol。
根据以上信息,则Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式是__________ 。
Ⅱ.经研究发现青铜器的腐蚀竟然都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。
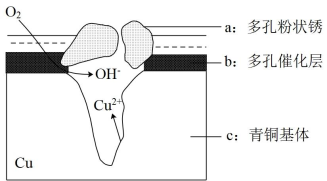
(1)腐蚀过程中,负极是___________ (填图中字母"a"或"b"或"c");
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为___________ 。
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为___________ L(标准状况)。

(1)K 与 M 连接时钢铁桥墩的电化学防护方法为
(2)K与N连接时,钢铁桥墩为
(3)下列各情况中,Fe片腐蚀由快到慢的顺序是

(4)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH = +234.1 kJ/mol
C(s)+O2(g)=CO2(g) ΔH = -393.5 kJ/mol。
根据以上信息,则Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式是
Ⅱ.经研究发现青铜器的腐蚀竟然都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。

(1)腐蚀过程中,负极是
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
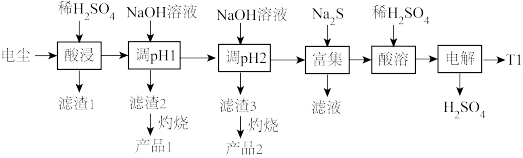
【推荐2】某省锌铜产量居全国之首,从铅锌厂的电尘(主要成分为PbO 、ZnO,还含有少量Fe2O3、Tl2O)中回收Fe2O3、ZnO、铊,铊锡合金可作超导材料。其工艺流程如图。
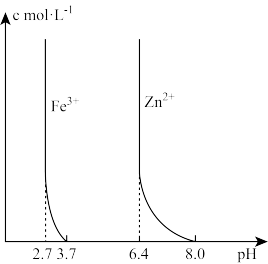
已知:①Zn(OH)2为两性氢氧化物,溶液pH> 10开始溶解。
②部分离子浓度与pH的关系如图。
(1)铊在周期表中的位置是_______ 。
(2)“酸浸”过程中为提高铊的浸取速度,可采取的措施有_______ (写出两条)。
(3)“产品1”的主要成分是_______ (填化学式),检验电尘中是否含FeO,取“酸浸”后的少量滤液于试管中,加入黄色试剂,发生反应的化学方程式 _______ 。
(4)“调pH2”过程调pH的范围是_______ 。
(5)“富集”过程发生的离子方程式是_______ 。
(6)“电解”过程的电解池如图,则应是_______ (填“阳”或“阴")离子交换膜。
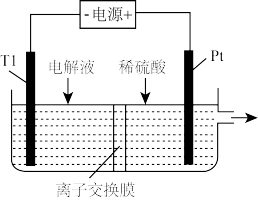

已知:①Zn(OH)2为两性氢氧化物,溶液pH> 10开始溶解。
②部分离子浓度与pH的关系如图。

(1)铊在周期表中的位置是
(2)“酸浸”过程中为提高铊的浸取速度,可采取的措施有
(3)“产品1”的主要成分是
(4)“调pH2”过程调pH的范围是
(5)“富集”过程发生的离子方程式是
(6)“电解”过程的电解池如图,则应是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氨在能源、化肥生产等领域有着非常重要的用途。
(1)25℃时, 和
和 能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是
能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是___________ 。
(2)与 燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型
燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型 燃料电池原理如下图所示:
燃料电池原理如下图所示:
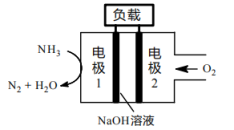
①电极1为___________ (填“正极”或“负极”),电极2的反应式为___________ 。
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:2H2(g)+O2(g)=2H2O(g) ΔH1,N2(g)+3H2(g)=2NH3(g) ΔH2,4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3, 、
、 、
、 之间的关系式为:
之间的关系式为:
___________ 。
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是原电池可将氧化反应与还原反应___________ 进行,使得电子发生定向移动,形成电流。
(3)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是___________ 。
(4)常温常压下电解法合成氨的原理如下图所示:
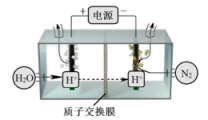
①阳极产生的气体是___________ 。
②阴极生成氨的电极反应式为___________ 。
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式___________ 。
(1)25℃时,
 和
和 能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是
能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是(2)与
 燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型
燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型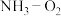 燃料电池原理如下图所示:
燃料电池原理如下图所示:
①电极1为
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:2H2(g)+O2(g)=2H2O(g) ΔH1,N2(g)+3H2(g)=2NH3(g) ΔH2,4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3,
 、
、 、
、 之间的关系式为:
之间的关系式为:
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是原电池可将氧化反应与还原反应
(3)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
| 序号 | 化学反应 | K(298K)的数值 |
| ① |  |  |
| ② | 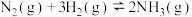 | 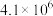 |

①阳极产生的气体是
②阴极生成氨的电极反应式为
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式
您最近一年使用:0次



