氢气是未来理想的能源。
(1)实验室用铁与2mol·L-1的硫酸反应生成H2的物质的量与反应时间的关系如图所示。按要求回答下列问题。
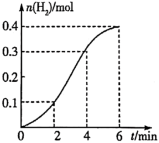
①产生H2的平均反应速率最大的时间段是___ (填“0~2min”“2~4min”或“4~6min”),该时间段内对反应速率起关键作用的影响因素是___ 。
②若向体系中加入少量硫酸铜溶液,可以加快氢气的生成速率,其原因是___ 。
③要加快上述实验中产生氢气的速率,还可采取的措施是__ (填一种)。
(2)工业上用海水制氢气的新技术的原理为2H2O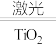 2H2↑+O2↑。回答下列问题:
2H2↑+O2↑。回答下列问题:
①分解海水的反应属于___ “反应(填“放热”或“吸热”)。
②分解产生的氢气储存比较困难,有一种储存方法的原理可表示为NaHCO3+H2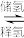 HCOONa+H2O。下列说法正确的是
HCOONa+H2O。下列说法正确的是__ (填序号)。
A.储氢、释氢过程中均有能量变化
B.储氢时反应物中只有离子键、非极性键的断裂
C.储氢过程中,NaHCO3被还原
D.释氢过程中,每消耗0.1molH2O放出2.24LH2
(3)H2可与I2发生反应:I2(g)+H2(g) 2HI(g)。一定温度下,在恒容密闭容器中进行该反应,下列叙述能说明该反应达到平衡的是
2HI(g)。一定温度下,在恒容密闭容器中进行该反应,下列叙述能说明该反应达到平衡的是___ (填序号)。
A.2v(H2)=v(HI)
B.断裂1molH—H键的同时形成1molI—I键
C.容器内气体的压强不变
D.容器内气体的颜色不变
(1)实验室用铁与2mol·L-1的硫酸反应生成H2的物质的量与反应时间的关系如图所示。按要求回答下列问题。

①产生H2的平均反应速率最大的时间段是
②若向体系中加入少量硫酸铜溶液,可以加快氢气的生成速率,其原因是
③要加快上述实验中产生氢气的速率,还可采取的措施是
(2)工业上用海水制氢气的新技术的原理为2H2O
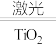 2H2↑+O2↑。回答下列问题:
2H2↑+O2↑。回答下列问题:①分解海水的反应属于
②分解产生的氢气储存比较困难,有一种储存方法的原理可表示为NaHCO3+H2
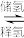 HCOONa+H2O。下列说法正确的是
HCOONa+H2O。下列说法正确的是A.储氢、释氢过程中均有能量变化
B.储氢时反应物中只有离子键、非极性键的断裂
C.储氢过程中,NaHCO3被还原
D.释氢过程中,每消耗0.1molH2O放出2.24LH2
(3)H2可与I2发生反应:I2(g)+H2(g)
 2HI(g)。一定温度下,在恒容密闭容器中进行该反应,下列叙述能说明该反应达到平衡的是
2HI(g)。一定温度下,在恒容密闭容器中进行该反应,下列叙述能说明该反应达到平衡的是A.2v(H2)=v(HI)
B.断裂1molH—H键的同时形成1molI—I键
C.容器内气体的压强不变
D.容器内气体的颜色不变
更新时间:2021-04-29 11:49:40
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】硫元素与铁可以形成多种硫化物,其中FeS和 最为常见,而FeS又是你最不陌生的,其样品如下图所示。
最为常见,而FeS又是你最不陌生的,其样品如下图所示。

将铁粉与硫粉混合均匀加热,即可生成FeS。但你所不知的是:细粉级的FeS在50℃以上便可自燃,纵然是极其小心地储存,也会被氧气缓慢完全氧化,其中 的Fe被氧化为+3价,同时有淡黄色晶体生成。
的Fe被氧化为+3价,同时有淡黄色晶体生成。
(1)由此信息推断的结论错误的是___________
A.上述铁粉与硫粉的反应是放热反应
B.细粉级的FeS被氧气缓慢时,可生成 和S
和S
C.等量的铁在Cl2中燃烧时,转移的电子数多
D.在50℃以上FeS自燃,有硫生成
E.FeS与硝酸反应,生成
(2)在低温冷冻下,向 溶液中滴加少量
溶液中滴加少量 溶液,得到黑色固体
溶液,得到黑色固体 ,则此反应的离子方程式为
,则此反应的离子方程式为___________ 。将 投入稀盐酸中溶解,有臭鸡蛋气味气体产生。此反应的产物除
投入稀盐酸中溶解,有臭鸡蛋气味气体产生。此反应的产物除 外,还有
外,还有___________ 和___________ (填写化学式)。
 最为常见,而FeS又是你最不陌生的,其样品如下图所示。
最为常见,而FeS又是你最不陌生的,其样品如下图所示。
将铁粉与硫粉混合均匀加热,即可生成FeS。但你所不知的是:细粉级的FeS在50℃以上便可自燃,纵然是极其小心地储存,也会被氧气缓慢完全氧化,其中
 的Fe被氧化为+3价,同时有淡黄色晶体生成。
的Fe被氧化为+3价,同时有淡黄色晶体生成。(1)由此信息推断的结论错误的是
A.上述铁粉与硫粉的反应是放热反应
B.细粉级的FeS被氧气缓慢时,可生成
 和S
和SC.等量的铁在Cl2中燃烧时,转移的电子数多
D.在50℃以上FeS自燃,有硫生成
E.FeS与硝酸反应,生成

(2)在低温冷冻下,向
 溶液中滴加少量
溶液中滴加少量 溶液,得到黑色固体
溶液,得到黑色固体 ,则此反应的离子方程式为
,则此反应的离子方程式为 投入稀盐酸中溶解,有臭鸡蛋气味气体产生。此反应的产物除
投入稀盐酸中溶解,有臭鸡蛋气味气体产生。此反应的产物除 外,还有
外,还有
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】近年来,随着汽车保有量的提高,机动车尾气排放问题越来越引起人们的重视,如何节能减排是汽车工业发展的重要因素,请回答下列问题。
(1)已知物质的键能:
汽车内燃机工作时引发反应: ,是导致汽车尾气中含有
,是导致汽车尾气中含有 的原因之一、该反应是
的原因之一、该反应是___________ 反应(填“放热”或“吸热”), 和
和 的总能量比
的总能量比 的总能量
的总能量___________ (填“高”或“低”)
(2)已知 的燃烧热为
的燃烧热为 。汽车尾气中的
。汽车尾气中的 与
与 理论上可以转换成无害物质排出,发生
理论上可以转换成无害物质排出,发生 ,
,
___________ ;但实际上该反应的速率很小,需要使用汽车尾气催化转换器,加快反应进行,上述反应在使用“催化转化器”后,
___________ (填“增大”“减小”或“不变”)。
(3)随着科技的进步,新能源汽车得到了极大的发展,在保证性能的同时也降低了能耗。新能源汽车的电池大多与锂有关,某锂电池电极材料分别为 (嵌锂石墨)、
(嵌锂石墨)、 (钴酸锂),电解质溶液为
(钴酸锂),电解质溶液为 (六氟磷酸锂)的碳酸酯溶液(无水),该电池放电时的反应原理可表示为:
(六氟磷酸锂)的碳酸酯溶液(无水),该电池放电时的反应原理可表示为: 。请回答下列问题:负极材料是
。请回答下列问题:负极材料是___________ ,正极的电极反应式___________ ,电解质溶液无水的原因___________ 。
(1)已知物质的键能:
| 物质 |  |  |  |
| 键能 | 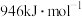 | 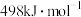 | 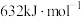 |
 ,是导致汽车尾气中含有
,是导致汽车尾气中含有 的原因之一、该反应是
的原因之一、该反应是 和
和 的总能量比
的总能量比 的总能量
的总能量(2)已知
 的燃烧热为
的燃烧热为 。汽车尾气中的
。汽车尾气中的 与
与 理论上可以转换成无害物质排出,发生
理论上可以转换成无害物质排出,发生 ,
,

(3)随着科技的进步,新能源汽车得到了极大的发展,在保证性能的同时也降低了能耗。新能源汽车的电池大多与锂有关,某锂电池电极材料分别为
 (嵌锂石墨)、
(嵌锂石墨)、 (钴酸锂),电解质溶液为
(钴酸锂),电解质溶液为 (六氟磷酸锂)的碳酸酯溶液(无水),该电池放电时的反应原理可表示为:
(六氟磷酸锂)的碳酸酯溶液(无水),该电池放电时的反应原理可表示为: 。请回答下列问题:负极材料是
。请回答下列问题:负极材料是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】化学变化过程中均存在物质变化与能量变化,某化学兴趣小组按下图所示装置实验,以验证此结论。

请回答下列问题:
(1)进行实验时,装置①中温度计中水银液面变化是___________ (填“升高”或“降低”),装置②中化学反应方程是___________ 。
(2)为探究 、
、 与盐酸的反应是吸热反应还是放热反应,某同学进行了下列实验(盐酸浓度相同,每项实验各做3次,取平均值)。
与盐酸的反应是吸热反应还是放热反应,某同学进行了下列实验(盐酸浓度相同,每项实验各做3次,取平均值)。
设计a、b组实验的目的是___________ ,___________ 溶液和盐酸的反应的能量变化情况符合图③


请回答下列问题:
(1)进行实验时,装置①中温度计中水银液面变化是
(2)为探究
 、
、 与盐酸的反应是吸热反应还是放热反应,某同学进行了下列实验(盐酸浓度相同,每项实验各做3次,取平均值)。
与盐酸的反应是吸热反应还是放热反应,某同学进行了下列实验(盐酸浓度相同,每项实验各做3次,取平均值)。| 实验序号 | 试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
| a | 35mL水 | 2.5g  | 20.0 | 18.5 |
| b | 35mL水 | 3.2g  | 20.0 | 24.3 |
| c | 35mL盐酸 | 2.5g  | 20.0 | 16.2 |
| d | 35mL盐酸 | 3.2g  | 20.0 | 25.1 |

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是_________ 。
②已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用__________ 反应的ΔH。
③反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是________________ (选填字母序号)。
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
④用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如下图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率_______ (填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因:____________________________ 。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是
②已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用
③反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
④用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如下图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 2NH3(g)△H=" -92.4KJ/mol ",据此回答以下问题:
2NH3(g)△H=" -92.4KJ/mol ",据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)___________ 。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________ 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________ (可用分数表示)。能说明该反应达到化学平衡状态的是_______________ (填字母)。
a.容器内的密度保持不变b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3)d.混合气体中c(NH3)不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________ 。

(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;
B中NH3的体积分数为b,放出热量Q2kJ。则:a_____ b(填>、=、<),Q1_____ Q2(填>、=、<),Q1_____ 92.4(填>、=、<)。
N2(g)+3H2(g)
 2NH3(g)△H=" -92.4KJ/mol ",据此回答以下问题:
2NH3(g)△H=" -92.4KJ/mol ",据此回答以下问题:(1)下列有关该反应速率的叙述,正确的是(选填序号)
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=
a.容器内的密度保持不变b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3)d.混合气体中c(NH3)不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)

(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;
B中NH3的体积分数为b,放出热量Q2kJ。则:a
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】汽车尾气(主要成分为NOx和CO)已成为主要的空气污染物来源之一,有发生光化学烟雾污染的潜在危险。
(1)某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是_____ 。(填选项序号字母)

a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
(2)一定条件下,将2 mol NO与2 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g) 2NO2(g),下列可判断反应达平衡的是
2NO2(g),下列可判断反应达平衡的是_____ 。(填选项序号字母)
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2 mol NO同时生成2 mol NO2
(3)高温下N2和O2发生N2(g)+O2(g) 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
①右图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此判断反应N2(g)+O2(g) 2NO(g)为
2NO(g)为_____ (填“吸热”或“放热”)反应。

②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=_____ 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为_____ 。

③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:_____ 。
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2,共放出热量867 kJ,则ΔH2=_____ 。若用标准状况下4.48 L CH4还原NO2至N2,共转移的电子总数为_____ (阿伏伽德罗常数的值用NA表示)。
(1)某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是

a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
(2)一定条件下,将2 mol NO与2 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g)
 2NO2(g),下列可判断反应达平衡的是
2NO2(g),下列可判断反应达平衡的是a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2 mol NO同时生成2 mol NO2
(3)高温下N2和O2发生N2(g)+O2(g)
 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
2NO(g)反应,是导致汽车尾气中含有NO的原因之一。①右图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此判断反应N2(g)+O2(g)
 2NO(g)为
2NO(g)为
②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=

③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2,共放出热量867 kJ,则ΔH2=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+ H2O(g)⇌CO2(g)+ 3H2(g) △H>0。
(1)在一定条件下,向体积为2L的恒容密闭容器中充入1mol CH3OH(g)和3mol H2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示的该反应的速率为_______ 。
(2)上述可逆反应达到平衡状态的依据是(填序号)_______ 。
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1mol CH3OH(g)和2mol H2O(g),向B容器中充入1.2mol CH3OH(g)和2.4mol H2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL。

试回答:
①反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH的转化率为_______ ,A、B两容器中H2O(g)的体积百分含量的大小关系为B_______ A(填“>”“<”或“=”)。
②若打开K,一段时间后重新达到平衡,容器B的体积为_______ L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(4)工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
根据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______ (用K1、K2表示)。若500℃时测得反应③在某时刻H2(g)、CO2(g) 、CH3OH(g)、H2O (g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正 _______ v逆(填“<”“=”或“>”)
(1)在一定条件下,向体积为2L的恒容密闭容器中充入1mol CH3OH(g)和3mol H2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示的该反应的速率为
(2)上述可逆反应达到平衡状态的依据是(填序号)
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1mol CH3OH(g)和2mol H2O(g),向B容器中充入1.2mol CH3OH(g)和2.4mol H2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL。

试回答:
①反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH的转化率为
②若打开K,一段时间后重新达到平衡,容器B的体积为
(4)工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度 / ℃ | |
500 | 800 | ||
| ①2H2(g)+CO(g) ⇌CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g) ⇌ H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g) ⇌CH3OH(g)+H2O (g) | K3 | ||
根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
(一)已知① H2O(g)=H2O(1) △H=-44kJ•mol-1
②N2(g)+O2(g) 2NO(g) △H=+180.5kJ•mol-1
2NO(g) △H=+180.5kJ•mol-1
③4NO(g)+6H2O(g) 4NH3(g)+5O2(g) △H=+1025kJ•mol-1
4NH3(g)+5O2(g) △H=+1025kJ•mol-1
写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式_________
(二)工业合成氨的原理为:N2(g)+3H2(g) 2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
(1)下列反应条件的控制不能用勒夏特列原理解释的是_________ 。
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是________ 。
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3从高到低的顺序是_________________ ;测得B(X,60)点时N2的转化率为50%,则X=________ 。
(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=________ (用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:_______________ 。
(一)已知① H2O(g)=H2O(1) △H=-44kJ•mol-1
②N2(g)+O2(g)
 2NO(g) △H=+180.5kJ•mol-1
2NO(g) △H=+180.5kJ•mol-1③4NO(g)+6H2O(g)
 4NH3(g)+5O2(g) △H=+1025kJ•mol-1
4NH3(g)+5O2(g) △H=+1025kJ•mol-1写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式
(二)工业合成氨的原理为:N2(g)+3H2(g)
 2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。(1)下列反应条件的控制不能用勒夏特列原理解释的是
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3从高到低的顺序是

(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】随原子序数递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1) f在周期表中的位置是__________ 。
(2) 比较d、e常见离子的半径大小(用化学式表示,下同):____ >____ ;比较g、h的最高价氧化物对应水化物的酸性强弱:____ >____ 。
(3) 任选上述元素组成一种四原子共价化合物,写出其电子式:____ 。
(4)f和h形成的化合物的物理性质非常特殊,其的熔点为190℃(2.02×105Pa),但在180℃就开始升华。据此判断,该化合物是_______ (填“共价化合物”或“离子化合物”) , 可以证明你的判断正确的实验依据是________________ 。
(5) 上述元素可组成盐R: zx4f(gd4)2,向盛有10 mL 1 mol·L-1R溶液的烧杯中滴加1 mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

①m点反应的离子方程式:________________ 。
②若在R溶液中改加20 mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______ mol。

根据判断出的元素回答问题:
(1) f在周期表中的位置是
(2) 比较d、e常见离子的半径大小(用化学式表示,下同):
(3) 任选上述元素组成一种四原子共价化合物,写出其电子式:
(4)f和h形成的化合物的物理性质非常特殊,其的熔点为190℃(2.02×105Pa),但在180℃就开始升华。据此判断,该化合物是
(5) 上述元素可组成盐R: zx4f(gd4)2,向盛有10 mL 1 mol·L-1R溶液的烧杯中滴加1 mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

①m点反应的离子方程式:
②若在R溶液中改加20 mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为________ (填化学式)。
(2)KClO4是助氧化剂,其中含有化学键的类型为________________________ 。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
________________________________________________________________ 。
(4)NaN3是气体发生剂,受热分解产生N2和Na。取56 g上述产气药剂,分解产生的气体通过碱石灰后的体积为16.8 L(标准状况),该产气药剂中NaN3的质量分数为________ 。
(1)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为
(2)KClO4是助氧化剂,其中含有化学键的类型为
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
(4)NaN3是气体发生剂,受热分解产生N2和Na。取56 g上述产气药剂,分解产生的气体通过碱石灰后的体积为16.8 L(标准状况),该产气药剂中NaN3的质量分数为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】冰晶石是金属铝冶炼时的助溶剂,工业上制取冰晶石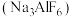 的化学方程式如下:
的化学方程式如下: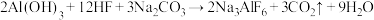 ;根据题意完成下列填空:
;根据题意完成下列填空:
(1)铝原子核外电子占据_______ 个轨道,最外层电子云伸展方向有_______ 种,某元素与铝元素不同周期但在相邻一族,且性质和铝元素十分相似,该元素原子核外电子排布式为_______ 。
(2)冰晶石中存在的化学键_______ ,在上述反应的反应物和生成物中,属于非极性分子的电子式_______ ,属于弱酸的电离方程式_______ 。
(3)金属铝冶炼时,使用助熔剂冰晶石,是因为原料 的高熔点,为什么原料不选用熔点更低的
的高熔点,为什么原料不选用熔点更低的 ?
?_______
(4)在电解法发明前,金属铝是用更活泼的金属通过置换反应来生产的,所以价格非常昂贵,为什么不使用相对廉价的碳或氢气进行置换呢?_______
(5)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是_______(选填编号)。
(6) 俗称纯碱,属于
俗称纯碱,属于_______ 晶体。工业上制取纯碱的原料是_______ 。
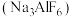 的化学方程式如下:
的化学方程式如下: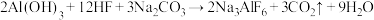 ;根据题意完成下列填空:
;根据题意完成下列填空:(1)铝原子核外电子占据
(2)冰晶石中存在的化学键
(3)金属铝冶炼时,使用助熔剂冰晶石,是因为原料
 的高熔点,为什么原料不选用熔点更低的
的高熔点,为什么原料不选用熔点更低的 ?
?(4)在电解法发明前,金属铝是用更活泼的金属通过置换反应来生产的,所以价格非常昂贵,为什么不使用相对廉价的碳或氢气进行置换呢?
(5)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是_______(选填编号)。
| A.气态氢化物的稳定性 | B.最高价氧化物对应水化物的酸性 |
| C.单质与氢气反应的难易 | D.单质与同浓度酸发生反应的快慢 |
 俗称纯碱,属于
俗称纯碱,属于
您最近一年使用:0次

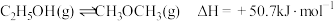 ,该反应的速率方程可表示为
,该反应的速率方程可表示为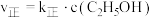 和
和 ,
,
 和只与温度有关。该反应的活化能
和只与温度有关。该反应的活化能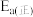
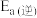 ,已知:
,已知: 时,
时,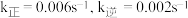 ,该温度下向某恒容密闭容器中充入
,该温度下向某恒容密闭容器中充入 乙醇和
乙醇和 甲醚,此时反应
甲醚,此时反应

