(1)在高温、高压、催化剂作用下,1mol石墨转化为金刚石,吸收1.9 kJ的热量。该反应的ΔH ___________ 0 (填“>”或“<”),对于石墨和金刚石,___________ 更稳定。
(2)用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
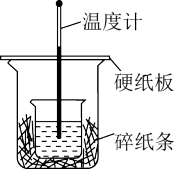
①从实验装置上看,图中尚缺少的一种玻璃用品是___________ 。
②大烧杯上如不盖硬纸板,测得的反应热数值___________ (填“偏大、偏小、无影响”)。
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的反应热的数值会___________ (填“偏大”、“偏小”、“无影响”)。
(3)在25℃、101 kPa下,1g CH3OH(l)完全燃烧生成CO2和液态水时放热22.68 kJ。写出表示CH3OH燃烧热的热化学方程式___________ 。
(4)已知几种化学键的键能如表所示:
则反应Cl2(g)+ 3F2(g) 2ClF3(g) 的ΔH =
2ClF3(g) 的ΔH =___________ kJ/mol
(5)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+ 4NO2 (g)=4NO(g)+ CO2 (g)+ 2H2O(1) △H1 = -662kJ·mol-1
②CH4 (g)+ 4NO(g) =2N2 (g)+ CO2 (g)+ 2H2O(1) △H2 = -1251 kJ·mol-1
据此,写出CH4将NO2还原为N2的热化学方程式:___________ 。
(2)用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是
②大烧杯上如不盖硬纸板,测得的反应热数值
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的反应热的数值会
(3)在25℃、101 kPa下,1g CH3OH(l)完全燃烧生成CO2和液态水时放热22.68 kJ。写出表示CH3OH燃烧热的热化学方程式
(4)已知几种化学键的键能如表所示:
| 化学键 | Cl—Cl | F—F | Cl—F |
| 键能/ (kJ/mol) | 242 | 159 | 172 |
则反应Cl2(g)+ 3F2(g)
 2ClF3(g) 的ΔH =
2ClF3(g) 的ΔH =(5)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+ 4NO2 (g)=4NO(g)+ CO2 (g)+ 2H2O(1) △H1 = -662kJ·mol-1
②CH4 (g)+ 4NO(g) =2N2 (g)+ CO2 (g)+ 2H2O(1) △H2 = -1251 kJ·mol-1
据此,写出CH4将NO2还原为N2的热化学方程式:
更新时间:2021-05-19 14:45:37
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
请回答下列问题:
①该反应的平衡常数表达式K=__________ ,ΔH_______ 0(填“>”、“<”或“=”)。
②欲提高反应中CO的平衡转化率,可采取的措施是_____________________ 。
A.减少Fe的量 B.加入合适的催化剂
C.增大容器的体积 D.降低反应的温度
③在一个容积为1 L的密闭容器中,1000 ℃时加入Fe2O3、CO各2 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO)=______________ ,Fe2O3的平衡转化率为________ 。
(2)饱和Mg(OH)2溶液中滴加FeCl3溶液,产生红褐色沉淀, 反应的离子方程式是________________________________________ 。
(3)已知:2Fe(s)+3/2O2(g)=Fe2O3(s) △H=−824 kJ·mol-1、2Al(s)+3/2O2(g)=Al2O3(s) △H=−1675.7 kJ·mol-1。则铝与Fe2O3发生反应生成Al2O3和Fe的热化学方程式为 :___________________________ 。
(1)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
①该反应的平衡常数表达式K=
②欲提高反应中CO的平衡转化率,可采取的措施是
A.减少Fe的量 B.加入合适的催化剂
C.增大容器的体积 D.降低反应的温度
③在一个容积为1 L的密闭容器中,1000 ℃时加入Fe2O3、CO各2 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO)=
(2)饱和Mg(OH)2溶液中滴加FeCl3溶液,产生红褐色沉淀, 反应的离子方程式是
(3)已知:2Fe(s)+3/2O2(g)=Fe2O3(s) △H=−824 kJ·mol-1、2Al(s)+3/2O2(g)=Al2O3(s) △H=−1675.7 kJ·mol-1。则铝与Fe2O3发生反应生成Al2O3和Fe的热化学方程式为 :
您最近一年使用:0次
【推荐2】甲醇是一种基础的有机化工原料和优质燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下可以合成甲醇,主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:

由此计算△H1=_______ kJ·mol-1;已知△H2=-58 kJ·mol-1,则△H3=_______ kJ·mol-1。
(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系是___________ ;随着温度的升高,K1_________ (填“减小”、“增大”或“不变”)。
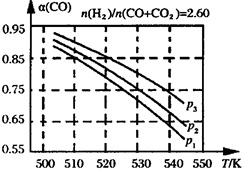
(3)合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如下图所示。图中压强由大到小的顺序为______________ 。
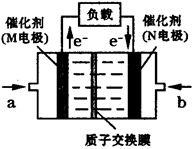
(4)下图是某研究机构开发的给笔记本电脑供电的甲醇燃料电池,甲醇在催化剂作用下提供质子(H+)和电子,电池总反应为:2CH3OH+3O2=2CO2+4H2O。
一个甲醇分子经过电化学氧化,可以产生_________ 个电子的电量,其负极的电极反应式为____________ 。

①CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2③CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:

由此计算△H1=
(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系是
(3)合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如下图所示。图中压强由大到小的顺序为

(4)下图是某研究机构开发的给笔记本电脑供电的甲醇燃料电池,甲醇在催化剂作用下提供质子(H+)和电子,电池总反应为:2CH3OH+3O2=2CO2+4H2O。
一个甲醇分子经过电化学氧化,可以产生
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】合成氨是人类科学技术上的一项重大突破,氨有广泛的应用。
已知:N2(g)+3H2(g) 2NH3(g) ∆H1=-a kJ∙mol-1;
2NH3(g) ∆H1=-a kJ∙mol-1;
2H2(g)+O2(g) 2H2O(l) ∆H2=-b kJ∙mol-1
2H2O(l) ∆H2=-b kJ∙mol-1
(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是___________ 。
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下H2的转化率为___________ (可用分数表示),平衡常数K=___________ (可用分数表示)。
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为___________ (填“正向”、“逆向”或“无法判断”)。
③L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。
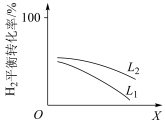
i.X代表的物理量是___________ 。
ii.判断L1、L2的大小关系,并简述理由___________ 。
已知:N2(g)+3H2(g)
 2NH3(g) ∆H1=-a kJ∙mol-1;
2NH3(g) ∆H1=-a kJ∙mol-1;2H2(g)+O2(g)
 2H2O(l) ∆H2=-b kJ∙mol-1
2H2O(l) ∆H2=-b kJ∙mol-1(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
物质 | N2 | H2 | NH3 |
平衡时物质的量/mol | 0.2 | 0.6 | 0.2 |
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为
物质 | N2 | H2 | NH3 |
起始浓度(mol/L) | 0.5 | 1.5 | 0.5 |

i.X代表的物理量是
ii.判断L1、L2的大小关系,并简述理由
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】联氨(N2H4)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
(1)工业上利用N2和H2合成NH3,用NH3进一步制备联氨N2H4。已知断开(或形成)1molN≡N键、H-H键分别需要吸收(或放出)948.9kJ、436.0kJ的热量,合成1molNH3可放出46.1kJ的热量,则形成1molN-H放出的热量为___________ kJ(保留一位小数)。
(2)发射航天器时常以N2H4为燃料,NO2为推进剂。
已知ⅰ.N2H4(g)的摩尔燃烧焓为-622kJ/mol。
ⅱ.N2(g)与O2(g)反应的物质和能量变化示意图如下:
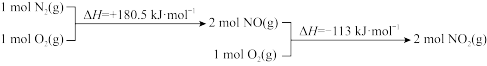
N2H4(g)与NO2(g)反应生成N2(g)和H2O(l)的热化学方程式为____________ 。
(3)燃料电池已广泛应用于航空领域。下图是一种新型燃料电池装置,其总反应方程式为N2H4+O2=N2+2H2O,通入N2H4(肼)的一极是电池的___________ (填“正极”或“负极”),该电极的电极反应式为___________ 。放电过程中,溶液中的阳离子移向___________ (填“正极”或“负极”)。
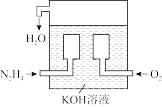
(4)在上述燃料电池中,若完全消耗16gN2H4,则理论上外电路中转移电子的物质的量为___________ mol,消耗氧气的体积为___________ L(标准状况)。
(1)工业上利用N2和H2合成NH3,用NH3进一步制备联氨N2H4。已知断开(或形成)1molN≡N键、H-H键分别需要吸收(或放出)948.9kJ、436.0kJ的热量,合成1molNH3可放出46.1kJ的热量,则形成1molN-H放出的热量为
(2)发射航天器时常以N2H4为燃料,NO2为推进剂。
已知ⅰ.N2H4(g)的摩尔燃烧焓为-622kJ/mol。
ⅱ.N2(g)与O2(g)反应的物质和能量变化示意图如下:
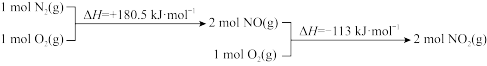
N2H4(g)与NO2(g)反应生成N2(g)和H2O(l)的热化学方程式为
(3)燃料电池已广泛应用于航空领域。下图是一种新型燃料电池装置,其总反应方程式为N2H4+O2=N2+2H2O,通入N2H4(肼)的一极是电池的

(4)在上述燃料电池中,若完全消耗16gN2H4,则理论上外电路中转移电子的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】燃煤烟气中含有 、CO、
、CO、 等气体,综合利用它们是科研的热点。
等气体,综合利用它们是科研的热点。
(1)已知:




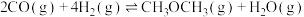

用 、
、 表示
表示 ,
,
___________ 。
(2)气体转化: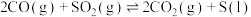
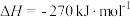 。
。
①相同条件下,分别选取 、NiO、
、NiO、 作上述反应的催化剂时,
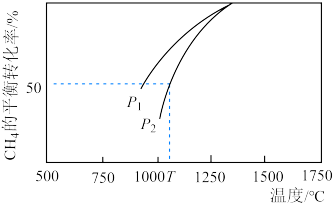
作上述反应的催化剂时, 的转化率随温度的变化如图所示,研究得出应该选择
的转化率随温度的变化如图所示,研究得出应该选择 作催化剂,主要原因可能是
作催化剂,主要原因可能是___________ 。
②若在2L恒容密闭容器中,将3mol CO、1mol 混合,在一定条件下引发反应,当
混合,在一定条件下引发反应,当 的平衡转化率为40%时,此时,K=
的平衡转化率为40%时,此时,K=___________ 。
③向反应容器中再分别通入下列气体,可以使 转化率增大的是
转化率增大的是___________ (填字母)。
a.CO b. c.
c. d.
d.
(3) 利用:密闭容器发生
利用:密闭容器发生 ,其中
,其中 与
与 的浓度均为0.1
的浓度均为0.1 ,在一定条件下反应,测得
,在一定条件下反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
___________  (填“>”或“<”=)。若
(填“>”或“<”=)。若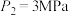 ,则T℃时该反应的平衡常数
,则T℃时该反应的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4) 捕捉:用100mL 0.1
捕捉:用100mL 0.1
 溶液完全捕捉0.22g
溶液完全捕捉0.22g  气体(溶液体积不变),所得溶液中
气体(溶液体积不变),所得溶液中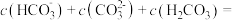
___________  ,此时溶液pH=a,
,此时溶液pH=a,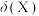 [分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则
[分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则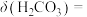
___________ (用含a、b、c的式子表示)。(已知 的两步电离常数
的两步电离常数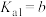 ,
,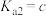 )
)
 、CO、
、CO、 等气体,综合利用它们是科研的热点。
等气体,综合利用它们是科研的热点。(1)已知:




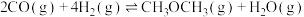

用
 、
、 表示
表示 ,
,
(2)气体转化:
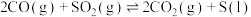
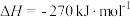 。
。①相同条件下,分别选取
 、NiO、
、NiO、 作上述反应的催化剂时,
作上述反应的催化剂时, 的转化率随温度的变化如图所示,研究得出应该选择
的转化率随温度的变化如图所示,研究得出应该选择 作催化剂,主要原因可能是
作催化剂,主要原因可能是
②若在2L恒容密闭容器中,将3mol CO、1mol
 混合,在一定条件下引发反应,当
混合,在一定条件下引发反应,当 的平衡转化率为40%时,此时,K=
的平衡转化率为40%时,此时,K=③向反应容器中再分别通入下列气体,可以使
 转化率增大的是
转化率增大的是a.CO b.
 c.
c. d.
d.
(3)
 利用:密闭容器发生
利用:密闭容器发生 ,其中
,其中 与
与 的浓度均为0.1
的浓度均为0.1 ,在一定条件下反应,测得
,在一定条件下反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
 (填“>”或“<”=)。若
(填“>”或“<”=)。若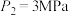 ,则T℃时该反应的平衡常数
,则T℃时该反应的平衡常数
 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)
 捕捉:用100mL 0.1
捕捉:用100mL 0.1
 溶液完全捕捉0.22g
溶液完全捕捉0.22g  气体(溶液体积不变),所得溶液中
气体(溶液体积不变),所得溶液中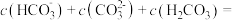
 ,此时溶液pH=a,
,此时溶液pH=a,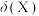 [分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则
[分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则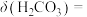
 的两步电离常数
的两步电离常数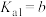 ,
,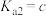 )
)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g) +H2O(g) CO(g)+3H2(g) △H= +216.4 kJ /mol
CO(g)+3H2(g) △H= +216.4 kJ /mol
b.CO(g) +H2O(g) ⇌CO2(g)+H2(g) △H =-41.2 kJ/mol
则反应CH4(g) +2H2O(g)⇌ CO2(g)+4H2(g) △H=_________ 。
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如下图。
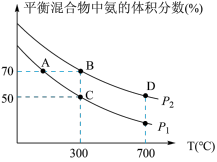
①恒压时,反应一定达到平衡状态的标志是______ (填序号);
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.c(H2)/c(NH3) 比值保持不变 D.c(NH3)/c(N2) 等于2
②P1_____ P2 (填“ > ”、“< ”、“=”,下同);反应平衡常数:B点____ D点;
③在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:υ(A)______ υ(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO 反应生成N2H4的化学方程式__________ ;
②已知25℃时N2H4水溶液呈弱碱性:
N2H4+H2O⇌N2H5++OH- K1= 1×10-a;
N2H5++H2O⇌N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围_________ (用含a、b式子表示)。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g) +H2O(g)
 CO(g)+3H2(g) △H= +216.4 kJ /mol
CO(g)+3H2(g) △H= +216.4 kJ /molb.CO(g) +H2O(g) ⇌CO2(g)+H2(g) △H =-41.2 kJ/mol
则反应CH4(g) +2H2O(g)⇌ CO2(g)+4H2(g) △H=
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如下图。

①恒压时,反应一定达到平衡状态的标志是
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.c(H2)/c(NH3) 比值保持不变 D.c(NH3)/c(N2) 等于2
②P1
③在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:υ(A)
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO 反应生成N2H4的化学方程式
②已知25℃时N2H4水溶液呈弱碱性:
N2H4+H2O⇌N2H5++OH- K1= 1×10-a;
N2H5++H2O⇌N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围
您最近一年使用:0次
【推荐1】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。
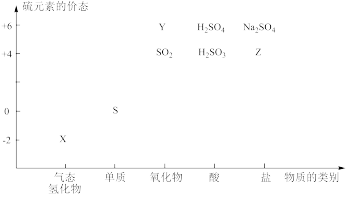
(1)图中X的电子式为_________ ;其水溶液长期在空气中放置容易变浑浊,写出该反应的化学方程式_________ 。
(2)下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______ (填字母序号)。
a. Na2S +S b. Z+S c. Na2SO3+Y d. NaHS+NaHSO3
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
已知:①CO(g)+ O2(g)=CO2(g) ΔH=-283 kJ·mol-1
O2(g)=CO2(g) ΔH=-283 kJ·mol-1
②S(s)+ O2(g)=SO2(g) ΔH=-296 kJ·mol-1
①则治理烟道气反应的热化学方程式为__________ 。
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是__________ (填写字母序号)。
a.v (CO) ∶v(SO2) = 2∶1 b.c(CO)∶c(SO2)∶c(CO2) =2∶1∶2
c.气体密度不变 d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为 ,则SO2的转化率为
,则SO2的转化率为__________ 。
(4)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05mol∙L﹣1的Na2SO3溶液与20 mL 0.02mol∙L﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为________ 。

(1)图中X的电子式为
(2)下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是
a. Na2S +S b. Z+S c. Na2SO3+Y d. NaHS+NaHSO3
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
已知:①CO(g)+
 O2(g)=CO2(g) ΔH=-283 kJ·mol-1
O2(g)=CO2(g) ΔH=-283 kJ·mol-1②S(s)+ O2(g)=SO2(g) ΔH=-296 kJ·mol-1
①则治理烟道气反应的热化学方程式为
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是
a.v (CO) ∶v(SO2) = 2∶1 b.c(CO)∶c(SO2)∶c(CO2) =2∶1∶2
c.气体密度不变 d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为
 ,则SO2的转化率为
,则SO2的转化率为(4)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05mol∙L﹣1的Na2SO3溶液与20 mL 0.02mol∙L﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】碳及其化合物在化工生产中有着广泛的应用。
I.合成二甲醚的三步反应如下:
2H2(g)+CO(g) CH3OH(g)ΔH1
CH3OH(g)ΔH1
2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH2
CH3OCH3(g)+H2O(g)ΔH2
CO(g)+H2O(g) CO2(g)+H2(g)ΔH3
CO2(g)+H2(g)ΔH3
(1)3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH是_______。
CH3OCH3(g)+CO2(g)的ΔH是_______。
II.在容积固定的密闭容器中,发生反应CO2(g)+H2(g) CO(g)+H2O(g),化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),化学平衡常数K和温度t的关系如下表:
请回答下列问题:
(2)该反应的化学平衡常数表达式为K=_______ 。
(3)该反应为_______ 反应(填“吸热”或“放热”)。
(4)不能判断该反应达到化学平衡状态的是_______ (填字母)。
a.容器中总压强不变 b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等 d.c(CO2)=c(CO)
(5)若1200℃时,在某时刻反应混合物中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的平衡移动方向为_______ (填“正反应方向”“逆反应方向”或“不移动”)。
I.合成二甲醚的三步反应如下:
2H2(g)+CO(g)
 CH3OH(g)ΔH1
CH3OH(g)ΔH12CH3OH(g)
 CH3OCH3(g)+H2O(g)ΔH2
CH3OCH3(g)+H2O(g)ΔH2CO(g)+H2O(g)
 CO2(g)+H2(g)ΔH3
CO2(g)+H2(g)ΔH3(1)3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的ΔH是_______。
CH3OCH3(g)+CO2(g)的ΔH是_______。| A.ΔH=2ΔH1+ΔH2+ΔH3 | B.ΔH=ΔH1+ΔH2+ΔH3 |
| C.ΔH=ΔH1+2ΔH2+2ΔH3 | D.ΔH=2ΔH1+ΔH2ΔH3 |
II.在容积固定的密闭容器中,发生反应CO2(g)+H2(g)
 CO(g)+H2O(g),化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),化学平衡常数K和温度t的关系如下表:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(2)该反应的化学平衡常数表达式为K=
(3)该反应为
(4)不能判断该反应达到化学平衡状态的是
a.容器中总压强不变 b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等 d.c(CO2)=c(CO)
(5)若1200℃时,在某时刻反应混合物中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的平衡移动方向为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】研究和开发CO、CO2的应用对构建人类的生态文明建设有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为__________ 。
(2)电子工业中使用的一氧化碳常以甲醇为原料CH3OH=CO + 2H2,该反应是经历脱氢、分解两步反应实现的。
ⅰ(脱氢):2CH3OH HCOOCH3 + 2H2
HCOOCH3 + 2H2
ⅱ(分解): ……
①ⅰ(脱氢)反应的机理可以用下图表示:图中中间产物X的结构简式为________ 。
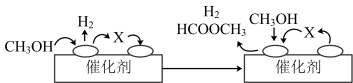
②写出ⅱ(分解)反应的化学方程式____________ 。
(3)科学家们积极探讨控制温室气体CO2的排放,减缓全球变暖措施和方法。
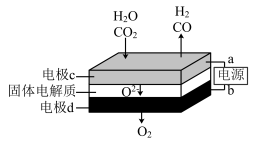
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为:____________ 。
②固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c上发生的电极反应式:_________ 、_________ 。
(4)催化剂可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图。
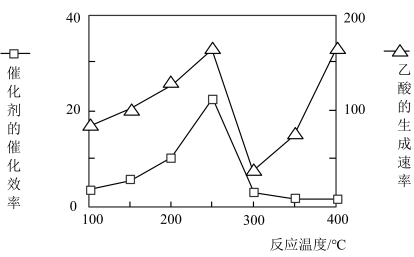
在250-300℃过程中影响速率的主要因素是___________ ;在300-400℃过程中影响速率的主要因素是___________ 。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为
(2)电子工业中使用的一氧化碳常以甲醇为原料CH3OH=CO + 2H2,该反应是经历脱氢、分解两步反应实现的。
ⅰ(脱氢):2CH3OH
 HCOOCH3 + 2H2
HCOOCH3 + 2H2ⅱ(分解): ……
①ⅰ(脱氢)反应的机理可以用下图表示:图中中间产物X的结构简式为

②写出ⅱ(分解)反应的化学方程式
(3)科学家们积极探讨控制温室气体CO2的排放,减缓全球变暖措施和方法。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为:
②固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c上发生的电极反应式:

(4)催化剂可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图。

在250-300℃过程中影响速率的主要因素是
您最近一年使用:0次



