研究和开发CO、CO2的应用对构建人类的生态文明建设有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为__________ 。
(2)电子工业中使用的一氧化碳常以甲醇为原料CH3OH=CO + 2H2,该反应是经历脱氢、分解两步反应实现的。
ⅰ(脱氢):2CH3OH HCOOCH3 + 2H2
HCOOCH3 + 2H2
ⅱ(分解): ……
①ⅰ(脱氢)反应的机理可以用下图表示:图中中间产物X的结构简式为________ 。
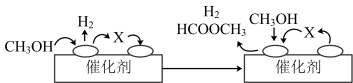
②写出ⅱ(分解)反应的化学方程式____________ 。
(3)科学家们积极探讨控制温室气体CO2的排放,减缓全球变暖措施和方法。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为:____________ 。
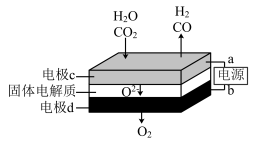
②固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c上发生的电极反应式:_________ 、_________ 。
(4)催化剂可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图。
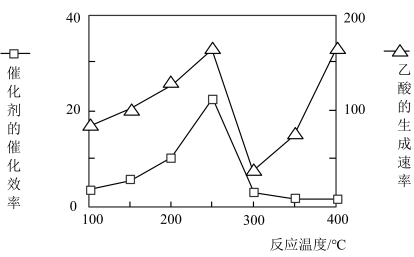
在250-300℃过程中影响速率的主要因素是___________ ;在300-400℃过程中影响速率的主要因素是___________ 。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为
(2)电子工业中使用的一氧化碳常以甲醇为原料CH3OH=CO + 2H2,该反应是经历脱氢、分解两步反应实现的。
ⅰ(脱氢):2CH3OH
 HCOOCH3 + 2H2
HCOOCH3 + 2H2ⅱ(分解): ……
①ⅰ(脱氢)反应的机理可以用下图表示:图中中间产物X的结构简式为

②写出ⅱ(分解)反应的化学方程式
(3)科学家们积极探讨控制温室气体CO2的排放,减缓全球变暖措施和方法。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为:
②固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c上发生的电极反应式:

(4)催化剂可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图。

在250-300℃过程中影响速率的主要因素是
更新时间:2018-06-06 11:31:13
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】请用相关化学知识回答下列问题。
(1)铬元素可表现出多种颜色,如 (黄),
(黄), (橙),Cr2+(蓝)等。室温下,Na2Cr2O7溶于水时发生的离子方程式为
(橙),Cr2+(蓝)等。室温下,Na2Cr2O7溶于水时发生的离子方程式为_______ ,若增强溶液酸性,溶液的颜色会_______ (填“不变”“变黄”或“变橙”)
(2)微波炉将电能转变成一定频率的微波穿透食物,食物内的极性分子(如水、脂肪、蛋白质、糖等)被吸引振荡而加热食物。将盛有牛奶的陶瓷杯放入微波炉加热,牛奶和杯子相比更易热的是_______ 。
(3)雪冰和石墨一般是六方晶系(如图)。1mol石墨碳原子含有的σ键数目是_______ 个,冰中平均每个水分子含有氢键的数目是_______ ,冰中的水分子排列方向是否相同_______ (填“是”或“否”)。

(4)钒催化剂参与SO2(g)+ O2(g)
O2(g) SO3(g) ΔH=−98kJ·mol−1反应的能量变化如图所示。SO3的VSEPR模型名称为
SO3(g) ΔH=−98kJ·mol−1反应的能量变化如图所示。SO3的VSEPR模型名称为_______ ,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:_______ 。

(1)铬元素可表现出多种颜色,如
 (黄),
(黄), (橙),Cr2+(蓝)等。室温下,Na2Cr2O7溶于水时发生的离子方程式为
(橙),Cr2+(蓝)等。室温下,Na2Cr2O7溶于水时发生的离子方程式为(2)微波炉将电能转变成一定频率的微波穿透食物,食物内的极性分子(如水、脂肪、蛋白质、糖等)被吸引振荡而加热食物。将盛有牛奶的陶瓷杯放入微波炉加热,牛奶和杯子相比更易热的是
(3)雪冰和石墨一般是六方晶系(如图)。1mol石墨碳原子含有的σ键数目是

(4)钒催化剂参与SO2(g)+
 O2(g)
O2(g) SO3(g) ΔH=−98kJ·mol−1反应的能量变化如图所示。SO3的VSEPR模型名称为
SO3(g) ΔH=−98kJ·mol−1反应的能量变化如图所示。SO3的VSEPR模型名称为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氮氧化物在含能材料、医药等方面有着广泛应用。请回答:
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O2(g);△H>0
4NO2(g)+O2(g);△H>0
下面表1、表2为反应在T1、T2温度下不同时刻的部分实验数据:
下列描述正确的是___________ 。
A. T1温度下在500s时,反应未达到平衡,且v正大于v逆
B.T2大于T1
C.当容器中的压强不再变化时说明该反应达到平衡状态
D.平衡时,v正=v逆=0
(2)在N2O4与NO2之间存在反应:N2O4(g) 2NO2(g)。将1 mol N2O4放入1 L恒容密闭容器中,测得其平衡转化率α(N2O4)随温度变化如图所示。
2NO2(g)。将1 mol N2O4放入1 L恒容密闭容器中,测得其平衡转化率α(N2O4)随温度变化如图所示。
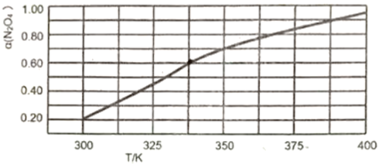
①337.5K时,反应平衡常数K=___________ 。
②已知:2SO2(g)+O2(g) 2SO3(g) △H= -196.6 kJ/mol
2SO3(g) △H= -196.6 kJ/mol
2NO(g)+O2(g)=2NO2(g) △H= -113.0 kJ/mol
则反应NO2(g)+ SO2(g)=SO3(g)+ NO(g)的△H=___________ kJ/mol。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)
 4NO2(g)+O2(g);△H>0
4NO2(g)+O2(g);△H>0 下面表1、表2为反应在T1、T2温度下不同时刻的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.40 |
| c(NO2)/mol·L-1 | 0 | 2.96 | a |
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L-1 | 5.00 | b1 | 2.40 |
| c(NO2)/mol·L-1 | 0 | b2 | 4.80 |
下列描述正确的是
A. T1温度下在500s时,反应未达到平衡,且v正大于v逆
B.T2大于T1
C.当容器中的压强不再变化时说明该反应达到平衡状态
D.平衡时,v正=v逆=0
(2)在N2O4与NO2之间存在反应:N2O4(g)
 2NO2(g)。将1 mol N2O4放入1 L恒容密闭容器中,测得其平衡转化率α(N2O4)随温度变化如图所示。
2NO2(g)。将1 mol N2O4放入1 L恒容密闭容器中,测得其平衡转化率α(N2O4)随温度变化如图所示。
①337.5K时,反应平衡常数K=
②已知:2SO2(g)+O2(g)
 2SO3(g) △H= -196.6 kJ/mol
2SO3(g) △H= -196.6 kJ/mol2NO(g)+O2(g)=2NO2(g) △H= -113.0 kJ/mol
则反应NO2(g)+ SO2(g)=SO3(g)+ NO(g)的△H=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】聚合硫酸铁(PFS) 是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣 (有效成分为Fe2O3和Fe3O4) 制备PFS,其工艺流程如下图所示。
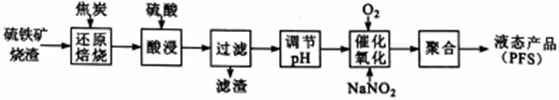
(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为___________________________ 。
已知:Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1
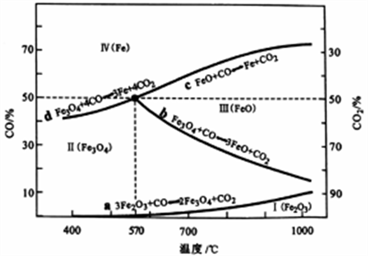
(2)CO是“还原焙烧" 过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于_________ (填“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K=_________________ 。
(3)工业上,“还原培烧”的温度一般控制在800℃左右,温度不宜过高的理由是____________________ 。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是___________________________ 。
(5)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤_____________ 。
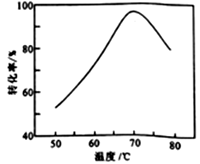
(6)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为_________________________ 。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是_______________________________ 。

(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为
已知:Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1
(2)CO是“还原焙烧" 过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于

(3)工业上,“还原培烧”的温度一般控制在800℃左右,温度不宜过高的理由是
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是
(5)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤
(6)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】乙醇是一种重要的工业原料,广泛应用于能源、化工、食品等领域。
Ⅰ.工业上乙烯水化制乙醇过程中能量变化如图所示:
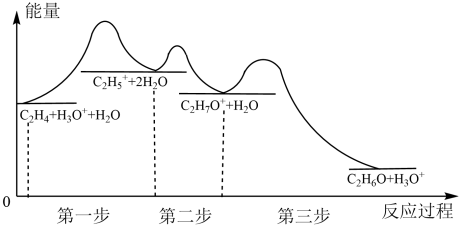
(1)图中所示活化能最大的步骤是第_______ 步。
(2)写出该反应过程中速率最快的基元反应:_______ 。
Ⅱ.研究显示乙酸甲酯催化加氢也可以制取乙醇,主要反应如下:
①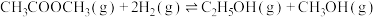
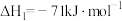
②

(3)已知反应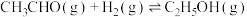 的
的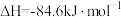 ,则
,则
_______ 。
(4)在体积密闭容器中进行上述反应时发现, 流速过大时乙酸甲酯的转化率下降,其原因可能是
流速过大时乙酸甲酯的转化率下降,其原因可能是_______ 。
Ⅲ.乙醇的一种重要用途是与乙酸反应合成乙酸乙酯。已知纯物质和相关恒沸混合物的常压沸点如下表:
(5)实际生产中,一般控制乙酸过量。若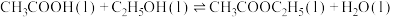
 ,则控制乙酸过量的作用有
,则控制乙酸过量的作用有_______ 。
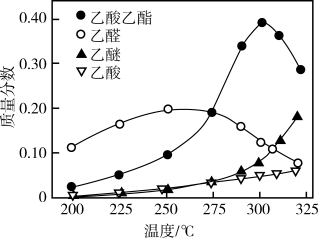
(6)一种新的乙醇催化合成乙酸乙酯的方法如下: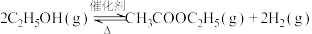 。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
Ⅰ.工业上乙烯水化制乙醇过程中能量变化如图所示:

(1)图中所示活化能最大的步骤是第
(2)写出该反应过程中速率最快的基元反应:
Ⅱ.研究显示乙酸甲酯催化加氢也可以制取乙醇,主要反应如下:
①
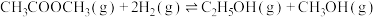
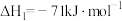
②


(3)已知反应
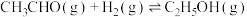 的
的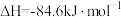 ,则
,则
(4)在体积密闭容器中进行上述反应时发现,
 流速过大时乙酸甲酯的转化率下降,其原因可能是
流速过大时乙酸甲酯的转化率下降,其原因可能是Ⅲ.乙醇的一种重要用途是与乙酸反应合成乙酸乙酯。已知纯物质和相关恒沸混合物的常压沸点如下表:
| 纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
| 乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
| 乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
| 乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08)+水(0.09) | 70.2 |
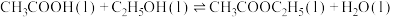
 ,则控制乙酸过量的作用有
,则控制乙酸过量的作用有(6)一种新的乙醇催化合成乙酸乙酯的方法如下:
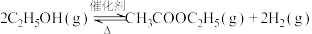 。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
| A.该反应的最宜温度应为325℃ |
| B.适当减小体系压强,有利于提高乙醇平衡转化率 |
| C.在催化剂作用下,乙醚是反应历程中的中间产物 |
| D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】以 为还原剂的选择性催化还原(NH3-SCR)技术是消除氮氧化物(NOx)污染的重要方法。
为还原剂的选择性催化还原(NH3-SCR)技术是消除氮氧化物(NOx)污染的重要方法。
(1) 法消除
法消除 (主要成分为NO)时同时发生如下3个反应:
(主要成分为NO)时同时发生如下3个反应:
①标准SCR反应: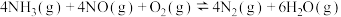
②快速SCR反应:
③慢速SCR反应:
消除氮氧化物时,需先通过预氧化催化器将 中部分NO转成
中部分NO转成 ,使其物质的量之比约为1∶1,主要目的是
,使其物质的量之比约为1∶1,主要目的是_______ 。
(2)其他条件相同,在2L密闭容器中加入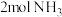 、2mol NO和
、2mol NO和 ,分别在甲、乙两种催化剂作用下发生如下反应:
,分别在甲、乙两种催化剂作用下发生如下反应: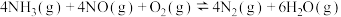
 。反应相同时间后,测得NO的转化率与温度的关系如图所示。
。反应相同时间后,测得NO的转化率与温度的关系如图所示。

①在催化剂甲作用下、100~210℃范围内,随着反应温度升高,NO的转化率逐渐增大的原因是_______ 。
②图中X点对应的反应体系中, 的物质的量分数为
的物质的量分数为_______ 。
(3)根据 和
和 在催化剂表面吸附状态,
在催化剂表面吸附状态, 反应存在两种可能的反应机理:
反应存在两种可能的反应机理:
E-R机理: 先吸附在催化剂表面形成吸附态,吸附态
先吸附在催化剂表面形成吸附态,吸附态 与气态(非吸附态)
与气态(非吸附态) 反应生成过渡态中间产物,进一步分解为
反应生成过渡态中间产物,进一步分解为 和
和 。
。
L-H机理: 与
与 均被吸附形成吸附态,吸附态
均被吸附形成吸附态,吸附态 与相邻的吸附态
与相邻的吸附态 反应生成
反应生成 和
和 。
。
为了探究 还原NO反应的机理,在相同条件下,将
还原NO反应的机理,在相同条件下,将 和NO分别匀速通入装有催化剂的反应器,测得反应器出口
和NO分别匀速通入装有催化剂的反应器,测得反应器出口 、NO浓度随时间变化曲线如图所示。
、NO浓度随时间变化曲线如图所示。

①能证明该反应机理为E-R的证据是_______
②研究发现:其他条件不变时,增大NH3的浓度,NO的转化速率几乎不变,原因可能是________
 为还原剂的选择性催化还原(NH3-SCR)技术是消除氮氧化物(NOx)污染的重要方法。
为还原剂的选择性催化还原(NH3-SCR)技术是消除氮氧化物(NOx)污染的重要方法。(1)
 法消除
法消除 (主要成分为NO)时同时发生如下3个反应:
(主要成分为NO)时同时发生如下3个反应:①标准SCR反应:
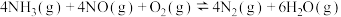
②快速SCR反应:

③慢速SCR反应:

消除氮氧化物时,需先通过预氧化催化器将
 中部分NO转成
中部分NO转成 ,使其物质的量之比约为1∶1,主要目的是
,使其物质的量之比约为1∶1,主要目的是(2)其他条件相同,在2L密闭容器中加入
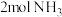 、2mol NO和
、2mol NO和 ,分别在甲、乙两种催化剂作用下发生如下反应:
,分别在甲、乙两种催化剂作用下发生如下反应: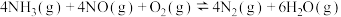
 。反应相同时间后,测得NO的转化率与温度的关系如图所示。
。反应相同时间后,测得NO的转化率与温度的关系如图所示。
①在催化剂甲作用下、100~210℃范围内,随着反应温度升高,NO的转化率逐渐增大的原因是
②图中X点对应的反应体系中,
 的物质的量分数为
的物质的量分数为(3)根据
 和
和 在催化剂表面吸附状态,
在催化剂表面吸附状态, 反应存在两种可能的反应机理:
反应存在两种可能的反应机理:E-R机理:
 先吸附在催化剂表面形成吸附态,吸附态
先吸附在催化剂表面形成吸附态,吸附态 与气态(非吸附态)
与气态(非吸附态) 反应生成过渡态中间产物,进一步分解为
反应生成过渡态中间产物,进一步分解为 和
和 。
。L-H机理:
 与
与 均被吸附形成吸附态,吸附态
均被吸附形成吸附态,吸附态 与相邻的吸附态
与相邻的吸附态 反应生成
反应生成 和
和 。
。为了探究
 还原NO反应的机理,在相同条件下,将
还原NO反应的机理,在相同条件下,将 和NO分别匀速通入装有催化剂的反应器,测得反应器出口
和NO分别匀速通入装有催化剂的反应器,测得反应器出口 、NO浓度随时间变化曲线如图所示。
、NO浓度随时间变化曲线如图所示。
①能证明该反应机理为E-R的证据是
②研究发现:其他条件不变时,增大NH3的浓度,NO的转化速率几乎不变,原因可能是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】H2O2被称为绿色氧化剂,其性质的研究极其重要。某同学以H2O2分解为例,按照表中数据探究温度、浓度、催化剂、酸对反应速率的影响。
(1)在实验①和②中,H2O2分解速率较快的是_______ ,实验②和③的目的是_______ ;
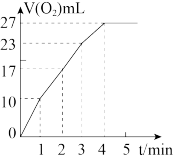
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图所示。分析该图能够得出的实验结论是_______ 。

III.如图:另一个同学将状态不同的1gMnO2分别加入盛有30mL等浓度的H2O2溶液的锥形瓶中,产生气体进入注射器针筒中,记录结果如表:
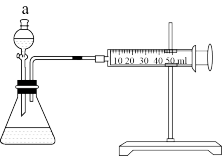
(3)锥形瓶中发生反应的化学方程式_______ ,该反应是_______ 反应(填“放热”或“吸热”),装置a的名称_______ ,实验结果表明,催化剂的催化效果与_______ 有关。
(4)实验过程中放出气体的体积(标准状况)和时间的关系如图所示。解释反应速率变化的原因_______ 。
| 编号 | 反应物 | 催化剂 | 温度 |
| ① | 20mL2%H2O2溶液+2mLH2O | 无 | 20℃ |
| ② | 20mL5%H2O2溶液+2mLH2O | 无 | 20℃ |
| ③ | 20mL5%H2O2溶液+2mLH2O | 1g粉末状MnO2 | 20℃ |
| ④ | 20mL5%H2O2溶液+2mL1mol/LHCl溶液 | 1g粉末状MnO2 | 20℃ |
| ⑤ | 20mL5%H2O2溶液+2mLH2O | 1g粉末状MnO2 | 40℃ |
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图所示。分析该图能够得出的实验结论是

III.如图:另一个同学将状态不同的1gMnO2分别加入盛有30mL等浓度的H2O2溶液的锥形瓶中,产生气体进入注射器针筒中,记录结果如表:

| MnO2状态 | 触摸试管情况 | 该温度下针筒内收集到气体的体积 | 所需时间 |
| 粉末状 | 很烫 | 30mL | 3min |
| 块状 | 微热 | 30mL | 9min |
(4)实验过程中放出气体的体积(标准状况)和时间的关系如图所示。解释反应速率变化的原因

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮及其化合物在工农业生产和生命活动中起着重要的作用。同时,氮氧化物(NOx)是常见的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。因此,研究氮氧化物(NOx)的无害化处理对治理大气污染、建设生态文明具有重要意义。请按要求回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬在现代工业中发挥着重要的作用。基态铬、氮原子的未成对电子数之比为__________ 。
(2)联氨(又称肼,N2H4,无色液体)也是氮的一种重要的化合物,是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方程式与氨相似,联氨的第一步电离方程式为___________ 。
(3)研究氮氧化物(NOx)的无害化处理
I.CO还原NO2的反应原理如下:
已知:①NO2(g)+CO(g) CO2(g)+NO(g) ΔH1= -234kJ·mol-1
CO2(g)+NO(g) ΔH1= -234kJ·mol-1
②N2(g)+O2(g) 2NO(g) ΔH2= +179.5 kJ·mol-1
2NO(g) ΔH2= +179.5 kJ·mol-1
③2NO(g)+O2(g) 2NO2(g) ΔH3=-112.3 kJ·mol-1
2NO2(g) ΔH3=-112.3 kJ·mol-1
NO2与CO反应生成无污染气体的热化学方程式为__________________________ 。
II.用H2还原NO的反应为2H2(g) + 2NO(g) N2(g) + 2H2O(g) ΔH =-752 kJ·mol-1。为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:
N2(g) + 2H2O(g) ΔH =-752 kJ·mol-1。为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:
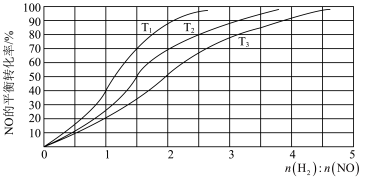
①反应温度T1、T2、T3从高到低的关系为______________________ ;
②T1温度下,充入H2、NO分别为3mol、3mol, 容器内的压强为w Pa,反应进行到10min时达平衡,0~ 10min内N2的平均反应速率为_____________ mol·L-1·s-1,该反应的平衡常数Kp=___________ (写出计算表达式,以分压表示的平衡常数为Kp,某气体分压=总压 ×某气体物质的量分数);
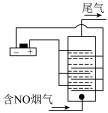
III.以铂为电极,饱和食盐水作电解液,对含有NO的烟气进行脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为 ,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的原理为
,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的原理为___________________________ (用电极反应和离子方程式表示)
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬在现代工业中发挥着重要的作用。基态铬、氮原子的未成对电子数之比为
(2)联氨(又称肼,N2H4,无色液体)也是氮的一种重要的化合物,是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方程式与氨相似,联氨的第一步电离方程式为
(3)研究氮氧化物(NOx)的无害化处理
I.CO还原NO2的反应原理如下:
已知:①NO2(g)+CO(g)
 CO2(g)+NO(g) ΔH1= -234kJ·mol-1
CO2(g)+NO(g) ΔH1= -234kJ·mol-1②N2(g)+O2(g)
 2NO(g) ΔH2= +179.5 kJ·mol-1
2NO(g) ΔH2= +179.5 kJ·mol-1③2NO(g)+O2(g)
 2NO2(g) ΔH3=-112.3 kJ·mol-1
2NO2(g) ΔH3=-112.3 kJ·mol-1NO2与CO反应生成无污染气体的热化学方程式为
II.用H2还原NO的反应为2H2(g) + 2NO(g)
 N2(g) + 2H2O(g) ΔH =-752 kJ·mol-1。为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:
N2(g) + 2H2O(g) ΔH =-752 kJ·mol-1。为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图: 
①反应温度T1、T2、T3从高到低的关系为
②T1温度下,充入H2、NO分别为3mol、3mol, 容器内的压强为w Pa,反应进行到10min时达平衡,0~ 10min内N2的平均反应速率为
III.以铂为电极,饱和食盐水作电解液,对含有NO的烟气进行脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为
 ,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的原理为
,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的原理为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】高纯镓是用来制作光学玻璃、真空管、半导体的重要原料。工业上由锌粉置换渣(主要成分有Ga2O3、Ga2S3、ZnS、FeO、Fe2O3、SiO2,还有部分锗元素)制备高纯镓的主要流程如图:

已知:①镓与铝性质相似;
②不同的萃取剂对微粒的选择性不同,N235型萃取剂优先萃取铁;P204+YW100协萃体系优先萃取离子的顺序是:Ge(Ⅳ)>Fe(Ⅲ)>Ga(Ⅲ)>Fe(Ⅱ)>Zn(Ⅱ)。
回答下列问题:
(1)二段浸出渣的成分是S和___ (填化学式),富氧浸出时通入氧气的作用是___ ,进行两段富氧浸出的目的是___ 。
(2)N235萃取和P204+YW100萃取的顺序不可以调换,说明原因___ 。
(3)中和沉镓时发生反应的离子反应方程式为____ ,选用Na2CO3中和沉镓优于选用NaOH的原因是____ 。
(4)生成粗镓的电极反应式为____ 。
(5)一定温度下,影响Fe3+在N235型萃取剂中溶解度大小的主要因素是___ ,真空蒸馏采用真空的原因是____ 。

已知:①镓与铝性质相似;
②不同的萃取剂对微粒的选择性不同,N235型萃取剂优先萃取铁;P204+YW100协萃体系优先萃取离子的顺序是:Ge(Ⅳ)>Fe(Ⅲ)>Ga(Ⅲ)>Fe(Ⅱ)>Zn(Ⅱ)。
回答下列问题:
(1)二段浸出渣的成分是S和
(2)N235萃取和P204+YW100萃取的顺序不可以调换,说明原因
(3)中和沉镓时发生反应的离子反应方程式为
(4)生成粗镓的电极反应式为
(5)一定温度下,影响Fe3+在N235型萃取剂中溶解度大小的主要因素是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义。
(1)二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为____________ 。
向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是:_________________ 。
(2)电解法是目前研究最为热门的生产ClO2的方法之一。下图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。

①电源负极为_______ 极(填A或B):
②写出阴极室发生反应依次为:______________________ 、______________________ ;
(3)已知:
2SO2(g)+ O2 (g) 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g) 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g) SO3 (g) +NO(g)的△H =
SO3 (g) +NO(g)的△H = _______________ kJ·mol-1
一定条件下,将体积比为1:2的NO2(g)、 SO2 (g)置于密闭容器中发生上述反应,测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=______ 。
(1)二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为
向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是:
(2)电解法是目前研究最为热门的生产ClO2的方法之一。下图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。

①电源负极为
②写出阴极室发生反应依次为:
(3)已知:
2SO2(g)+ O2 (g)
 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-12NO(g)+ O2 (g)
 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1则反应NO2(g)+ SO2 (g)
 SO3 (g) +NO(g)的△H =
SO3 (g) +NO(g)的△H = 一定条件下,将体积比为1:2的NO2(g)、 SO2 (g)置于密闭容器中发生上述反应,测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=
您最近一年使用:0次



